菊苣总黄酮缓解酒精所致小鼠急性肝损伤
庞佳慧,徐福飞, 3,江海涛,李盛杰,霍光明,吴雨龙*
(1. 南京晓庄学院 食品科学学院,江苏 南京 211171;2. 江苏省高校“特殊生物质废弃物资源化利用”重点建设实验室,江苏 南京 211171;3. 南京师范大学 生命科学学院,江苏 南京 210046)
各式各样的酒因其独特的口味而在世界各地广受欢迎.随着酒消费量的大大增加,肝脏疾病也随之增加.近年来,酒精性肝病(alcoholic liver disease,ALD)的发病率一直在逐年上升.长期或过量饮酒已经成为导致肝病的最主要因素之一[1].ALD主要包括酒精性脂肪肝、肝炎、肝纤维化等,如不加以控制将最终发展成为肝癌[2].目前,临床上仍然没有有效治疗ALD的药物.ALD可能的发病机制主要包括与酒精代谢有关的氧化应激损伤、蛋氨酸代谢异常、炎症介质损伤、营养失衡等[3].现已证明体内酒精代谢过程中的氧化应激可诱导肝脏线粒体功能障碍、脂肪变性、炎症和纤维化[4-7].因此,调节肝脏炎症,调控ALD肝脏氧化应激反应机制,减少肝脏炎症和免疫损伤反应,可为ALD的防治提供新的靶点.
菊苣,菊科菊苣属,系维吾尔族习用药材,具有清肝利胆,健胃消食,利尿消肿等功效.菊苣富含黄酮类、多酚类、多糖、菊苣酸等多种功能活性成分[8].Mohafrash等[9]发现菊苣和洋蓟叶的草药糖浆可通过增加体重及抗氧化酶、减少脂质过氧化作用来改善溴氰菊酯对断奶雄性大鼠的肝损伤.Wu等[10]研究表明菊苣多糖通过激活AMPK信号通路来减轻高脂肪饮食诱导的非酒精性脂肪性肝病.Keshk等[11]证明在膳食中添加菊苣可以缓解氧化应激并通过AMPK/SIRT1/FXR信号通路中断炎症通路来有效预防硫代乙酰胺诱导的肝损伤、纤维化和肝硬化.然而,有关菊苣总黄酮(Chicory total flavonoids, CTF)的肝保护特性尚未在动物体内进行实验探索,因此,本研究探究了CTF对急性酒精性肝病小鼠模型的作用,为研制开发菊苣保肝食品或天然药物提供参考.
1 材料与方法
1.1 材料与试剂
菊苣总黄酮(CTF)由南京晓庄学院食品科学学院生物功能分子研究室提供.
雄性ICR小白鼠,动物合格证号:SCXK(苏)2017-0001,体质量18~22 g,南京市江宁区青龙山动物繁殖场提供;总胆固醇(TC)和甘油三酯(TG)试剂盒(北京北华康泰临床试剂有限公司);谷草转氨酶(AST)测试盒、谷丙转氨酶(ALT)测试盒、谷胱甘肽过氧化物酶(GSH-PX)测试盒、丙二醛(MDA)测试盒、蛋白定量测试盒、微量还原型谷胱甘肽(GSH)测试盒、超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所);Trizol Reagent(赛默飞世尔科技有限公司);PrimeScriptTMII第一链cDNA合成试剂盒和SYBR Premix Ex Taq TM II(日本TaKaRa公司);其他试剂均为分析纯.
1.2 仪器与设备
BioTek 多功能酶标仪、ELx50 洗板机(美国BioTek 仪器有限公司);H600L 尼康显微镜(日本尼康公司);ND-1000 微量紫外可见分光光度计(美国Nanodrop公司);Mx3000P 荧光定量PCR仪(美国Stratagene公司);Mikro-22R 高速冷冻离心机(德国Andreas Hettich GmbH8 CO.KG).
1.3 实验方法
1.3.1 CTF的制备
取100.0 g菊苣粉末于烧杯中,加入3700 mL的70%乙醇溶液,按照菊苣粉末量加入2.2%的混合酶(纤维素酶和果胶酶),搅拌均匀,封上保鲜膜,酶解66 min后,将烧杯放入95 ℃水中10 min灭酶,接着用超声波处理(超声功率59 W,超声时间24 min)提取液,抽滤,得澄清滤液,浓缩后经聚酰胺树脂70%乙醇洗脱纯化,洗脱液浓缩,冷冻干燥得CTF[12].
1.3.2 急性酒精肝损伤动物模型的建立
小鼠适应性喂养3 d后,随机分为空白对照组、酒精模型组、阳性对照组(西利马林)、CTF低剂量组和高剂量组,每组10只.空白对照组和酒精模型组灌胃纯净水,阳性对照组灌胃西利马林(10 mg/kg bw),CTF低高剂量组分别灌胃50、100 mg/kg bw菊苣总黄酮,连续15 d.期间每天观察小鼠生活状态,每3 d称重小鼠一次,并根据小鼠体重调整灌胃剂量.第15 d,除空白对照组外,其余各组在分别灌胃给药6 h后,均灌胃56度红星二锅头白酒(12 mL/kg bw),建立小鼠急性酒精肝损伤模型.
1.3.3 指标检测
各组小鼠在末次灌胃白酒禁食18 h后,用乙醚麻醉,眼球摘除法采血,3000 r/min离心10 min,分离血浆,经试剂盒测定血浆指标(TC、TG、ALT和AST).小鼠解剖后迅速切除肝脏并称重,部分肝脏用福尔马林固定以进行组织学研究;部分肝脏经试剂盒用于生化分析(MDA、GSH、GSH-PX和SOD);其余肝脏在液氮中快速冷冻,在-70 ℃冰箱保存,用于实时荧光定量PCR分析.
1.3.4 肝脏中基因表达的实时荧光定量PCR分析
取60 mg肝脏组织,用Trizol 试剂根据销售商提供的操作指南提取总RNA.用ND-1000 微量紫外可见分光光度计检测总RNA 的纯度和浓度,置于-70 ℃ 冰箱保存备用.用PrimeScriptTMII第一链cDNA合成试剂盒按操作说明合成cDNA第一链.以SYBR Premix Ex Taq TM II和2 μL稀释的cDNA为模板,参照操作指南进行反应.用Primers 6.0软件设计目的基因引物,由生工生物工程(上海)股份有限公司合成,引物序列见表1.

表1 目的基因引物序列
PCR反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火20 s,一共进行40个循环.每组实验重复三次.以β-Actin为内参基因,采用2-ΔΔCT法[13]来计算目的基因转录的相对表达量,ΔΔCT=CT目的基因-CT内参基因.
1.3.5 肝脏病理切片制作
取小鼠右叶相同位置肝脏,用4 ℃生理盐水冲尽残血,滤纸拭干,10% 中性福尔马林固定,石蜡包埋,切片,苏木素-伊红(HE)染色,光镜下观察肝组织切片的病理形态学变化.
1.3.6 统计学分析
所有实验数据以平均值±标准差表示,采用SPSS 19.0软件进行分析,统计学分析采用单因素方差分析法及t检验法分析各组之间的差异,P<0.05为显著性标准,采用Graphpad prism 6作图分析结果.
2 结果与分析
2.1 CTF对小鼠生长情况及体重的影响
实验期间,各组小鼠精神状态较好,活泼好动,被毛平顺有光泽,体重不断增长,各组小鼠体重不存在明显差异,结果如图1所示.在灌胃56度红星二锅头白酒后,除空白对照组外,其余各组小鼠出现行走不稳,四肢瘫软,呼吸急促,重者嗜睡醉倒等情况,此状态一直持续1 h左右.18 h后,酒精模型组小鼠仍然精神萎靡不振,反应迟钝,嗜睡,而阳性对照组和CTF剂量组小鼠恢复较快,活动量增多,食欲和整体精神状态恢复较好.结果表明,预先灌胃CTF不影响小鼠体重变化,且可缓解酒精带来的对小鼠的影响.

图1 CTF对小鼠体重的影响
2.2 指标检测结果
2.2.1 CTF对酒精所致急性肝损伤小鼠肝脏指数的影响
小鼠的肝脏指数可部分反映肝损伤的程度.由图2可知,空白对照组、阳性对照组及CTF高剂量组与酒精模型组相比肝脏指数有显著性差异(P<0.05).结果表明,CTF能够缓解酒精对肝脏的损伤,具有一定的保肝作用.
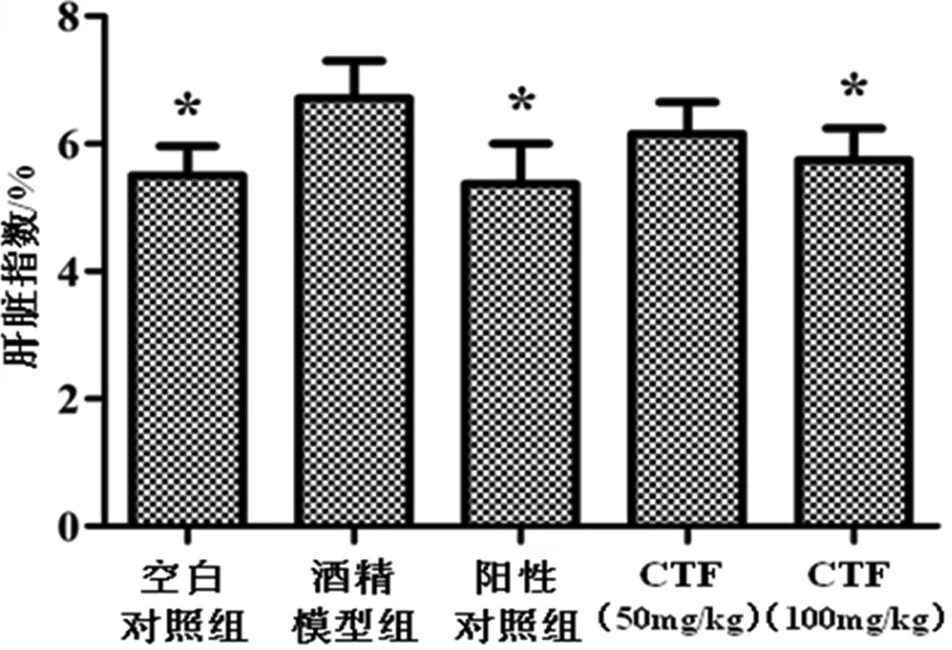
图2 CTF对酒精所致急性肝损伤小鼠肝脏指数的影响*与模型组相比,差异显著(P<0.05);下同.
2.2.2 CTF对酒精所致急性肝损伤小鼠血浆中ALT 、AST、TC和TG的影响
ALT 和AST是评价动物肝功能和健康状况的常用指标,可以反映动物的肝损害和健康状况.由图3A和B可知,空白对照组与酒精模型组相比,血浆ALT和AST活性差异显著(P<0.05),表明ALD小鼠模型建模成功.而灌胃CTF和西利马林组小鼠血浆中ALT和AST活性有不同程度的降低,且CTF高剂量组和阳性对照组与酒精模型组相比差异显著(P<0.05).图3C和D显示了空白对照组与酒精模型组相比,血浆TC和TG的含量差异显著(P<0.05),而阳性对照组和CTF组含量有不同程度下降,且对于TC含量,CTF高剂量组和阳性对照组与酒精模型组相比差异显著(P<0.05);TG含量,CTF各剂量组和阳性对照组与酒精模型组相比差异均显著(P<0.05).提示CTF具有较好的保护肝脏受损、降低血浆转氨酶和脂质在肝脏中沉积的能力.
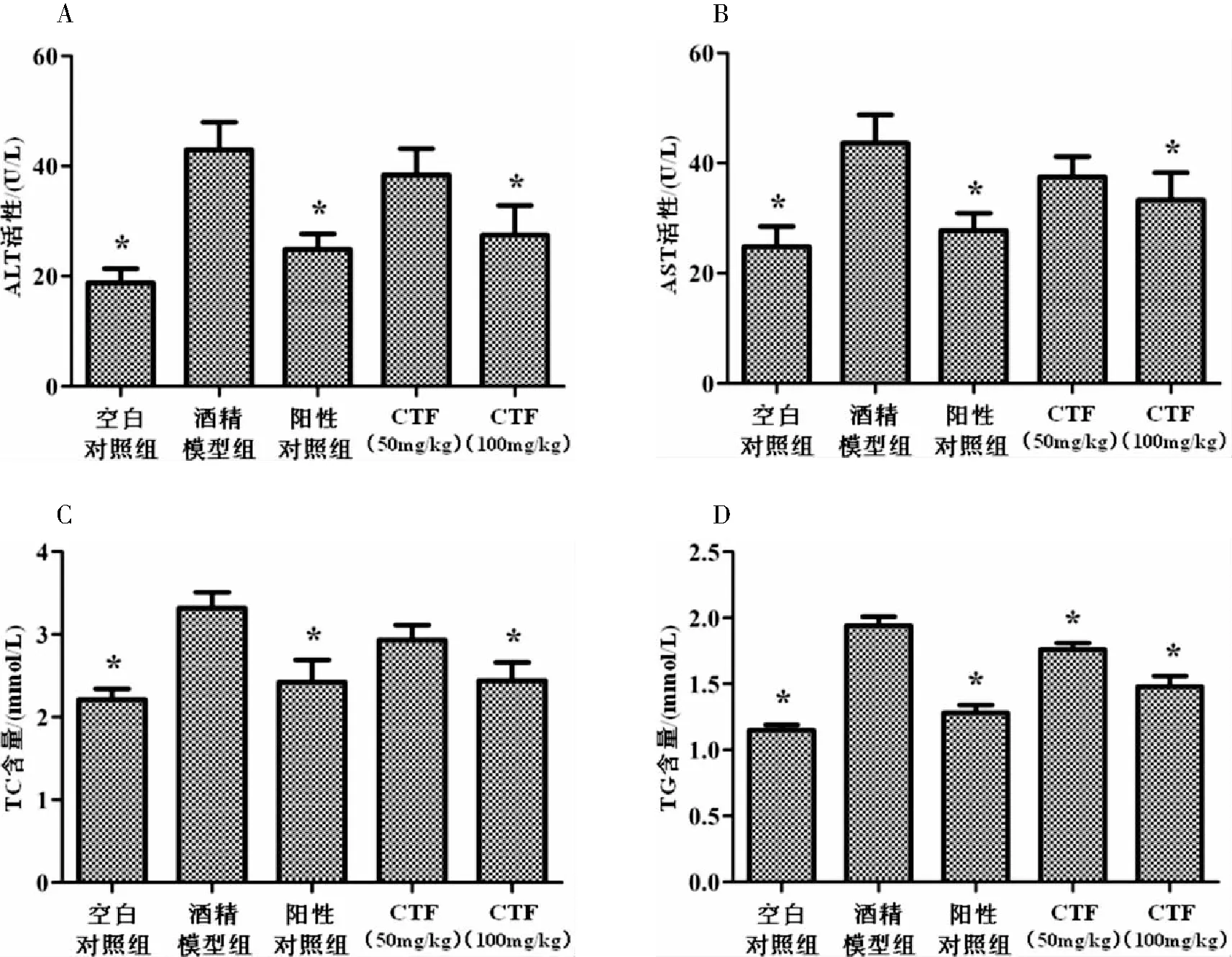
图3 CTF对酒精所致急性肝损伤小鼠血浆中ALT 、AST、TC和TG的影响
2.2.3 CTF对酒精所致急性肝损伤小鼠肝匀浆中MDA、GSH、GSH-PX和SOD的影响
肝损伤总是与异常的氧化应激相关[14].因此,通过检测MDA、GSH、GSH-PX和SOD四种肝脏氧化应激指标,可以检验CTF是否能改善酒精所致损伤引起的肝脏氧化应激.由图4可知,过量饮酒会导致肝脏中MDA含量显著上升,而GSH-PX和SOD活性以及GSH含量明显下降,表明ALD小鼠肝脏氧化应激水平明显升高.与酒精模型组相比,经西利马林和CTF作用后,各组小鼠抗氧化能力有不同程度的提高,MDA含量显著降低(P<0.05),GSH-PX和SOD活性显著上升(P<0.05).此外,CTF高剂量组GSH含量显著上升(P<0.05).提示CTF具有较好的改善肝组织氧化应激的能力.

图4 CTF对酒精所致急性肝损伤小鼠肝匀浆中MDA、GSH、GSH-PX和SOD的影响
2.3 CTF对酒精所致急性肝损伤小鼠肝脏中HO-1、Nrf-2、CYP2e1、TNF-α、TLR-4和FAS基因mRNA表达的影响
为了探讨CTF抗酒精性肝病活性的分子机制,分析了肝脏中与氧化应激相关的基因(HO-1、Nrf-2和CYP2e1)、脂质过氧化基因(FAS)和免疫调节基因(TNF-α和TLR-4)的表达水平,结果见图5.与模型组相比,阳性对照组和CTF组HO-1和Nrf-2基因的表达明显升高(P<0.05),而CYP2e1、TNF-α、TLR-4和FAS基因的表达则显著降低(P<0.05).提示CTF具有缓减由酒精引起的肝组织氧化应激、降低脂质在肝脏中的积累以及提高机体免疫力的功效.
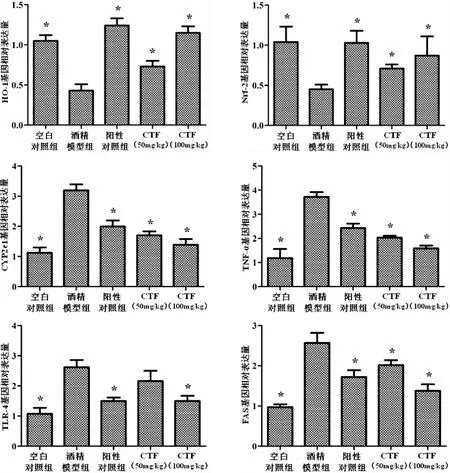
图5 CTF对酒精所致急性肝损伤小鼠肝脏中HO-1、Nrf-2、CYP2e1、TNF-α、TLR-4和FAS基因mRNA表达的影响
2.4 CTF对酒精所致急性肝损伤小鼠肝组织病理变化影响
病理观察可以直接验证CTF是否对酒精所致的急性肝损伤具有缓减作用.各实验组结果如图6所示,空白对照组肝细胞排列整齐,细胞核圆而清晰,胞浆丰富,无明显组织学病变(图6A).不同的是,在酒精模型组中,暴露于酒精中的小鼠出现肝小叶破坏、肝索紊乱、肝细胞肿胀、肝细胞球囊化和核固缩(图6B).然而,经CTF处理的实验组,肝损伤明显降低,且呈现剂量依赖状态(图6D-E),特别是CTF高剂量组(图6E),肝细胞改善情况与阳性对照组相似(图6C).提示CTF对酒精所致急性肝损伤有较好的缓减作用.

A.空白对照组;B. 酒精模型组;C.阳性对照组;D. CTF低剂量组;E. CTF高剂量组图6 CTF对酒精所致急性肝损伤小鼠肝组织病理变化影响(HE, ×400)
3 讨论
近些年来,对天然活性产物防治酒精性肝病的研究进一步深入.大多数报道主要集中在天然多糖对酒精性肝病的防治,如铁皮石斛多糖、平菇菌丝体多糖、云芝菌丝体多糖等[15-17].此外,也有关于二酮类和三萜类药物对肝脏的保护作用的报道[18,19].本研究探讨了CTF对酒精所致急性肝损伤小鼠的影响.同时发现CTF组的小鼠生长情况和体重与空白对照组比较无明显差异,即灌胃CTF对小鼠的生长和体重无影响.
动物肝脏指数可部分反映肝损伤的程度.本研究中,与空白对照组相比,酒精模型组小鼠肝脏指数显著上升;而与酒精模型组相比,CTF各剂量组的肝脏指数出现不同程度降低,且CTF高剂量组与酒精模型组差异显著,接近空白对照组和阳性对照组水平,表明CTF能够抑制肝细胞肿胀,缓解酒精对肝脏的损伤.
血清生化指标ALT和AST是衡量肝功能是否正常的重要指标,当肝脏受到酒精的影响,肝组织受损,肝细胞膜通透性增加,血液中ALT和AST水平会明显升高[20].本研究显示,与空白对照组相比,酒精模型组血浆 ALT和 AST的水平均显著的升高,而CTF各剂量组不同程度降低了酒精所致急性肝损伤小鼠血清中ALT 和 AST 水平,表明CTF可以缓解酒精对肝脏的损害.人体内的TC和TG主要在肝脏中合成,若肝脏受损,则血液中游离脂肪酸水平上升,导致血液中TG水平升高,引起高TG血症,致使肝脏合成TC能力增强,引起血液中TC浓度升高.因此血清中TC和TG含量的高低间接反映了肝脏受损的程度[21].本研究显示,与酒精模型组相比,CTF各剂量组可以缓减酒精所致的小鼠急性肝损伤,降低血清中TC和TG含量.
饮酒引起的氧化应激是各种肝病常见的病理生理学特征[22].过度的饮酒可以降低机体中SOD、GSH、GSH-PX等抗氧化酶的水平,增加脂质过氧化的产物MDA,诱导肝组织损伤.本研究发现,酒精模型组小鼠肝脏SOD、GSH和GSH-PX活性明显低于空白对照组和阳性对照组,而MDA含量明显升高;CTF各剂量组可以不同程度提高肝受损小鼠肝脏中SOD、GSH和GSH-PX活性,降低MDA的含量,表明预先灌胃CTF能够提高机体应对氧化应激的能力.
在肝细胞中,细胞色素氧化酶P4502E1(CYP2e1)是参与酒精代谢的主要酶之一,具有较强的NADPH氧化酶活性,它可以使酒精氧化产生活性氧基团,诱导氧化应激反应,导致细胞死亡或凋亡[23],而Nrf-2可以调节氧化应激并减少炎症反应,当其处于氧化应激环境中时,CYP2e1被解离.HO-1是Nrf-2已知的靶基因,当Nrf-2被激活时,HO-1表达增加,从而保护机体免受损伤[24].研究表明,酒精摄入可上调FAS基因的转录,该基因与脂肪酸合成密切相关,并影响脂质代谢[25].炎症也是引起酒精性肝病的一个重要因素.有报道称,肝实质细胞中TLR-4的激活可以促进TNF-α的释放,增加促炎细胞因子和炎症反应[26].本研究结果表明,CTF可以减轻酒精对肝脏氧化应激、脂质代谢和炎症相关基因表达的负面影响.
病理学切片观察能够直观反映肝脏病理变化情况.本研究中,酒精模型组小鼠肝细胞出现肿胀、水样变性、点状坏死等病理改变.而预先灌胃CTF的小鼠肝组织的病理损伤和炎症反应能明显减轻,且病理改善作用呈剂量相关性,CTF剂量越大,改善越明显.
综上所述,菊苣总黄酮能够明显缓解酒精所致小鼠急性肝损伤,在预防急性酒精性肝损伤方面很有开发前景.

