Vaspin通过抑制KLK7改善败血症诱导的小鼠心脏损伤和心脏炎症
程小龙,水寅萍
(皖南医学院,安徽 芜湖 241002)
败血症是一种由病原微生物侵入体内引起的全身性炎症综合征[1]。败血症的发病率高且死亡率高,因此是临床研究的重要疾病之一[2]。败血症发生的过程中往往伴随着脂多糖(LPS)的释放,导致多种免疫细胞的激活和多种病理反应,随后引起组织器官的损伤和衰竭,其中心脏损伤和炎症的发生是造成死亡的重要原因[3]。因此,寻找潜在的靶点预防败血症引起的心脏损伤十分必要。Vaspin是一种内脏脂肪组织衍生的丝氨酸蛋白酶抑制剂[4],主要来源于内脏脂肪细胞,可在心脏、肾脏、大脑、胃肠道、胰腺等多种组织中表达[5],炎症、高糖等病理条件可促进vaspin的合成和分泌[6]。研究发现vaspin可调控血管内皮细胞的炎性因子、黏附分子及趋化因子的表达,且能对抗细胞凋亡,对血管内皮具有保护作用[7]。激肽释放酶可分为两大类,分别为血浆激肽释放酶(plasma kallikrein,PK)和组织激肽释放酶(kallikrein related peptidase,KLK)[8]。组织激肽释放酶中的激肽释放酶7(KLK7)是一种具有胰凝乳蛋白酶样特异性的蛋白酶,被确定为第一个vaspin靶蛋白酶,已有研究表明KLK7参与了机体炎症的发生过程[9]。大量研究表明[10],vaspin与心血管疾病之间存在关联,冠状动脉疾病(CAD)患者体内的vaspin显著增高,且与冠心病的严重程度呈正相关[11]。Vaspin在动脉粥样硬化小鼠体内也增加,并通过减轻炎症逆转ApoE-/-小鼠的动脉粥样硬化过程[12]。然而,目前尚不清楚vaspin是否在脓毒症引起的心脏损伤中起作用,本研究中使用盲肠结扎和穿刺(CLP)诱导的败血症小鼠来探究这一问题。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和试剂 C57野生型(WT)小鼠购自安徽医科大学动物实验中心(动物生产许可证号:2022134628)。KLK7基因敲除(KLK7-/-)小鼠购自GemPharmatech有限公司(江苏,中国)。LPS(sigma)溶解于生理盐水中,稀释终浓度为10 mg/kg,保存使用;vaspin(PeproTech)先溶解于DMSO中,后使用生理盐水溶解,终浓度为0.1 μg/kg,保存使用。
1.1.2 实验仪器 多功能酶标仪(北京市六一仪器厂);荧光倒置显微镜(卡尔·蔡司公司);高速冷冻离心机(珠海黑马医学仪器设备有限公司);凝胶成像系统(上海欧翔科学仪器公司);电泳设备(美国Thermo Fisher Scientific公司)。
1.2 试验方法
1.2.1 构建败血症模型 采用盲肠结扎穿刺(CLP)和脂多糖(LPS)建立脓毒症小鼠模型[13]。首先WT小鼠或 KLK7-/-小鼠用vaspin或PBS预处理,用2%异氟烷吸入麻醉,并平放在预热的手术台上,腹部的毛发用剃毛器去除,用75%的乙醇对皮肤进行消毒。然后解剖腹部皮肤以暴露腹腔,盲肠在远端和盲肠底部之间的一半距离处被结扎,从盲肠前部的肠系膜末端穿刺一次,用26G针头从肠系膜端向肠前方向穿刺一次。最后,缝合腹部皮肤并进行消毒,将小鼠置于28 ℃的培养箱中。对模型组小鼠使用LPS(10 mg/kg)预给药6 h,刺激小鼠炎症发生,小鼠败血症模型构建完成。
1.2.2 实验分组与给药 WT小鼠接受假手术或使用生理盐水作为对照(n=15)。此外,在接受CLP或假手术之前,WT小鼠用PBS或vaspin(0.1 μg/kg)预处理30 min(n=15),LPS(10 mg/kg)预给药6 h;造模结束后观察小鼠1周以确定其存活率。同样对于KLK7-/-小鼠首先接受CLP或假手术(n=15),小鼠使用vaspin或PBS预处理30 min(n=15),LPS(10 mg/kg)预给药6 h;给药和CLP后观察小鼠1周以确定其存活率。
1.2.3 超声检测血流动力学指标 给药和CLP结束后,将各组小鼠麻醉并仰卧固定于手术台上,气管插管,使用小动物呼吸机维持通气,开胸,将PowerLab数据采集分析系统传感器的针尖小心插入小鼠左心室内,根据系统软件检测记录血流动力学指标:平均动脉压(mean arterial pressure,MAP) 、左心室收缩压(left ventricular systolic pressure,LVSP) 、左心室等容舒张期压力下降最大速率(maximum rate of left ventricular isovolumic diastolic pressure drop,-dp/dtmax) 和左心室等容舒张期压力上升最大速率(maximum rate of leftventricular isovolumic diastolic pressure rise,+dp/dtmax) ,每只小鼠至少需检测3个连续且完整的心动周期。
1.2.4 心脏损伤标志物的分析 通过小鼠眼球取血的方式采集各组小鼠血液样本并离心以获得血清。使用LDH检测试剂盒和CK-MB检测试剂盒(均购自中国Njjcbio生物技术公司)检测乳酸脱氢酶(LDH)和心肌结合肌酸激酶(CK-MB),用以评估心脏损伤标志物水平。
1.2.5 HE染色观察心肌组织病理学变化 将被安乐死的小鼠解剖并分离其心肌组织,每组各取15只小鼠的心肌组织(其余心肌组织置于-80 ℃冰箱中,用于后续ELISA和Western Blot检测)迅速置于4%多聚甲醛溶液中固定24 h,用石蜡包埋,用切片机切成约5 mm厚的切片,参照HE染色试剂盒说明书进行染色,之后在光学显微镜下观察并拍照。
1.2.6 蛋白免疫印迹分析 将冷冻的组织研磨,用裂解缓冲液裂解,并通过超声波进一步裂解。通过离心获得总蛋白质,收集上清液。使用BCA蛋白质定量试剂盒(Thermo Fisher Scientific,USA)检测蛋白浓度。总蛋白使用12%的十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶,按分子量进行电泳分离,并转移到PVDF膜上(Millipore,USA)。用3%的BSA封闭1 h后,将膜与稀释好的vaspin、 KLK7 、Cleaved caspase3等抗体孵育过夜;PBS洗膜完成后,与二抗GAPDH室温孵育1 h(所有单克隆抗体均购自英国Abcam公司),最后上机显影,并用Image J进行灰度值分析。
1.2.7 ELISA检测心肌组织中炎症因子水平 造模结束后取小鼠心肌组织,冰PBS漂洗后制备心肌组织匀浆,按ELISA试剂盒要求检测心肌组织中IL-1β和TNF-α的含量。

2 实验结果
2.1 超声检测各组小鼠血流动力学指标情况 MAP、LVSP、-dp/dtmax和+dp/dtmax:CLP处理组较假手术组显著降低;vaspin预处理组较CLP处理组显著升高;KLK7基因敲除组的小鼠CLP处理后较正常CLP处理组小鼠升高得更加显著,差异均有统计学意义(P<0.05)。见表1。

表1 各组小鼠血流动力学结果比较
2.2 各组LDH和CK-MB检测情况 与假手术组相比,CLP组的LDH和CK-MB水平显著升高;vaspin预处理组相较于CLP组LDH和CK-MB水平显著降低;基因敲除组相较于CLP组LDH和CK-MB水平降低得更加显著,差异均有统计学意义(P<0.05)。见表2。
2.3 HE染色观察各组心肌组织病理学变化情况 HE染色结果显示假手术组小鼠心肌组织结构正常,心肌纤维横纹清晰,无变质、坏死等异常改变;CLP处
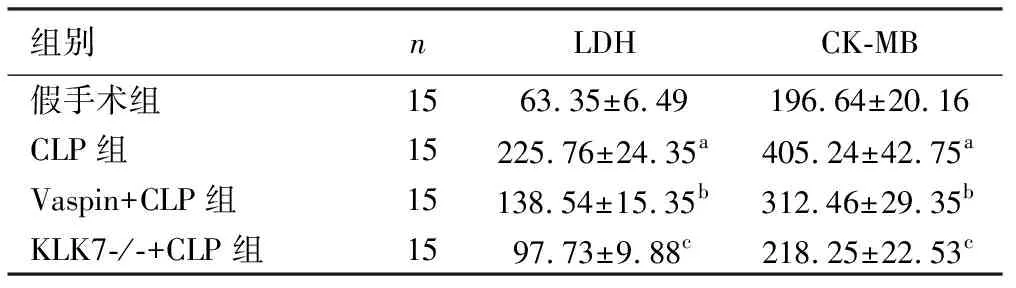
表2 各组小鼠血清LDH和CK-MB水平比较 单位:μg/L
理组小鼠心肌组织结构紊乱,可见心肌细胞变性、坏死,细胞核碎裂、溶解,心肌纤维断裂,心肌横纹模糊、消失、间质水肿等异常变化;vaspin预处理组可见心肌损伤情况明显好转;而基因敲除组可见小鼠心肌组织结构趋于正常,异常变化得到改善。见图1。

图1 各组小鼠心肌组织病理学HE染色图(×200)
2.4 蛋白免疫印迹检测相关蛋白表达情况 蛋白免疫印迹结果显示,与假手术组相比,CLP处理组的vaspin、KLK7、Cleaved caspase3、TNF-α和IL-6的表达均显著上调;而与CLP组相比,vaspin预处理的CLP组KLK7、Cleaved caspase3、TNF-α和IL-6表达显著下调;当KLK7被敲除时,与CLP组相比,KLK7、Cleaved caspase3、TNF-α和IL-6的表达显著下调。差异均有统计学意义(P<0.05)。见图2。

图2 各组小鼠心肌组织vaspin、KLK7和Cleaved caspase3等蛋白表达结果
2.5 ELISA检测各组小鼠心肌组织中炎症因子水平 ELISA检测结果显示,与假手术组相比,CLP处理后小鼠体内的TNF-α、IL-6等炎症因子的水平上升;将vaspin预处理后再CLP处理时,与单纯CLP处理组相比,小鼠体内的TNF-α、IL-6等炎症因子的水平下降;当敲除KLK7后,小鼠体内的炎症因子水平也下降,差异均有统计学意义(P<0.05)。见图3。
3 讨论
败血症是世界范围内的一个重大公共卫生问题,是由细菌和其他致病微生物侵入体内引起的全身性炎症反应综合征[14]。败血症在临床上病情进展迅速、临床救治困难,心肌损伤是败血症常见的早期并发症[15],一旦发现患者出现心血管疾病,极大可能发生死亡,因此研究如何预防败血症的发生和恶化显得尤为必要。

图3 各组小鼠体内TNA-α、IL-6等炎症因子水平
在本次研究中小鼠接受了CLP诱导腹部感染,模拟临床败血症,同时腹腔注射LPS,以模拟革兰氏阴性细菌细胞壁释放LPS的情况[16]。小鼠通过接受CLP处理并注射LPS以建立败血症模型。以前的研究发现[17],vaspin是急性心肌梗死患者心衰的一个重要预测指标。本次研究主要探究丝氨酸蛋白酶抑制剂vaspin在败血症诱发的小鼠心脏损伤中的保护作用,并深入探究其保护机制。首先实验结果显示,当对小鼠进行vaspin预给药时,能够有效地保护败血症诱导的小鼠心功能障碍和损伤。在后续的实验中发现,vaspin预给药可以有效降低小鼠体内的相关炎症因子水平,抑制心肌细胞的凋亡。PAHLAVANI N等[18]在败血症患者和小鼠体内,研究发现了血液中的各种免疫细胞,包括白细胞、单核细胞和巨噬细胞,它们的水平都明显增加。此外,这些免疫细胞逐渐浸润心脏并被激活,从而释放出多种因子,放大了心脏的炎症反应[19]。这些发现表明,炎症在败血症的发生过程中起着重要的作用。尽管其他病理因素包括氧化应激反应等也参与了败血症损伤机体的过程[20],但败血症引发的炎症极大可能是败血症导致心脏损伤的主要原因。那么vaspin究竟是通过什么机制发挥其保护作用的,是课题研究的主要问题。KLK7是组织激肽释放酶中的重要一员,可以在各种组织和器官中表达。研究表明,KLK7参与了多种系统性疾病的发生,包括皮肤病、肿瘤和前列腺炎[21]。同时KLK7是vaspin的第一个下游信号,后续实验结果显示,当预给药vaspin再进行CLP处理时,小鼠体内的KLK7蛋白表达水平显著降低,同时相关炎症蛋白和凋亡蛋白的表达水平显著升高。因此,推测vaspin是通过抑制KLK7表达发挥其保护作用的。随后敲除了KLK7基因,实验结果显示CLP处理后小鼠体内的炎症因子水平并没有升高,凋亡蛋白的表达也没有明显上调。同时当KLK7被敲除后,CLP小鼠的心功能障碍得到一个明显的保护。
本研究证实vaspin通过抑制KLK7的表达来减轻败血症诱导的小鼠心脏损伤和心脏炎症,并且能够缓解败血症引起心脏功能障碍。因此vaspin和KLK7可能是预防和治疗临床败血症中心脏损伤的重要治疗靶点。

