蛋白质组学分析中蛋白质快速酶解方法的研究进展
关致颖, 潘建章,2, 方 群*,2,3
(1.浙江大学化学系,浙江杭州 310058;2.浙江大学杭州国际科创中心,浙江杭州 311200;3.浙江大学激发态材料浙江省重点实验室,浙江杭州 310007)
1 引言
细胞是生命活动的基本单位,生物体内组成不同、功能各异的多种细胞中时刻进行着复杂的生命活动[1]。蛋白质是细胞内功能的直接执行者,蛋白质组学层面的差异标志着细胞功能的差异[2]。基因表达过程从DNA、mRNA到蛋白质,存在转录水平、翻译水平以及翻译后水平三个层次的调控,这使得组织中mRNA丰度与蛋白质丰度的相关性大大降低。蛋白质复杂的翻译后修饰(Post-Translation Modification,PTM)等过程均不能从其基因编码序列中预测,只能从功能蛋白的层面展开分析。因此,从蛋白质组学层面展开深入研究具有重大意义。
质谱(Mass Spectrometry,MS)作为一种灵敏度和分辨率极高的分析方法,可在无标记的情况下直接测定样品离子的质量数与电荷数之比(质荷比,m/z)。20世纪80年代末,基质辅助激光解吸电离(Matrix-Assisted Laser Desorption/Ionization,MALDI)[3]和电喷雾电离(Electron Spray Ionization,ESI)[4]两种软电离技术的诞生推动了生物质谱的快速发展,可以实现对多肽等生物大分子快速、精确的测定[5]。基于质谱技术的蛋白质组学分析方法主要有自上而下(Top-down)[6 - 8]和自下而上(Bottom-up)[9 - 13]两种策略。自下而上的蛋白质组学分析能够对复杂的生物样品提供足够的鉴定深度和广度,已成为主流的蛋白质组学方法之一,广泛应用于蛋白质的鉴定及其PTM分析中。在以液相色谱-质谱(Liquid Chromatography-Mass Spectrometry,LC-MS)分析系统为基础的自下而上鸟枪法(Shotgun)蛋白质组学分析中,蛋白质需要在进入LC-MS分析系统前被蛋白酶消化成分子量更小的肽段。常规的蛋白质组学前处理操作主要包括以下步骤:首先,使用细胞裂解剂破碎细胞膜,释放其中的蛋白质;其次,加入还原剂,使蛋白质中的二硫键断裂并形成半胱氨酸残基;之后加入烷基化试剂将半胱氨酸残基烷基化使其无法再次形成二硫键,从而破坏蛋白质的空间结构,将其展开为长链,使切割位点充分暴露。上述每个步骤的时间通常都不到1 h。第四步是加入胰蛋白酶,将蛋白质长链消化成肽段,这一过程通常要求37 ℃下过夜反应,反应后加入甲酸调节体系酸碱度并终止反应。样品经脱盐处理后,送入LC-MS系统进行分离和检测,单个样品的分离检测时间通常在2 h以内。显然,在整个蛋白质组学分析过程中,过夜的胰蛋白酶消化是最关键也是最耗时的一步,耗时数小时以上的酶解反应制约了蛋白质组学前处理操作的通量和效率。酶解反应的完全性和专一性对于蛋白质及其序列的鉴定起到决定性的作用,酶解程度受到酶的种类和活性、反应体系酸碱度(pH值)、温度、时间等因素影响。探索能够显著加快胰酶消化速度的方法能够显著提高蛋白组学分析的效率,以应对大规模、高通量的分析需求。以下,本文将从引入额外能量、缩小反应体系体积、改变酶试剂形态三种策略来介绍近年来蛋白质快速酶解研究工作的进展。
2 引入额外能量的快速酶解策略
蛋白质的酶解反应效率取决于酶分子的活性、蛋白质切割位点的暴露程度、两种分子间发生碰撞及相互作用的几率等因素。向蛋白质酶解体系提供额外的能量,能够向体系提供充足的反应温度,提升酶分子的活性,促进蛋白质分子中各类化学键的振动,帮助蛋白质分子暴露切割位点并与活跃的酶分子相结合,从而显著加快蛋白质酶解反应的进程。
红外光是波长在770 nm到1 mm之间的电磁波,红外激光可用于许多生物学过程的调节和疾病的治疗,其中发射波长约为800 nm的近红外激光应用尤为广泛[14 - 18]。这种近红外激光即使在高功率和长时间照射下也可以很容易地穿透水且几乎没有能量损失,相较于其它激光辐射而言,对生物组织造成不可逆损伤的概率明显降低。如果激光功率足够高,它能够加速热量积累并提高生物过程中的组织温度。除了光热效应外,高能近红外辐射还可以激发组织内有机成分化学键的振动,提高分子水平的反应活性。对于蛋白质的酶解反应而言,近红外激光的热效应能够帮助胰酶维持在适宜的反应温度且不损伤蛋白质和胰酶的活性,对蛋白质分子中的N-H、C-O、C-N键振动的促进作用有可能帮助蛋白质暴露更多的胰蛋白酶切割位点,从而有效提升酶解反应的效率。
2008年,Wang等[19]首次将红外光用于提升胰蛋白酶消化蛋白质的效率。他们将蛋白质∶胰蛋白酶=40∶1(w/w)的混合溶液置于密封透明的离心管中,在250 W红外灯照射下进行酶解反应,通过热电偶温度计维持溶液温度在37 ℃。结果显示,该方法可将牛血清白蛋白(Albumin from Bovine Serum,BSA)和肌红蛋白(Myoglobin,MYO)的消化时间缩短到5 min,通过MALDI-TOF MS鉴定序列覆盖率分别为69%(BSA)和90%(MYO),明显优于传统方法38%(BSA)和69%(MYO)的消化结果。2010年,Yao等[20]使用功率为5 W、波长为808 nm的光纤耦合二极管红外激光照射蛋白质和胰酶的混合溶液来加速酶解反应的进程。如图1a,红外激光器照射在密封的透明离心管或不锈钢 MALDI 靶板上,辐照度约为25.5 W/cm2。结果显示,使用红外激光照射能够将离心管内的肌红蛋白酶解反应缩短到几十秒,且所得序列覆盖度略高于过夜酶解12 h的样品。对于MALDI靶板上的样品,红外激光照射可将酶解过程缩短至5 s,所得蛋白质序列覆盖度和离心管内溶液样品基本相同。实验显示红外激光对十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)胶内蛋白质酶解效率也有提升作用,但不如离心管内溶液反应的效果,可能是由于808 nm的红外激光更容易穿透含水量高的样品。文章使用该方法进行大鼠脑提取物的前处理,酶解时间为1 min,用LC-MS/MS鉴定,得到728条肽段和134个蛋白质。为探究激光热效应对反应的实际作用,他们将离心管置于冰水浴中并照射激光,以控制溶液在反应过程中的温度。结果显示,冰水浴中样品所得的BSA序列覆盖度(26%)低于不加冰水浴的结果(42%),说明红外激光的热效应是促进蛋白质酶解的一个重要因素,但与此同时也存在其他作用机理。在此基础上,2011年Zhang等[21]将红外激光与固定化酶反应器(Immobilization Enzyme Reactor,IMER)联用来提高蛋白质酶解的效率。激光辅助IMER蛋白酶解系统如图1b所示,IMER通过胰蛋白酶丙烯酰化和原位水相聚合两步反应整体固定在毛细管中,长度约为1 cm。实验使用发射波长为808 nm、功率为5 W的光纤耦合二极管红外激光器,光纤透镜和IMER之间的距离固定为10 cm。通过注射泵将蛋白质溶液注入固定有IMER的毛细管,蛋白质消化过程可在60 s内完成,使用MALDI-TOF MS鉴定得到BSA的序列覆盖率为33%,细胞色素c(Cytochrome c,Cyt-c)的序列覆盖率为73%,β-酪蛋白(Beta-Casein,β-casein)的序列覆盖率为22%,与常规溶液中反应14 h所得蛋白质序列覆盖度基本相同,显著高于仅使用IMER的效果。蛋白质N-末端的靶向分析有助于阐明成熟蛋白质N-末端的起始位点和翻译后修饰。Li等[22]将红外激光辅助蛋白质酶解的方法用于蛋白质的N-末端分析。实验结果显示,两种蛋白酶解方法所得的4种标准蛋白的肽段数量和序列覆盖率基本相同,而红外激光辅助酶解的方法可以增强蛋白质中N-末端肽的释放。与传统的过夜消化相比,激光辅助消化的方法从小鼠肝脏中识别出的N-末端肽数量提高了28.3%,消化时间成本从过夜缩短到40 s。
微波是波长在0.01~1 m、频率在0.3~30 GHz之间的电磁辐射。作为常见的热源之一[23],微波加热的原理是促进物质内部极性分子的高频往复运动,它无需热传导过程即可使物质内外均匀地受热升温,这使得其加热效率远高于常规热源。将微波加热运用于化学反应当中,可以有效地提升反应的产率和效率[24 - 32]。对于蛋白质酶解反应而言,选择适当的微波功率及加热时长,可以显著加速酶解反应的进程。
2002年,Pramanik等[33]使用最大功率为300 W、具有温控功能的单束微波发生器产生微波,实现了微波辅助的溶液内蛋白质快速酶解。实验使用胰蛋白酶∶蛋白质=1∶25(w/w)的比例处理细胞色素c、泛素、溶菌酶、肌红蛋白和干扰素-2b,反应温度设定在37 ℃,微波照射10 min,使用 MALDI-TOF MS或ESI MS技术进行分析。与传统方法所需的数小时相比,微波辅助可以在数分钟内完成蛋白质的消化。为了研究微波照射加速蛋白质酶解的机制,实验在不同的微波温度设置下进行干扰素-2b的酶解,并在不同时间点采集反应样品,结果显示,溶液温度快速升高到60 ℃以上将大大增强酶解反应效率。为进一步验证快速升温是否对酶解反应的加速有重要作用,在没有微波照射的情况下将反应混合物放入预热至60 ℃的加热块中,所测得的酶解情况与微波实验获得的结果相似,说明反应温度的快速升高是微波加速酶解反应的重要原因之一。Lin等[34]研究了在不同种类溶剂系统中进行微波辐射加速蛋白质酶解的反应情况。有机溶剂具有促进蛋白质变性的作用,在传统酶解实验中,加入甲醇、乙腈等有机溶剂虽然能促进蛋白底物的变性,但同时会使胰蛋白酶失去活性。使用600 W微波炉产生微波辐射,将肌红蛋白、细胞色素c、溶菌酶和泛素作为底物,胰酶∶蛋白质比例为1∶25(w/w),反应时间为10 min。结果显示,在微波作用下,乙腈、甲醇和氯仿中的胰酶酶解反应消化效率和所得蛋白质的序列覆盖度均较常规酶解反应有显著提升。这些结果表明,微波辐射能够在一定程度上提高蛋白质酶解体系对有机溶剂的耐受性,使得酶解效率进一步提升。Sun等[35]使用850 W微波炉产生微波,将200 μL 1 mg/mL BSA溶液置于0.6 mL离心管中,加热时在离心管旁放置1 000 mL水吸收多余能量,微波加热时间为1 min。实验比较了不同的反应条件的结果,说明对于快速酶解反应,蛋白质还原步骤较为重要而烷基化步骤可以省略。对于凝胶内蛋白质,将样品放于1.5 mL离心管微波加热5 min可得到比常规实验更好的消化效率。在使用BSA对实验条件进行优化后,他们将该系统应用于人尿液提取蛋白和酵母裂解产物这两种复杂样品中,能够分别在6 min 或25 min内完成溶液中(人尿液提取蛋白)或凝胶中(酵母裂解物)的蛋白质混合样品前处理,获得了与常规过夜酶解等效或更佳的反应效果,显示了微波辅助酶解技术在复杂生化样品分析中的应用潜力。Zhao等[36]开发了一种集成化的蛋白质样品制备方法imFASP,将原位过滤器辅助的样品预处理方法和微波辅助的胰酶酶解方法结合,可在1 h内高效地处理微克至纳克级的复杂蛋白样品。如图1c所示,首先,将溶解在8 mol/L尿素中的蛋白质上样至截留分子量为10 kDa的过滤器上,然后进行原位蛋白质预浓缩、变性、还原、烷基化和微波辅助胰蛋白酶消化。与传统溶液中样品前处理的鉴定结果(1 952个蛋白质和18 645个肽段)相比,imFASP方法从45 mg大肠杆菌蛋白质提取物中鉴定到的结果(2 215个蛋白质,23 012个肽段)更高,且样品前处理通量提高了14倍。当将大肠杆菌细胞裂解物的量降至50~500 ng的水平时,imFASP方法相对于传统溶液过夜酶解的方法,对蛋白质和肽的鉴定数分别提高了30%和44%,说明imFASP方法在微量蛋白质组样品的分析方面有独特的优势,有望成为高效、高通量的微量蛋白质组分析方法。
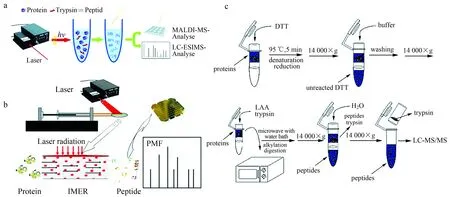
图1 引入额外能量的蛋白质快速酶解系统[20,21,36]Fig.1 Rapid enzymatic proteolysis systems based on introducing additional energy[20,21,36]
超声波作为一种波长很短的机械波,也被用于加速蛋白质的酶解反应。2005年,Lopez-Ferrer等[37]首次使用高强度超声探头进行蛋白质酶解。2007年,Rial-Otero等[38]报道了一种使用基于超声反应器的加速蛋白质酶解动力学的新方法。他们将两种不同的超声发生装置——超声反应器和超声探头分别用于蛋白质的酶解反应中,建立了超声波辅助蛋白质酶消化(Ultrasonic-assisted Protein Enzymatic Digestion,USAPED)分析方法,通过MALDI-TOF MS鉴定蛋白质的肽指纹图谱。作者优化了胰蛋白酶/蛋白质比例、超声时间、超声波振幅、蛋白质底物浓度等一系列反应条件。结果显示,两种超声发生装置最佳的胰蛋白酶/蛋白质比例和能够检出的最低蛋白质浓度基本相同,所用胰蛋白酶的量高于常规酶解反应体系的用量。在同样使用50%超声振幅的情况下,超声探头消化蛋白质所需的时间(60 s)比超声反应器(120 s)更短,但使用超声反应器获得的MALDI-TOF MS谱图更清晰,标准偏差更小。此外,超声反应器有六个样品通道,样品前处理的通量更高,更加适用于小体积样品,而超声探头一次只能处理一个样品,易造成微量样品的携出损失。
3 缩小反应体系体积的快速酶解策略
微反应体系具有不同于常规毫升至微升级体系的反应特征和独特优势,在微米级反应体系(如微液滴或微通道)中微尺度效应凸显,物质传质传热加快,反应的效率会得到显著的提升。微米级的微液滴可以通过电喷雾、微流体、纸喷雾等多种方法产生[39 - 45]。微液滴体系被广泛运用于加速各种类型的单相或双相有机反应,这些反应往往动力学过程缓慢,在常规大体积反应中需要加入特定的催化剂[46 - 49]。微液滴反应过程结合质谱检测也被用于研究快速反应动力学,推进化学合成、纳米材料合成等方面的研究[50 - 53]。微液滴内反应速率显著提升的确切原因目前尚未完全明确,但通常推测是与微尺度体系内的各种因素如液滴大小、表面电荷、溶剂组成、液滴蒸发等[54,55]有关。微液滴除了在有机合成方面发挥重要作用外,水性微滴能够提供与生命体系兼容的环境,故其在促进生化反应方面也有很大潜力。
2020年,Zhong等[56]使用电喷雾质谱喷雾过程中产生的微液滴来实现蛋白质的快速酶解。如图2a所示,在室温下将10 μmol/L肌红蛋白和5 μg/mL胰蛋白酶的5 mmol/L NH4HCO3溶液通过自主搭建的± 3 kV高压喷雾装置喷射形成直径9 μm、体积3 pL左右的液滴,液滴喷雾口和质谱口之间的距离约为2 cm,毛细管周围使用干燥N2作为鞘气,质谱入口毛细管温度始终保持在275 ℃,电压保持在0 V,实验在不到1 ms的时间内获得100%的肌红蛋白序列覆盖率。将相同的溶液置于37 ℃反应14 h,使用商品化电喷雾电离源产生直径约为60 μm的大液滴进行喷雾和质谱分析,得到的肌红蛋白序列覆盖度为60%,说明液滴尺寸对反应效率有显著的影响。他们还研究了微滴质谱法中蛋白质酶解适宜的pH范围。当pH小于4时,微滴质谱法促进酶解的程度会受到抑制,测得蛋白质序列覆盖度约为40%;当pH高至11时,微滴质谱法仍可完全消化合成肽。该方法被用于治疗性抗体曲妥珠单抗(约148 kDa)的序列分析,得到轻链100%、重链85%的序列覆盖率,证明了其在药物开发中的应用潜力。
4改变酶试剂形态的快速酶解策略
生物酶催化效率高、专一性强,通常在常温、常压等生物适宜的条件下发挥催化作用[57]。然而,当离开细胞及其特定环境,酶分子难以长时间保持活性或进行重复利用。固定化酶是指通过某种方法将酶固定于固体载体上或限制于一定区域内,在保证其催化能力的基础上提高酶试剂的稳定性和重复利用率[58,59],被广泛应用于医药、食品、能源、环境等领域。固定化酶提供了一个局部高浓的酶环境,能够有效加速蛋白质酶解反应动力学。常见的固定化酶载体有玻璃、膜、聚合物、磁珠、凝胶、多孔硅胶、多孔整体式材料等,固定方法也多种多样,如吸附法、包埋法、共价结合法、交联法等[60 - 62]。
Kosuke等[63]通过使用毛细管内固定化酶的方法来实现少量细胞的在线高效蛋白质组样品前处理(In-Line Sample Preparation For Efficient Cellular Proteomics,ISPEC)。ISPEC分析系统如图2b,将2 μL HeLa细胞悬液滴到玻璃板上,将相同体积的裂解液滴在另一块玻璃板的同一位置上,依次吸取空气500 nL、裂解液2 μL、空气500 nL、HeLa细胞悬液或细胞培养上清液,空气500 nL。使用带有电荷耦合器件(Charge Coupled Device,CCD)相机的显微镜对细胞进行计数,确定收集在采样毛细管中的细胞数量。之后,使用PicoClear联结器将采样毛细管连接到填充有固定化胰蛋白酶的反应毛细管和色谱柱,用注射泵以5 μL/min的流速推动水溶液进入毛细管,使得毛细管中收集的细胞与裂解液混合而裂解,再将流速更改为1 μL/min,推动溶液与固定化胰蛋白酶微球接触使蛋白质酶解,最终将酶解所得的肽段捕获在液相色谱柱的入口端,整个酶解和进样过程约1 h。将所得的装有样品的毛细管色谱分析柱连接到液相泵上,使用含有5%乙腈和0.1%甲酸的水溶液作为流动相进行30 min的液相分离。为避免样品间的交叉污染,每次分析均需更换固定化胰蛋白酶柱和色谱分析柱。使用经过优化的ISPEC方法和nano-LC-MS分析方法,他们分别从100个、10个和单个HeLa细胞中鉴定到了1351、351和60种蛋白质。该系统针对少量哺乳动物细胞样品展开方法设计和优化,降低了样品制备过程中的损失,提高了固定化胰蛋白酶消化的稳定性和效率。

图2 缩小反应体系体积和使用固定化酶的蛋白质快速酶解系统[56,63 - 65]Fig.2 Rapid enzymatic proteolysis systems based on reducing reaction system volume and using immobilized enzyme reactors[56,63 - 65]
Shen等[64]比较了采用固定化胰蛋白酶(Immobilized Trypsin,IM)和游离胰蛋白酶(Free Trypsin,FT)两种方法的酶解结果,同时系统地分析了IM相对于FT的作用区别以及IM固定基质的引入对蛋白质裂解机理或选择性的影响。如图2c所示,分别使用了胺基官能化(IM-N)或羧基官能化(IM-C)的固定化酶磁珠以及FT来消化大肠杆菌蛋白质组样品。与FT相比,IM在其消化蛋白的过程中没有特殊的选择性,对于位置不同、功能不同、丰度不同的蛋白都可以较好地进行鉴定。IM-N方法(用时15 min)和FT方法(用时12 h)都可以从小鼠脑蛋白质组中鉴定出9000种蛋白质。该工作建立了使用固定化酶进行消化的高通量自下而上蛋白质组学工作流程:蛋白质样品预处理(包括蛋白质变性,还原和烷基化)用时40 min,IM-N消化用时15 min,肽段脱盐和冻干用时1 h,毛细管区带电泳质谱(Capillary Zone Electrophoresis,CZE-MS/MS)分析时间为30 min,数据分析用时30 min,整个分析流程总时长约3 h,从小鼠脑蛋白质组中识别出1000多种蛋白质和6000多种肽,具有良好的定性和定量重现性。
Atacan等[65]使用热溶剂法制备了Fe3O4磁性纳米粒子(Magnetic Nanoparticles,MNPs),并开发了一种新方法将胰蛋白酶共价固定在单宁修饰的MNP上,表征了所得纳米粒子的形貌、结构和磁性。Fe3O4纳米粒子具有优良的药物相容性和超顺磁性,非常适用于固定化酶的研究,但裸露的Fe3O4纳米粒子通常稳定性和分散性较差,因此需要开发表面修饰方法来获得稳定且更具生物相容性的Fe3O4纳米粒子。单宁酸是一种天然的多酚分子,广泛存在于多种植物中,葡萄糖作为中心核通过酯键与十个没食子酸基团相连,其大量羟基结构易与生物聚合物相互作用,故可用作固定化酶结构的结合涂层。实验利用多酚的pH依赖性氧化反应,通过升高pH在单宁修饰纳米颗粒上生成醌基,利用席夫碱反应或Michael加成反应将胰蛋白酶共价固定在单宁修饰的Fe3O4MNPs上(图2d)。室温下,Fe3O4MNPs的饱和磁化值为60.18 emu/g,而单宁修饰的Fe3O4MNPs和固定有胰酶的单宁修饰Fe3O4MNPs的饱和磁化值分别为57.82 emu/g和55.16 emu/g,这表明单宁涂层和胰蛋白酶固定良好。他们使用BSA作为样品来表征固定化酶效果,分别在1 min、5 min和15 min内进行了BSA的酶解,并且在微波辅助下将酶解过程缩短到15 s,使用MALDI-TOF MS鉴定到39个特征肽段,在1 min的消化时间下获得了84%的蛋白质序列覆盖率。
2020年,Wei等[66]基于玻璃芯片研制了一种集成了固定化酶反应器(IMER)的一体化蛋白质预处理微流控系统。玻璃芯片由三个入口通道和两组蛇形通道组成,可使蛋白质溶液、还原剂和烷基化试剂同时注入芯片通道,保证反应液在线高效混合和充分反应。IMER通过硫醇-烯点击化学反应制备,经检测2个月内IMER酶活性降低13.8%,体现了IMER系统的稳定性和重复利用的能力。在此基础上,该研究组[67]于2021年发展了通过微流控芯片集成反相色谱、IMER和分子印迹整体柱的样品处理系统,实现在线蛋白质分离、变性、消化和多肽富集。该微流控系统完整处理一组样品的时间(约9.6 h)短于传统方法(约13.3 h)。2022年,该研究组[68]报道了基于微流控系统的分子印迹聚合物(MIP)和IMER相结合的富集策略,提高了质谱鉴定N-肉豆蔻酰化肽的水平,从MCF-7细胞提取的蛋白质混合物中鉴定出1 296个蛋白质和5 670个肽段,包括71个肉豆蔻酰化蛋白和78个肉豆蔻酰化肽。
5 总结与展望
随着人们在生物医学领域的认识和研究不断深入,少量细胞乃至单个细胞水平的蛋白质组学研究引起了广泛关注[69 - 71]。基于鸟枪法的传统蛋白质组学前处理流程较为复杂且耗时,如何显著提升蛋白质酶解速率是一大挑战。红外光辅助酶解策略通常用于离心管内数十微升体积的样品,蛋白质底物浓度较高,可将蛋白质酶解时间缩短至30 s~5 min。红外激光辅助的酶解系统装置简单,操作方便,易于集成,但它要求反应器为敞开式或者基于红外透过特性,方便光线照射到样品溶液。红外激光器的性质决定了它更适合于流动式的反应体系,对于大规模批式样品,红外激光器产生的激光难以同时均匀作用于每个反应单元,因此需要组装运动元件控制其在不同反应单元上方移动和定位,或采用多个红外激光器构建反应器阵列。已报道的微波辅助酶解策略同样用于离心管内数十微升体积的样品,可将蛋白质酶解时间缩短至30 s~10 min。使用微波炉产生微波的方法非常适用于批量样品同时反应,操作简单高效,但是微波炉本身难以集成到自动化微量样品前处理模块中。另外,高功率的红外激光和微波在操作中都具有一定的危险性。超声辅助酶解策略适用于数十微升样品,反应时间通常在1~20 min,操作简单,但超声波引起的振动对液体造成的扰动较大,不适用于微液滴原位反应体系。另一种基于微尺度效应的快速酶解策略利用电喷雾产生的皮升级微液滴将酶解反应加速到毫秒级,产物直接喷入质谱,装置简单,反应效率极高,但是仅适用于底物较为纯净单一的反应,目前尚难以推广到样品组成复杂、前处理操作繁琐、需要经液相色谱分离的蛋白质组分析体系中。基于固定化酶反应器的快速酶解策略是微体系反应中最常用的快速酶解策略,样品体积通常在百纳升至百微升,酶解反应时间在2 s~2 h,它的作用效果稳定,能一定程度上减少酶自切反应的发生,可灵活放置于各类微反应器中,尤其适合流动反应体系。然而,固定化酶制备步骤相对繁琐,对酶试剂的消耗较大,易向体系引入吸附残留、交叉污染等问题。
促进蛋白质快速酶解的目的是加快蛋白组学样品前处理的反应进程,以实现更大规模、更高通量的蛋白组学分析研究。在未来的研究中,如何对现有的蛋白质快速酶解策略进行选择和组合,实现集成化、自动化的蛋白组学快速样品前处理,是蛋白组学分析系统实用化进程中应该重点关注的问题。此外,随着研究者们对细胞异质性的认识不断加深,以及相关分析技术和仪器的不断发展,针对少量细胞乃至单个细胞的蛋白组学研究已成为当前蛋白质组研究的热点领域。目前文献报道的快速酶解策略多以常规量的某一种或数种蛋白质作为底物,以蛋白质序列覆盖度作为表征酶解效果的主要依据,这种方法的局限性是无法定量地反映体系中的所有蛋白质是否都被充分地酶解。当样品中的蛋白质含量极低时,可能存在蛋白质酶解不充分、响应低于检出限以至于影响蛋白质鉴定的问题。因此,对于少量和单细胞蛋白组学分析水平的微量样品而言,在常规蛋白组学分析中所采用的加速酶解方案是否依然适用,仍需要进一步的试验和验证。

