羊肚菌白霉病病原鉴定及生物学特性研究
苏文英,刘晓梅,纪伟,梁长东,赵书光,任立凯*
(1.连云港市农业科学院,江苏 连云港 222006;2.灌南县农业技术推广中心,江苏 连云港 222006)
羊肚菌(Morchella)是一种珍稀食药用菌,在菌物分类学上隶属于子囊菌亚门(Ascomycota)、盘菌纲(Discomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella)[1]。羊肚菌风味独特,营养价值极高,富含多种蛋白质及人体所需氨基酸,具有抑制肿瘤、调节机体免疫功能,能够抗疲劳、保肝、保肾、调血脂及保护胃肠功能等作用,具有重要的经济价值[2-3]。由于羊肚菌产业成本低、见效快、效益高的优势,其栽培区域由最初的川渝地区迅速扩张,现如今全国各地除海南以外的各省份均有种植[4-5]。羊肚菌属于土腐生类型,菌丝体需要在土壤中的有机物、无机物、水分及各种微生物的作用下才能出菇。因此,羊肚菌大田栽培占全行业栽培的90%以上,整个栽培过程羊肚菌菌丝体及子实体都暴露在外界环境中,与环境中的各种生物体接触,容易招致各种病虫害侵袭,给生产带来损失。此外,在栽培管理后期,高温高湿的环境也会加剧病害的发生和蔓延[6]。
近几年,羊肚菌病害在全国范围内频发,病害种类包括细菌性病害和真菌性病害,细菌性病害主要为软腐病及红体病;真菌性病害主要为白霉病。羊肚菌白霉病是其子实体时期最主要的病害,发病时子实体受侵染部位被白色绒毛状菌丝覆盖,严重时子实体受侵染部位会枯萎,病害发生率达60%~80%,使羊肚菌的商品性状和经济价值大打折扣,给种植户带来巨大的经济损失。此外,羊肚菌白霉病菌适应性极强,且能快速传播,一旦发病极难控制。因此,掌握羊肚菌白霉病病原菌的物种归属及生物学特性,对于该病害的预防和控制及进一步提升羊肚菌种植的经济效益具有一定的实践指导意义。
本研究通过对羊肚菌白霉病病原菌的分离鉴定及生物学特性进行研究,以期为该病害的早期诊断和科学防治提供理论依据。
1 材料与方法
1.1 供试菌株
2020年3月在江苏省连云港市农业科学院试验基地,采集发病子实体并带回实验室,观察记录病害症状。
1.2 供试培养基
MYG培养基(称取10 g麦芽糖、5 g葡萄糖、5 g酵母浸粉、15 g琼脂,加入蒸馏水定容至1 L);基础培养基(称取20 g葡萄糖、10 g蛋白胨、1 g K2HPO4、0.5 g MgSO4、15 g琼脂,加入蒸馏水定容至1 L);马铃薯葡萄糖琼脂(PDA)培养基(称取200 g马铃薯、20 g葡萄糖、15 g琼脂,加入蒸馏水定容至1 L);萨氏(SDAY)培养基(称取10 g酵母浸粉、40 g葡萄糖、10 g蛋白胨、15 g琼脂,加入蒸馏水定容至1 L);察氏(Czapek)培养基(称取2 g NaNO3、1 g K2HPO4、0.5 g KCl、0.5 g MgSO4、0.01 g FeSO4、30 g蔗糖、15 g琼脂,加入蒸馏水定容至1 L),所有培养基均在121 ℃下高压灭菌20 min。
1.3 病原菌的分离与鉴定
采用组织分离法进行病原菌的分离和纯化,在超净工作台中,用75%乙醇棉擦拭病害子实体表面,用接种刀切取病健交界处1~2 mm的组织块置于MYG平板内于25 ℃下恒温培养。待组织块周围生长出菌丝,切取尖端菌丝转至新的MYG培养基纯化培养。共获得1个菌株标记为JS-1,菌株在MYG培养基上培养10 d后置于4 ℃保藏备用。
利用基因组DNA提取试剂盒(北京康为世纪生物科技有限公司,北京)提取病原真菌DNA,选择通用引物ITS1、ITS4对提取的DNA进行扩增,扩增产物经1%琼脂糖凝胶电泳检测,检测正确后送至生工生物工程(上海)股份有限公司进行测序,测序结果进行BLAST同源性比对。通过比对测序结果,选取相似性较高的菌株相关种属序列,利用MEGA 7.0构建系统发育树。
将菌株JS-1接种于MYG平板上,25 ℃恒温暗培养10 d,观察记录菌落特征及显微形态。
根据柯赫氏法则进行回接致病性检测。
1.4 病原菌生物学特性测定
1.4.1 不同培养基对病原菌菌丝生长的影响
用8 mm打孔器在致病菌菌落边缘打孔,将菌块分别接种于PDA培养基、SDAY培养基、MYG培养基、Czapek培养基上,每个处理5个重复,于25 ℃恒温暗培养。培养期间观察记录菌丝均匀度及密度等长势情况,并计算菌丝生长速率。
1.4.2 碳源试验
分别以等量麦芽糖、淀粉、蔗糖、乳糖替换基础培养基中的葡萄糖,121 ℃灭菌20 min后倒入培养皿中,待培养基凝固后,用直径8 mm的打孔器取菌块接种于平板中央,每个处理5个重复,25 ℃恒温条件下黑暗培养,观察并记录菌丝长势。
1.4.3 氮源试验
分别以等量硫酸铵、酵母浸粉、氯化铵、尿素替换基础培养基中的蛋白胨,121 ℃灭菌20 min后倒入培养皿中,待培养基凝固后,用直径8 mm的打孔器取菌块接种于平板中央,每个处理5个重复,25 ℃恒温条件下黑暗培养,观察并记录菌丝长势。
1.4.4 温度试验
将接种后的平板培养皿分别置于15、20、25、30、35、40 ℃条件下培养,每个处理5个重复(培养基为基础培养基),观察并记录菌丝长势。
1.4.5 pH试验
用盐酸和氢氧化钠溶液调各培养基初始pH为5、6、7、8、9,观察并记录菌丝长势。
1.5 数据分析
用Excel和SPSS 17.0对数据进行整理和分析。
2 结果与分析
2.1 病害症状
2020年3月对连云港市农业科学院试验基地羊肚菌大棚调查发现,发病初期在子实体上出现白色小斑点,斑点逐渐扩大并穿孔,幼小的子实体被病原菌的白色菌丝覆盖,最终停止生长(图1中A和B)。
2.2 病原菌的分离纯化及形态学鉴定
从发病羊肚菌样品中,分离获得致病菌JS-1。将致病菌菌饼覆盖在羊肚菌菌帽部分,再置于培养皿中,3次重复,保湿培养若干天,直至有病斑形成,将病斑部位再进行分离培养,通过培养观察菌落形态、显微形态及ITS序列确定分离到的病原菌与发病菌株的致病菌为同一株病原菌。
在MYG培养基和25 ℃黑暗条件下,菌株JS-1的菌落初期为白色,轮状生长,边缘规则,菌丝绒毛状,较发达,后期菌丝生长部位培养基萎缩(图1中C)。分生孢子梗侧生,分生孢子呈链式;分生孢子条形或梭形,有间隔(图1中D)。

A—自然感病子实体;B—感病部位;C—病原菌在MYG平板25 ℃培养;D—病原菌显微形态。图1 病原菌形态特征
2.3 病原菌的分子生物学鉴定
经PCR扩增和序列测定,获得供试菌株ITS序列片段,BLAST在线比对结果表明,JS-1与长毛拟青霉Paecilomycespenicillatus(登录号:EU146306.1)相似度为99.81%;与长孢卵单隔孢霉Diploösporalongispora(登录号:KX427537.1)相似度为99.44%。将致病菌的ITS序列与相近种菌株构建系统发育树(图2),结果显示,所得病原菌JS-1与长毛拟青霉菌株及长孢卵单隔孢霉聚于同一分支,说明其亲缘关系较近。
2.4 病原菌生物学特性
致病菌菌丝在不同培养基下的生长情况见表1。在Czapek培养基上,致病菌菌丝生长速度最快,但中心菌丝浓密,边缘菌丝稀疏;在MYG培养基上,菌丝生长速度较快,菌落边缘整齐,菌丝浓密;其次为PDA培养基;SDAY培养基菌丝生长最为缓慢。在菌丝生长后期,可以观察到培养基萎缩甚至穿孔。
致病菌菌丝在不同pH试验结果见表2。羊肚菌致病菌菌丝在pH 5~9的条件下均可生长,pH 6~8时菌丝生长速度较快,且致病菌菌丝在不同pH下差异并不显著。
致病菌菌丝在22~34 ℃温度范围下的生长情况见表3,在25 ℃条件下培养的实验菌株菌丝生长速度最快,其次为22 ℃,温度高于31 ℃时,菌丝不生长。因此,JS-1菌丝较适宜的生长温度为25 ℃。
碳源试验结果表明,致病菌株在不同碳源培养基上均能生长(表4),但菌落形态及菌丝生长速率不同。在以乳糖为碳源的培养基上菌丝生长速率最快,为0.225 cm·d-1;其次为葡萄糖及淀粉,分别为0.205及0.201 cm·d-1。各培养基的菌丝密度差异较为显著,其中淀粉为碳源时,菌丝生长最为浓密;以葡萄糖为碳源时,菌丝较为稀疏。因此,致病菌JS-1菌丝生长较适宜碳源为乳糖。

图2 ITS序列系统发育树

表1 培养基对菌丝生长的影响
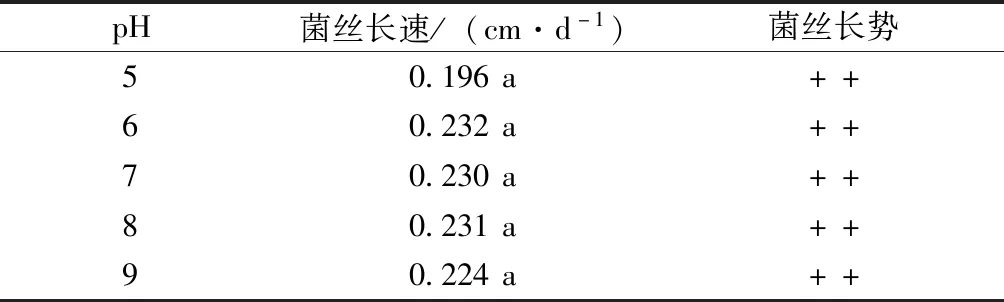
表2 pH对菌丝生长的影响

表3 温度对菌丝生长的影响
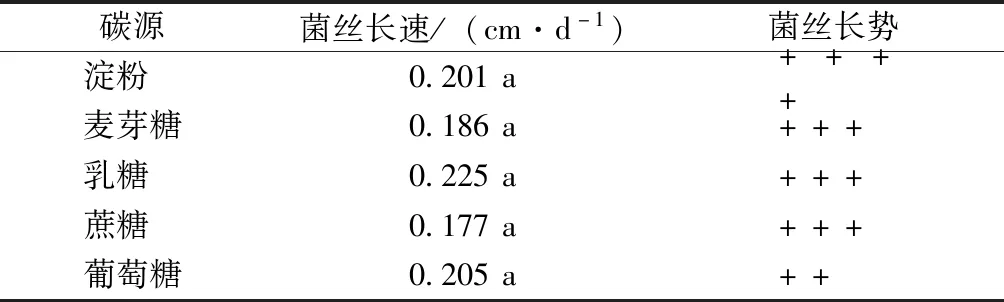
表4 碳源对菌丝生长的影响
氮源试验结果表明,菌株在不同氮源培养基上均能生长,但氮源不同,菌丝体生长速度及菌落形态差异较大(表5)。在以酵母浸粉为氮源的培养基上,菌丝体生长速度最快,为0.312 cm·d-1,菌丝生长浓密。其次为以氯化铵为氮源的培养基,菌丝生长速度为0.222 cm·d-1,但菌丝生长稀疏。而在硫酸铵、磷酸氢二钾为氮源的培养基上,菌丝体生长速度很慢,而且菌丝长势差。因此,致病菌JS-1菌丝体较适宜的氮源为酵母浸粉。
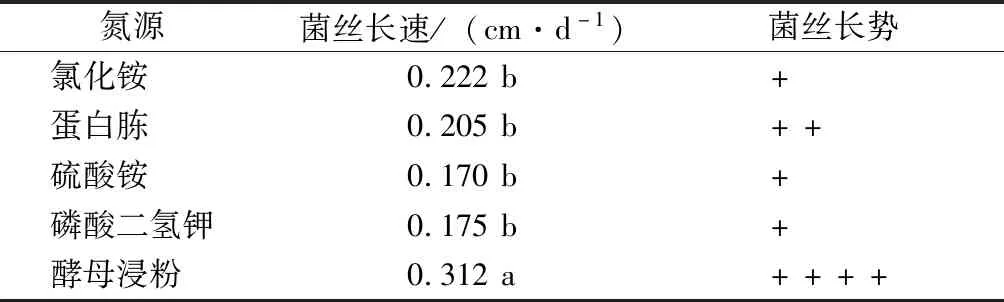
表5 氮源对菌丝生长的影响
3 讨论
近年来,羊肚菌因其低投入高回报的特点在全国范围内种植面积大幅增加,对其致病菌进行研究,对保证其品质和产量有重要意义。目前,已有研究表明,多种病原菌可侵染羊肚菌子实体导致真菌病害发生。刘伟等[6]报道羊肚菌的真菌性病害主要有霉菌性枯萎病、蛛网病、镰刀菌病。刘天海等[7]对四川等地暴发的柄腐病害进行调查鉴定,结合菌落形态和显微特征鉴定柄腐病的病原菌为Fusariumnematophilum,该病原菌菌落正面白色,背面米白色,不透明,隆起,菌丝致密,边缘整齐,菌落呈同心环纹,菌丝有隔,有分枝,无水溶性色素,分生孢子呈镰刀型,整体较粗壮,中部略宽于两端,尖端短而小,大多3隔,极少数1隔、2隔或4隔,呈3隔孢子的隔间距7~12 μm。余苗等[8]对羊肚菌白腐病病菇进行分离鉴定,采用形态学研究,结合ITS序列分析技术鉴定病原菌为曲霉(Aspergillussp.),该病原真菌菌丝体颜色为白色,菌落边缘整齐呈圆形,稍凸起,产生分生孢子后呈黄绿色,分生孢子球形、近球形。黄慧等[9]对贵州六盘水等地暴发的羊肚菌菌盖干腐病进行病原菌的分离鉴定,结合形态学和分子生物学鉴定,发现病原菌为长孢卵单隔孢霉(D.longispora),该致病菌菌落边缘整齐、表面干燥,呈白色绒毛状,有轮状花纹,显微形态下分生孢子梗透明,呈细长棍棒状,分生孢子链生,呈棍棒状或长柠檬形状,有隔。
本研究分离得到的致病菌菌落初期为白色,轮状生长,边缘规则,菌丝绒毛状,较发达,后期菌丝生长部位培养基萎缩,显微形态下分生孢子梗侧生,分生孢子链式;分生孢子条形或梭形,有间隔。测序获得的ITS序列经NCBI比对后发现与长毛拟青霉相似度为99.81%;与长孢卵单隔孢霉相似度为99.44%,进一步构建系统发育树表明JS-1的ITS序列与长毛拟青霉和长孢卵单隔孢霉聚为一支,这两者均为羊肚菌真菌病害的主要病原菌[10-11]。前人研究[12-13]结果表明,这2种真菌的分生孢子都呈链式,但长毛拟青霉的分生孢子呈椭圆形或梨形,无隔;而长孢卵单隔孢霉的分生孢子为棍棒状或长柠檬形,有隔。通过比对其形态学特征,本研究分离得到的致病菌在形态上更接近于长孢卵单隔孢霉。因此,通过结合发病特征、形态学观察及构建分子系统发育树表明该病害是由长孢卵单隔孢霉(D.longispora)侵染引起的。
此外,生物学特性研究结果表明,羊肚菌白霉病病菌最适生长温度为25 ℃,30 ℃以上不生长,pH在6~9时生长较快,说明该菌不耐高温,对pH适应范围较广,与黄慧等[9]的研究结果一致;最适碳、氮源为乳糖及酵母浸粉。本研究通过对羊肚菌白霉病病原菌的鉴定,尤其是对其进行系统的生物学特性研究,为进一步研究该病害的发病规律及田间防治奠定理论基础。

