下调S100A8表达对卵巢癌细胞恶性生物学行为的影响及其机制
赵玮玮,王华,郑艳莉
1 复旦大学附属妇产科医院病理科,上海 200090;2 南通市第一人民医院妇产科
卵巢癌是女性生殖系统常见的恶性肿瘤之一,由于其发病隐匿,早期症状不典型,多数患者就诊时已进展至中晚期,预后较差,5年生存率不足30%[1-2]。即使经手术和化疗病情得到完全缓解,80%患者在治疗后两年内仍有复发可能[3]。近年来,随着生物技术和分子生物学不断发展,分子靶向治疗成为继手术、放疗、化疗之后的又一肿瘤治疗手段。S100钙结合蛋白A8(S100A8)属于S100蛋白家族成员之一,最初发现其与许多炎症性疾病有关[4],近年发现S100A8在肿瘤发生、发展中亦发挥重要作用[5]。有研究报道,卵巢癌患者血清S100A8蛋白表达显著升高,并且其表达升高与病情进展密切相关[6]。MIRICESCU等[7]研究表明,卵巢癌的发生、发展与信号通路异常息息相关,如磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路激活能够促进卵巢癌细胞增殖、侵袭并抑制其凋亡。2020年5月—2021年5月,本研究探讨了下调S100A8表达对卵巢癌细胞恶性生物学行为的影响及其机制。现报告如下。
1 材料与方法
1.1 材料 人卵巢浆液性乳头状囊腺癌细胞株SKOV3,购自中国科学院上海细胞库。所有引物序列由上海生工生物工程股份有限公司设计合成。S100A8-siRNA、NC-siRNA由美国芝加哥大学医学中心分子肿瘤实验室惠赠。SLAN-96P实时荧光定量PCR仪,购自上海宏石医疗科技有限公司;Varioskan LUX多功能酶标仪、荧光倒置显微镜,购自赛默飞世尔科技(中国)有限公司;紫外可见分光光度计,购自南京菲勒仪器有限公司;DYCP-31DN型蛋白电泳仪,购自北京六一生物科技有限公司。Lipofectamine2000,购自美国Invitrogen 公司;逆转录试剂盒、实时荧光定量PCR试剂盒,购自上海兢准基因医学科技有限公司;MTT试剂盒,购自北京华美生科生物技术有限公司;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒,购自北京索莱宝科技有限公司;细胞划痕检测试剂盒,购自广州亿宁生物技术有限公司。兔抗人PI3K、Akt单克隆抗体,购自美国Cell Signaling Technology 公司;GAPDH单克隆抗体,购自上海群己生物科技有限公司。
1.2 细胞传代培养 将低温冷藏的SKOV3 细胞置于37 ℃水浴快速解冻,3 000 r/min 离心10 min、离心半径10 cm,弃上清液。然后加入含10% FBS 的RPMI 1640 培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。待贴壁细胞90%以上融合时,用0.25%胰蛋白酶消化,按1∶3 传代。取传3 代、对数生长期、生长状态良好的SKOV3细胞进行后续实验。
1.3 细胞转染 取传3 代、对数生长期、生长状态良好的SKOV3 细胞,以2.5 × 103个/孔接种于96 孔板,随机分为对照组、空转组、S100A8 组,每组设3个复孔,然后将96 孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。常规培养24 h,按Lipo⁃fectamine2000 说明,S100A8 组转染S100A8-siRNA,空转组转染NC-siRNA,对照组仅加入转染试剂。转染36 h,收集细胞。采用TRIzol法提取细胞总RNA,经紫外可见分光光度计鉴定,提取的总RNA 纯度和浓度合格。然后将总RNA 逆转录为cDNA,逆转录条件:42 ℃ 60 min、72 ℃ 5 min。以cDNA为模板,按实时荧光定量PCR 试剂盒说明进行PCR 扩增。引物序列:S100A8 上游引物5′-GCAACGUCAUUGAA⁃GUCUATT-3′、下游引物5′-UAGACUUCAAUGAC⁃GUUGCTT-3′,β-actin 上游引物5′-UUCUCCGAAC⁃GUGUCACGUTT-3′、下游引物5′-ACGUGACAC⁃GUUCGGAGAATT-3′。按实时荧光定量PCR试剂盒说明配制反应体系。反应条件:95 ℃ 3 min,95 ℃ 5 s、58 ℃ 30 s、65 ℃ 30 s共40个循环。PCR 扩增反应结束,绘制熔解曲线,收集循环阈值(CT)数。以β-actin为内参,采用2-ΔΔCT法计算S100A8 mRNA相对表达量。
1.4 细胞增殖活性检测 收集各组转染后细胞,调整细胞密度为5 × 103个/mL,接种于6 孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。分别于继续培养24、48、72 h,每孔加入5 g/L MTT试剂20 μL,避光孵育4 h;终止培养,吸弃孔内培养上清液,每孔加入DMSO 溶液200 μL,振荡混匀,使结晶物充分溶解。酶标仪于490 nm 波长处检测各孔的光密度(OD)值。以OD490值作为细胞增殖活性。
1.5 细胞凋亡检测 收集各组转染后细胞,以1 ×105个/孔接种于6 孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。继续培养24 h,胰蛋白酶消化,离心弃上清,收集细胞沉淀。然后用Binding Buffer 200 μL重悬,依次加入Annexin V-FITC 10 μL、PI 10 μL,轻轻混匀,室温避光孵育15 min,再加入Binding Buffer 300 μL,1 h 内上流式细胞仪检测。
1.6 细胞迁移能力检测 收集各组转染后细胞,以1 × 104个/孔接种于6孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。待细胞铺满孔底后,用1 mL无菌加样枪头垂直划一条直线,PBS冲洗,加入无血清的细胞培养基继续培养24 h。分别于划痕后0、24 h 倒置显微镜下拍照并测量划痕距离,计算迁移距离。迁移距离=0 h 划痕距离-24 h 划痕距离。以迁移距离代表细胞迁移能力。
1.7 PI3K、Akt 表达检测 ①PI3K、Akt mRNA 表达检测。收集各组转染后细胞,采用TRIzol 法提取细胞总RNA,经紫外可见分光光度计鉴定,提取的总RNA 纯度和浓度合格。然后将总RNA 逆转录为cDNA,逆转录条件:42 ℃ 60 min、72 ℃ 5 min。以cDNA 为模板,按实时荧光定量PCR 试剂盒说明进行PCR 扩增。引物序列:PI3K 上游引物5′-GACTC⁃CAAGATGAAGAAGATGTG-3′、下游引物5′-GAG⁃CATTCGCAGGTVCAAGCC-3′,Akt 上游引物5′-CGCTGCGCTGGTCGTCGACA-3′、下游引物5′-CC⁃GGAAGTCCATCGTCTCCT-3′,β-actin 上游引物5′-CGCTGCGCTGGTCGTCGACA-3′、下游引物5′-GT⁃CACGCACGATTTCCGCT-3′。按实时荧光定量PCR试剂盒说明配制反应体系。反应条件:95 ℃ 3 min,95 ℃ 5 s、58 ℃ 30 s、65 ℃ 30 s共40个循环。PCR 扩增反应结束,绘制熔解曲线,收集CT 数。以β-actin为内参,采用2-ΔΔCT法计算PI3K、Akt mRNA 相对表达量。②PI3K、Akt 蛋白表达检测。收集各组转染后细胞,加入含PMSF 的RIPA 裂解液提取细胞总蛋白,经BCA 法蛋白定量合格。然后加入等体积的上样缓冲液,100 ℃水浴5 min,使蛋白充分变性。取变性蛋白20 μg,SDS-PAGE分离。电泳结束,将蛋白电泳产物转印至PVDF 膜上。5%脱脂奶粉室温封闭60 min,分别加入兔抗人PI3K、Akt、GAPDH 一抗,4 ℃孵育过夜。次日洗膜后,加入辣根过氧化物酶标记的山羊抗人IgG二抗,室温孵育60 min,ECL发光,暗室内曝光、显影。全自动凝胶成像仪拍照,Alpha View 软件分析各蛋白电泳条带灰度值。以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
1.8 统计学方法 采用SPSS22.0 统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析或重复测量数据方差分析,进一步两两比较采用LSD-t检验;两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组S100A8 mRNA 表达比较 对照组、空转组、S100A8 组S100A8 mRNA 相对表达量分别为1.00 ± 0.00、0.96 ± 0.03、0.54 ± 0.08。S100A8 组S100A8 mRNA 相对表达量显著低于对照组和空转组(P均<0.05),而对照组与空转组比较差异无统计学意义(P>0.05)。
2.2 三组培养不同时间细胞增殖活性比较 见表1。
表1 三组培养不同时间细胞增殖活性比较(±s)
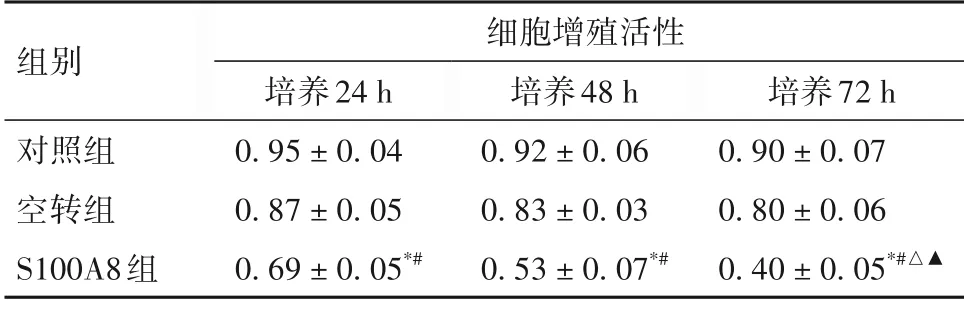
表1 三组培养不同时间细胞增殖活性比较(±s)
注:与对照组同时间比较,*P<0.05;与空转组同时间比较,#P<0.05;与同组培养24 h 比较,△P<0.05;与同组培养48 h 比较,▲P<0.05。
组别细胞增殖活性培养72 h 0.90 ± 0.07 0.80 ± 0.06 0.40 ± 0.05*#△▲对照组空转组S100A8组培养24 h 0.95 ± 0.04 0.87 ± 0.05 0.69 ± 0.05*#培养48 h 0.92 ± 0.06 0.83 ± 0.03 0.53 ± 0.07*#
2.3 三组细胞凋亡率比较 对照组、空转组、S100A8 组细胞凋亡率分别为(4.35 ± 1.33)%、(5.70 ± 1.58)%、(21.35 ± 2.56)%。S100A8 组细胞凋亡率显著高于对照组和空转组(P均<0.05),而对照组与空转组比较差异无统计学意义(P>0.05)。
2.4 三组细胞迁移能力比较 对照组、空转组、S100A8 组细胞划痕距离分别为(155.40 ± 8.60)、(153.90 ± 9.14)、(82.05 ± 3.68)μm。S100A8 组划痕距离显著低于对照组和空转组(P均<0.05),而对照组与空转组比较差异无统计学意义(P>0.05)。
2.5 三组PI3K、Akt表达比较 见表2。
表2 三组PI3K、Akt蛋白和mRNA相对表达量比较(±s)
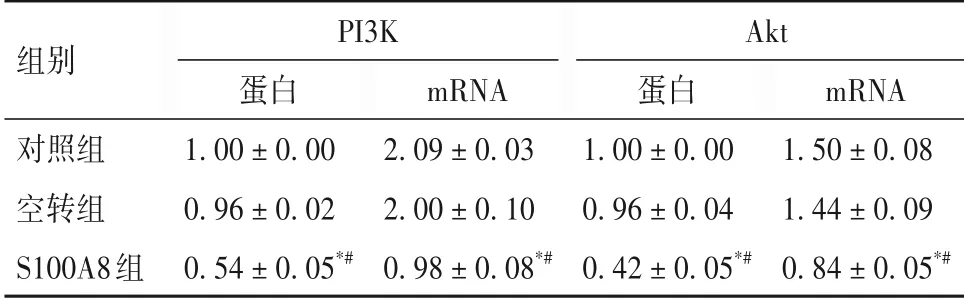
表2 三组PI3K、Akt蛋白和mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.01;与空转组比较,#P<0.01。
组别对照组空转组S100A8组PI3K蛋白1.00 ± 0.00 0.96 ± 0.02 0.54 ± 0.05*#mRNA 1.50 ± 0.08 1.44 ± 0.09 0.84 ± 0.05*#mRNA 2.09 ± 0.03 2.00 ± 0.10 0.98 ± 0.08*#Akt蛋白1.00 ± 0.00 0.96 ± 0.04 0.42 ± 0.05*#
3 讨论
卵巢癌是女性恶性肿瘤相关死亡的第五大原因,其死亡率居妇科恶性肿瘤首位。卵巢癌发病隐匿,早期症状不典型,多数患者就诊时已进展至中晚期,预后较差,5年生存率不足30%[1-2]。即使经手术和化疗病情得到完全缓解,80%患者在治疗后两年内仍有复发可能[3]。近年来,随着生物技术和分子生物学不断发展,分子靶向治疗成为继手术、放疗、化疗之后的又一肿瘤治疗手段。因此,探索卵巢癌发生、发展的分子机制,寻找其分子靶标,从而筛选合适的靶向治疗药物,对提高中晚期卵巢癌预后具有重要意义。
S100蛋白家族是一个钙结合蛋白家族,在体内能够与钙离子相互作用而发挥多种生物学作用[8]。S100A8是S100蛋白家族成员之一,具有组织特异性和细胞特异性,通常在中性粒细胞和单核细胞内表达。最初发现S100A8与许多炎症性疾病有关[4],近年发现其在肿瘤发生、发展中亦发挥重要作用[5]。有研究报道,胰腺癌组织S100A8表达显著高于其癌旁正常组织[9];在宫颈癌细胞中下调S100A8表达能够抑制肿瘤细胞恶性生物学行为[10]。ICHIKAWA 等[11]将MC38细胞注射入小鼠体内发现,S100A8敲除小鼠较野生型小鼠移植瘤的发生率明显降低,转移灶亦明显减少。以上研究为S100A8在肿瘤发生、发展中的作用提供了实验证据。有研究发现,S100A8能够促进鼻咽癌CNE2细胞增殖、迁移和基质黏附等生物学行为,其机制可能与激活Wnt/β-catenin 信号通路有关[12]。CORTESI等[13]研究表明,卵巢癌组织S100A8表达显著高于正常卵巢组织。本研究采用瞬时转染技术下调S100A8 表达,结果发现S100A8 组S100A8 mRNA相对表达量显著低于对照组和空转组,而对照组与空转组比较差异无统计学意义。结果证实,该技术能够使SKOV3细胞S100A8表达下调。进一步研究发现,S100A8组细胞增殖活性和迁移能力均显著低于对照组和空转组,细胞凋亡率显著高于对照组和空转组,而对照组与空转组细胞增殖活性、凋亡率和迁移能力比较差异均无统计学意义。结果表明,下调S100A8表达能够抑制卵巢癌细胞恶性生物学行为。
PI3K/Akt信号通路在真核生物的调控网络中普遍存在,具有调控细胞周期、参与血管生成及促进上皮间质转化等作用[14],是目前研究较多的信号通路之一。目前认为,PI3K/Akt信号通路异常激活与恶性肿瘤的发生、发展有关。有研究在乳腺癌患者中发现PI3K/Akt信号通路异常激活,并且其异常激活能够促进肿瘤细胞增殖、侵袭和迁移[15]。在宫颈癌中PI3K/Akt信号通路处于活跃状态,并通过诱导上皮间质转化促进肿瘤细胞侵袭和迁移。当卵巢癌细胞大量增殖时,PI3K/Akt信号被磷酸化,通过介导下游信号通路mTOR活性,促进卵巢癌细胞向远处迁移[16]。因此,卵巢癌细胞PI3K/Akt信号通路激活能够促进肿瘤细胞增殖、侵袭和迁移。本研究结果发现,S100A8组PI3K、Akt蛋白与mRNA相对表达量均显著低于对照组和空转组,而对照组与空转组比较差异均无统计学意义。提示下调S100A8表达能够抑制PI3K/Akt信号通路激活。
综上所述,下调S100A8表达能够抑制卵巢癌细胞增殖和迁移并促进其凋亡,其机制可能与抑制PI3K/Akt信号通路激活有关。

