外周血CEA、ATER及CTCs对晚期肺腺癌患者化疗效果及预后的评估价值分析*
李锄云
肺癌是临床最常见、死亡率最高的恶性肿瘤,其早期发病隐匿,确诊时大多数患者疾病已发展至中晚期,错失手术治疗的最佳时期,临床对于不能进行手术治疗的患者则通常以放化疗为主[1-2]。癌胚抗原(CEA)是一种多糖蛋白复合物,属于广谱性肿瘤标志物,临床通常将其用于辅助癌症诊断、判断肿瘤分期及病变程度、评估疗效、预测预后结局[3]。红细胞具备内呼吸功能、免疫功能,与机体免疫系统相关,参与机体免疫调控,协同肿瘤红细胞花环率(ATER)可反映机体红细胞免疫情况[4]。有研究表明,循环肿瘤细胞(CTCs)具备远处转移倾向,且由于其来源于肿瘤组织,用于肿瘤的识别、定性的特异性极高,随着检测技术的进步,CTCs逐渐用于恶性肿瘤的辅助诊疗、疗效评估、预后预测[5]。本研究旨在探究化疗后晚期肺腺癌患者外周血CEA、ATER 及CTCs 水平对化疗效果及预后的评估价值,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015 年1 月-2018 年5 月抚州市第一人民医院肿瘤科收治的127 例晚期肺腺癌患者的临床资料,患者均进行2 个周期化疗。纳入标准:(1)不能手术的Ⅲ期及Ⅳ期肺腺癌[6];(2)未行EGFR 检测或者EGFR 检测阴性;(3)年龄>18 岁;(4)美国东部肿瘤协作组(ECOG)评分≤2 分。排除标准:(1)合并其他恶性肿瘤;(2)临床资料缺失;(3)合并自身免疫性疾病、血液系统疾病;(4)合并急/慢性感染;(5)预计生存期≤3 个月;(6)存在精神病史;(7)合并脑转移。患者中男82 例,女45 例;年龄49~76 岁,平均(62.5±8.7)岁。本研究经医院医学伦理学委员会批准。
1.2 方法 全部患者在入院后以培美曲塞+顺铂治疗32 例;培美曲塞+卡铂治疗26 例;多西他赛+顺铂治疗35 例;多西他赛+卡铂化疗治疗34 例,持续2 个周期。在化疗结束后,均抽取患者清晨空腹静脉7 mL。其中2 mL 离心后采用血清放射免疫法检测患者外周血CEA 水平;取其中2 mL 离心后取血浆,使用全自动化学发光免疫分析仪检测患者外周血ATER 水平;取3 mL 加入红细胞裂解液进行孵育,红细胞裂解后进行离心,再加入CD45+进行磁珠富集,富集完成后使用免疫荧光法测定CTCs。本研究的CTCs 阳性判断标准为:圆形、椭圆形或者长形细胞,核质明显大于血细胞,荧光下的细胞形态完整,且同时染蓝色和绿色荧光。光镜下尖刀细胞形态和细胞核均完整,外周血见单个核细胞为阴性对照[7]。治疗2 个周期后,按照RECIST1.1 标准对患者进行效果评价。完全缓解(CR):所有非淋巴结的靶病灶消失,全部病理淋巴结短轴缩小至<10 mm;部分缓解(PR):所有靶病灶的长径总和低于基线≥30%;疾病进展(PD):以研究中所有测量的靶病灶直径之和的最小值为参照,长径和相对增加>20%,且长径和的绝对值增加≥5 mm(出现一个或多个新病灶也视为PD);疾病稳定(SD):介于PR、PD 之间[8]。将患者根据化疗效果分为CR 组(n=20)、PR 组(n=46)、SD组(n=37)、PD 组(n=24)。两组患者均随访3 年,根据患者生存情况分为存活组(n=49)、死亡组(n=78)。
1.3 观察指标及判定标准 比较不同疗效患者外周血CEA、ATER 及CTCs 差异;使用Spearman 法分析患者外周血CEA、ATER 与化疗效果的相关性。比较不同预后患者外周血CEA、ATER 及CTCs 差异,使用受试者特征(ROC)曲线分析患者外周血CEA、ATER 及CTCs 对死亡结局的预测效能。
1.4 统计学处理 本研究采用统计学软件SPSS 19.0对数据进行分析处理,外周血CEA、ATER 及CTCs以()表示,两组间比较采用t 检验,多组间比较进行单因素方差分析;使用ROC 曲线分析患者外周血CEA、ATER 及CTCs 对死亡结局的预测效能,使用Spearman 法分析患者外周血CEA、ATER与化疗效果的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 不同化疗效果患者外周血CEA、ATER 及CTCs 比较 不同化疗效果患者外周血CEA、ATER及CTCs 比较,差异均有统计学意义(P<0.05),见表1。
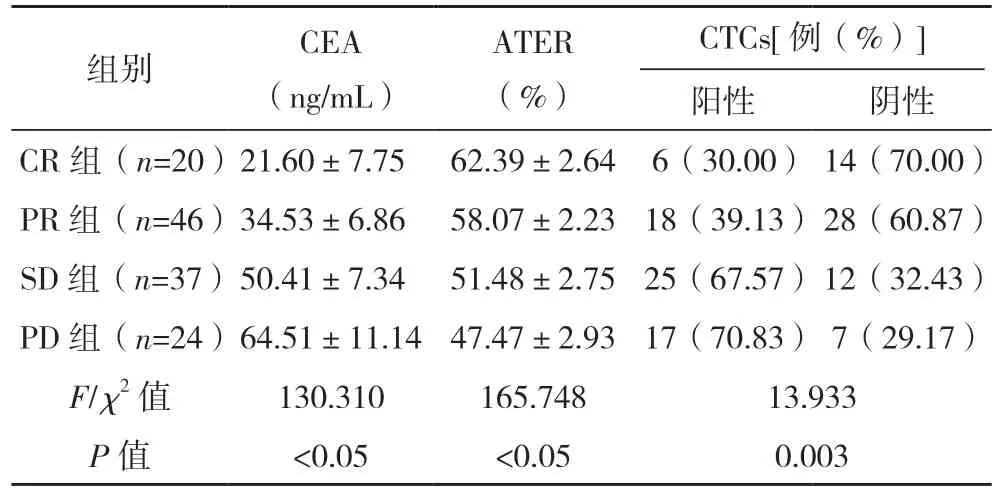
表1 不同化疗效果患者外周血CEA、ATER及CTCs比较
2.2 晚期肺腺癌患者外周血CEA、ATER 与化疗效果的相关性 Spearman 分析结果显示,晚期肺腺癌患者外周血CEA 与患者化疗效果呈正相关(rs=0.871,P<0.05),ATER 与化疗效果呈负相关(rs=-0.889,P<0.05),见表2。
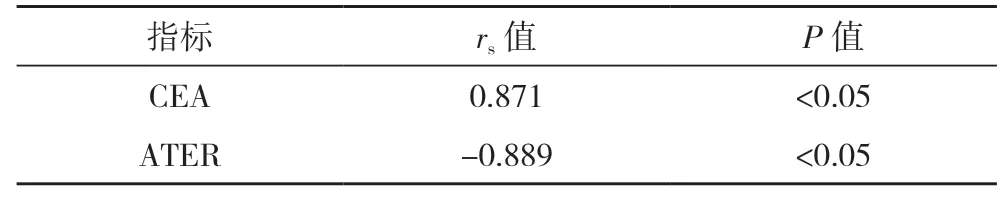
表2 晚期肺腺癌患者外周血CEA、ATER与化疗效果的相关性
2.3 存活组与死亡组患者外周血CEA、ATER 及CTCs 变化比较 存活组患者外周血CEA 水平、CTCs 阳性率均低于死亡组,外周血ATER 水平高于死亡组(P<0.05),见表3。
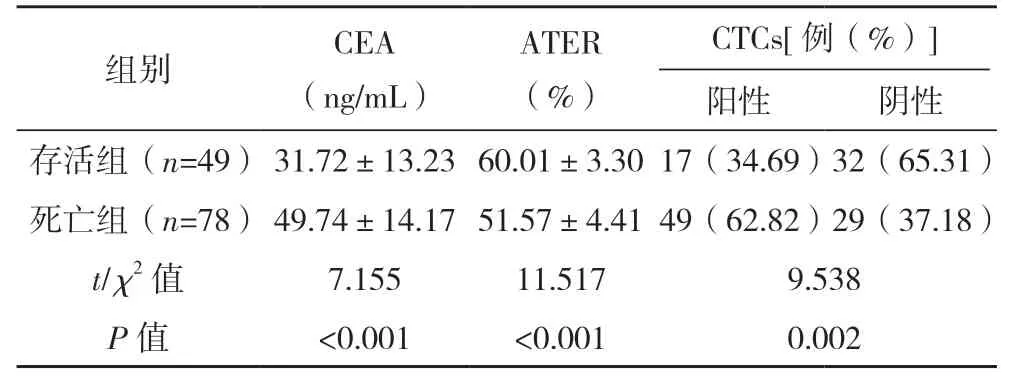
表3 存活组与死亡组患者外周血CEA、ATER及CTCs变化
2.4 外周血CEA、ATER 及CTCs 对晚期肺腺癌患者死亡结局的预测效能 ROC 曲线结果显示,外周血CEA、ATER 及CTCs 预测晚期肺腺癌患者死亡结局的AUC 为0.814、0.937、0.641(P<0.05),见表4、图1。
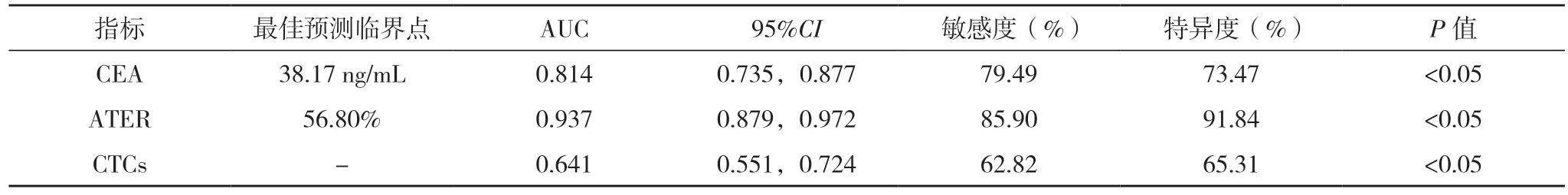
表4 外周血CEA、ATER及CTCs对晚期肺腺癌患者死亡结局的预测效能
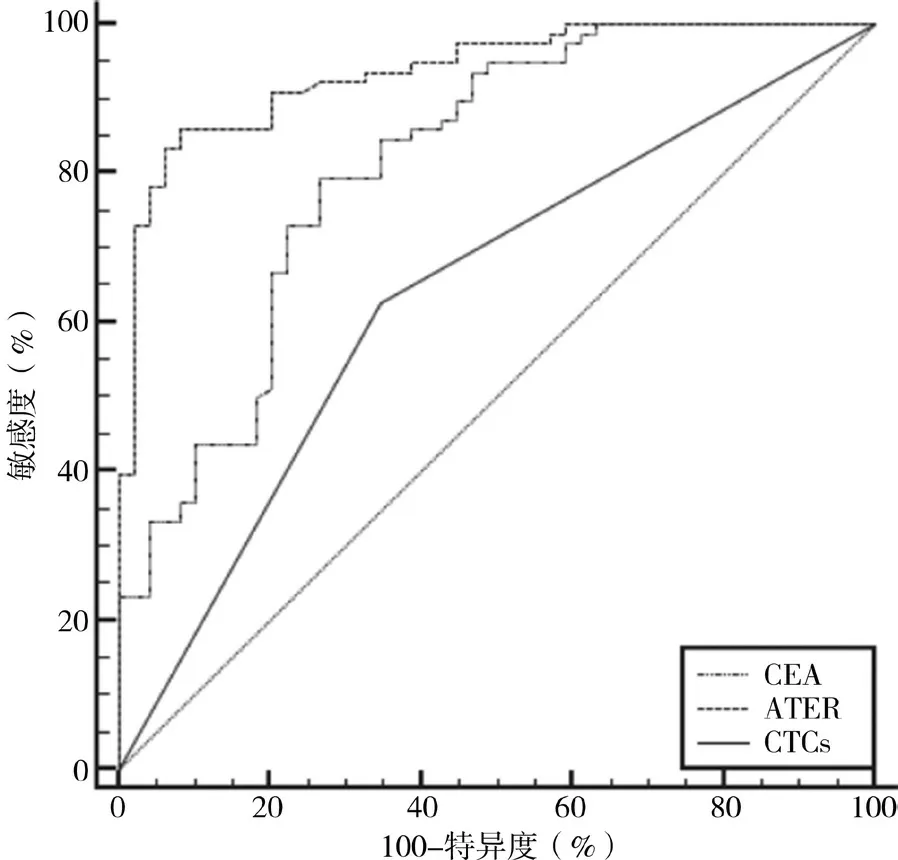
图1 外周血CEA、ATER及CTCs对晚期肺腺癌患者死亡结局的预测效能
3 讨论
近年来研究显示,我国肺癌发病率呈上升趋势,且病死率位于恶性肿瘤首位,大多数肺癌患者癌症类型属于非小细胞肺癌(NSCLC),其中又以肺腺癌为主[9-10]。随着分子生物学研究的进展,多种肿瘤标志物进入临床研究者的研究范围。血液循环系统是恶性肿瘤转移的必经之路,外周血中肿瘤标志物及其他免疫标志物均属于临床监测指标[11]。CEA 属于酸性糖蛋白,当恶性肿瘤处于进展期时,肿瘤细胞大量生长导致血管供血不足,部分肿瘤瘤体破裂导致CEA 大量释放进入血液,使机体外周血CEA水平上升[12]。红细胞参与机体的免疫调节,具备识别、黏附、杀灭抗原、清除免疫复合物等作用,其中ATER 属于红细胞免疫相关指标,其水平与机体免疫功能呈正相关[13]。CTCs 是原发病灶及转移病灶之外的肿瘤细胞,对CTCs 进行监测有利于发现肿瘤转移情况[14]。
本研究结果显示,不同化疗效果患者外周血CEA、ATER 及CTCs 存在显著差异,且经Spearman分析,晚期肺腺癌患者外周血CEA 与患者化疗效果呈正相关,与ATER 呈负相关(P<0.05)。其原因在于:(1)外周血CEA 可相对快速反映肿瘤负荷变化,化疗效果理想的患者化疗后CEA 水平更低[15];(2)红细胞免疫可促进淋巴粒细胞对肿瘤细胞的黏附,进而使粒细胞吞噬肿瘤细胞,可调控肿瘤免疫,进行化疗后患者继发性红细胞免疫黏附功能低下的情况得到改善,运输、清除癌细胞的能力得到增强[16];(3)化疗通过诱导肺腺癌患者的肿瘤组织及血液循环系统中的肿瘤细胞坏死、凋亡,使患者肿瘤血管内皮细胞增殖及血管生成受抑制[17],效果显著的患者血液循环系统中CTCs 减少更显著。此前有研究证实,外周血CEA 可用于评估晚期肺腺癌患者的疗效[18],本研究结果与之一致。
本研究结果显示,存活组患者外周血CEA 水平、CTCs 阳性率均低于死亡组,外周血ATER 水平高于死亡组(P<0.05)。推测其原因可能与如下因素相关:(1)红细胞免疫主要通过红细胞黏附功能进行,恶性肿瘤患者的红细胞免疫黏附功能低下,清除癌细胞的能力也随之下降[19],ATER 水平越低表示患者红细胞免疫功能越差,不利于患者生存;(2)CTCs 的流动及侵袭性均较强,较易黏附于血管、发生远处转移,外周血CTCs 上升提示患者更易发生肿瘤复发,导致不良预后结局[20]。从ROC曲线结果来看,外周血CEA、ATER 及CTCs 均可预测晚期肺腺癌患者的结局。此前有研究证实,外周血CEA、CTCs 可用于预测癌症患者预后结局[21],本研究结果与之存在一定相似。
本研究不足之处与改进方法如下:(1)仅在患者化疗结束后对患者进行外周血指标检测,未探究治疗不同时间点的外周血CEA、ATER 及CTCs 动态变化情况,有待临床深入研究,进行多时间、多次检测上述指标则更合理;(2)未分析外周血CEA、ATER 及CTCs 对晚期肺癌患者肿瘤转移、肿瘤大小的影响,还有待临床深入研究。
综上所述,不同化疗效果、存活与死亡结局的晚期肺腺癌患者之间外周血CEA、ATER 及CTCs存在显著差异,经Spearman 分析,外周血CEA、ATER 与患者化疗效果存在相关性,且经ROC 曲线分析,上述三种指标可预测患者死亡结局。

