实时荧光聚合酶链反应检测新型冠状病毒室内质控方法初探
刘 晶,杜晶辉,刘瑞岩,鲍志军,贺 鑫,赵 岩,王 俊,雷曜荣,刘 旭
天津中医药大学第一附属医院检验科/国家中医针灸临床医学研究中心,天津 300193
新型冠状病毒核酸检测是我国常态化疫情防控的技术保障,已在全国二、三级医疗机构广泛开展,是切断病毒传播的重要防线。实时荧光聚合酶链反应(RT-PCR)技术具有高灵敏度、高效高通量的优势,可在疾病早期或潜伏期内识别微量的病毒核酸片段[1],是《新型冠状病毒肺炎实验室检测技术指南》推荐的常规检测方法[2]。为确保核酸检测结果的准确性,各实验室需具备完善的实验室质量控制体系。2021年5月国家卫生健康委员会颁布的《新型冠状病毒肺炎防控方案》(第八版)文件指出[3],实验室应规范开展室内质控,每批检测至少有1 份弱阳性质控品、3 份阴性质控品,室内质控是全面质量控制体系的关键环节。新型冠状病毒RT-PCR检测方法属于定性分析,仅简单判断阴阳性质控是否在控,无法评价核酸提取效率是否达标、检测过程是否存在系统误差或偶然误差。本文在阴阳性质控在控的基础上,将定性PCR结果进行计量资料转换,统计弱阳性质控靶基因循环阈值(Ct值),绘制Levey-Jennings质控图,回顾性分析检测系统的稳定性。
1 材料与方法
1.1仪器与试剂 全自动核酸提取仪BG-Flex-96,配套核酸提取及纯化试剂TQ-BG-003-96D-96,新冠病毒核酸检测试剂盒(荧光PCR法),以上均购自上海伯杰公司。实时定量PCR仪QuantStudio 5,购自美国Thermofisher公司。
1.2质控物来源 本实验质控物来自第三方噬菌体假病毒颗粒,批号2021005,浓度范围:5.35×103+3~5.24×104+4 copy/mL,购自广州邦德盛生物科技有限公司。
1.3方法
1.3.1新冠病毒核酸检测 新冠病毒的核酸检测严格按照伯杰试剂说明书和按本实验室标准操作规程文件进行操作。使用伯杰核酸提取试剂96孔板吸取200 μL样本,首先样本与裂解液和磁珠结合,经过两次洗涤去除蛋白质和杂质,洗脱出核酸。将5 μL核酸加入20 μL扩增反应液,形成25 μL反应体系,在PCR仪进行扩增反应,应用QuantStudioDesign & Analysis软件进行扩增曲线分析进行结果判读。每批次检测均设置3个阴性质控、1个弱阳性质控。
1.3.2弱阳性质控稀释倍数的选择 使用无菌生理盐水按照1∶5、1∶10、1∶20、1∶30、1∶40对第三方质控物进行倍比稀释,每个稀释倍数分装8支,每支200 μL,分装至1.5 mL离心管。配制完成后,5个浓度水平的40支质控物立即进行RT-PCR核酸检测。
1.3.3绘制定性检测散点图 记录每批次阴性质控和弱阳性质控的结果并按照自定义数值绘制定性结果散点图:将弱阳性质控定义为数值“1”,检测为阳性时定义数值为“2”,检测为阴性时定义数值为“-2”;将阴性质控定义为“-1”,检测为阴性时定义数值为“-2”,检测为阳性时定义数值为“2”;将质控品定义数值与检测结果定义值相加,等于“3”或“-3”为在控,等于“1”为假阳性反应,等于“-1”为假阴性反应[4]。
1.3.4弱阳性质控的配制与数据采集 (1)弱阳性质控的配制:首先使用生理盐水将第三方质控物按1∶3稀释分装至1.5 mL离心管(无RNase),置于-80 ℃冰箱贮存备用。每批检测时取一支配制好的质控物,室温平衡,充分混匀并瞬离。进行核酸提取时,弱阳性质控位置加入20 μL配制阳性质控+180 μL生理盐水,共200 μL,即再进行10倍稀释。(2)收集本实验室2022年1-2月每批次实验的原始数据;统计所有实验批次弱阳性质控的靶基因Ct值,建立Excel 2010数据库录入数据。分别对N基因和ORF1ab基因两组Ct值进行正态分布检验,当P>0.05表示服从正态分布,当P<0.05表示不服从正态分布。
1.3.5绘制Levey-Jennings质控图 根据前20次检测结果分别计算N基因和ORF1ab基因的靶值X和标准差s,上下限为X±3s,警告限为X±2s。以检测次数为横坐标,以Ct值为纵坐标绘制Levey-Jennings质控图。
1.4统计学处理 使用Microsoft Excel 2010进行数据的统计、分析、制图。应用IBM SPSS21.0对数据进行正态分布检验。
2 结 果
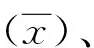

表1 5个稀释倍数的弱阳性质控靶基因Ct值比较(n=8)
2.2RT-PCR定性室内质控散点图 根据自定义数值绘制定性检测结果散点图,如图1所示。在97个批次检测结果中出现1次失控,即第85次(即2月2日第3批次)弱阳性质控检出阴性结果出现了“假阴性”反应。发现失控后,立即采取纠正措施并复检。
图1 荧光PCR定性室内质控散点图
2.3弱阳性质控靶基因Ct值的正态性检验 2021年1-2月份弱阳性质控靶标N基因、ORF1ab基因Ct值进行正态性检验,结果两组数据均符合正态分布(P>0.05)。见图2。

注:N基因Ct值正态分布(P=0.574)ORF1ab基因Ct值正态分布(P=0.08)。
2.42022年1-2月弱阳性质控靶基因Ct值Levey-Jennings质控图 弱阳性质控N 基因靶值X为34.13,标准差s为0.652,变异系数CV为1.91%。结果如图3所示,所有Ct值均在X±3s以内,5次出现±2s警告,根据Westgard多规则法分析,符合质控规则。弱阳性质控ORF1ab基因靶值X为35.30,标准差s为0.910,CV为2.58%。第73次检测(2月20日)Ct值超过+3s,见图4。经原始曲线分析,该次检测ORF1ab曲线第1~10个循环基线波动较大,整体信号强度较低。5次出现±2s警告,根据Westgard多规则法分析,第31~41批次检测违反了10x规则,第73~80批次违反了R 4s规则。

图3 2022年1-2月弱阳性质控N基因Levey-Jennings质控图
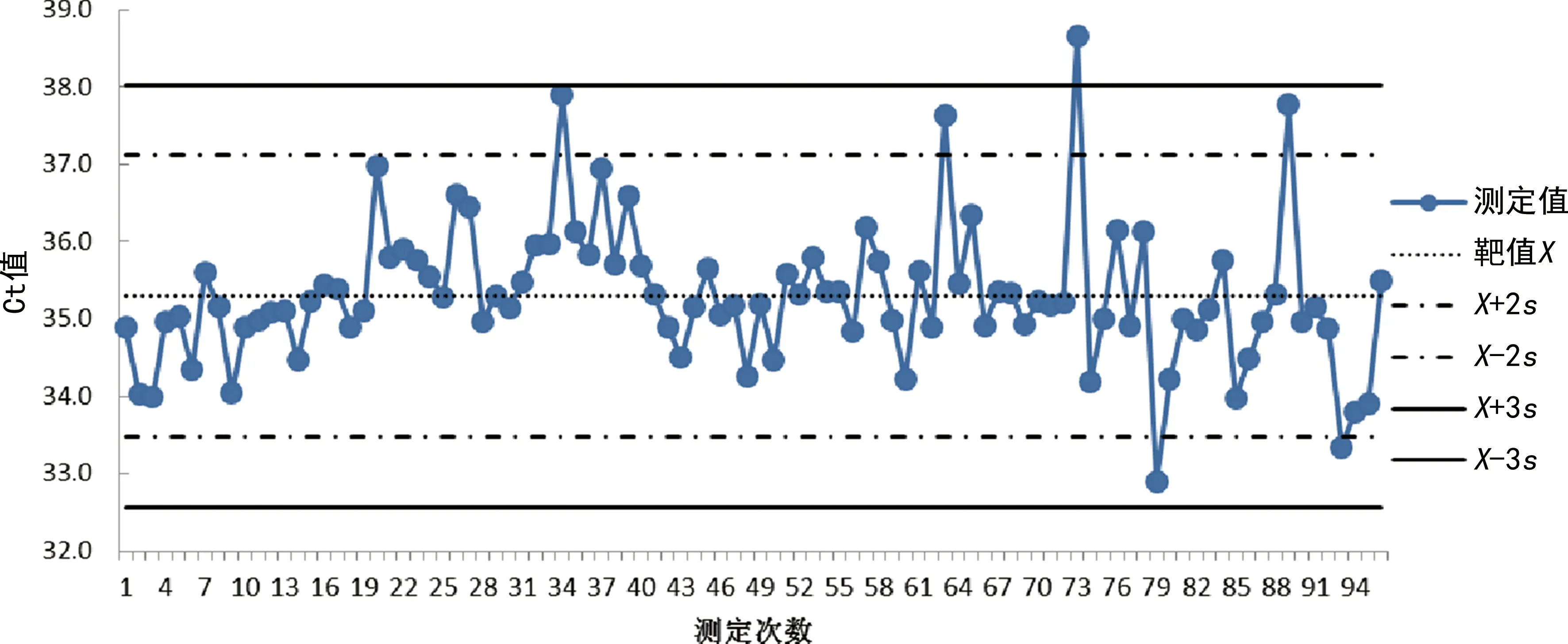
图4 2022年1-2月弱阳性质控ORF1ab 基因Levey-Jennings质控图
3 讨 论
目前RT-PCR法是临床上广泛应用的新冠病毒核酸检测方法,是确诊COVID-19的直接证据[3],因此准确的核酸检测结果在疾病诊断和疫情防控中承担重要作用。《新型冠状病毒实验室检测专家共识》指出[5],实验室应从试剂质量控制、操作质量控制、设置对照、多指标诊断等多方面避免假阴性、假阳性结果出现。因此做好全过程质量控制,特别是室内质量控制尤为重要,它是连续评价实验室工作可靠性程度的方法,是确定检测结果是否可靠、可否发出报告的关键环节[6]。
首先,本研究选用第三方假病毒技术的阳性质控品,原因是假病毒技术以MS2噬菌体外壳蛋白为载体,包裹核酸检测的靶标RNA,具有真实病毒相似的物理结构,可参与核酸提取、反转录、扩增全过程,实现核酸检测的全过程质量控制[7-8]。第三方邦德盛的阳性质控品(浓度范围:5.35×103+3~ 5.24×104+4 copy/mL),为确定弱阳性质控的稀释倍数,进行5个稀释倍数的平行试验,结果表明,确定最接近检出限且稳定性高的稀释倍数为1∶30,平均浓度为556.7 copy/mL(浓度范围:178.3~1 746.7 copy/mL),是核酸检测试剂检出限(500 copy/mL)的1.2倍左右,符合弱阳性质控品的浓度要求。
其次,关于核酸检测荧光PCR法的室内质控,文件规定“每批检测至少有1份弱阳性质控品(第三方质控品)、3份阴性质控品(生理盐水)[3]。”“核酸检测试验以及其他定性试验可选择适当浓度的质控物,采用定性检测结果合格即判为在控的方法[9]。”据此本研究采用自定义弱阳性质控及阴性质控数值的方法,绘制核酸检测定性室内质控散点图,直观地反映出质控品的检测结果与预期检测结果不一致的情况并判定为“失控”,绘制定性质控散点图简单易行,符合国家相关规定。
最后,Ct值是扩增曲线与阈值线的交叉点,是判读结果是否为阴(阳)性的重要依据,是荧光PCR反应中靶标浓度的相对测量[10]。为更加精细的进行PCR实验室质控管理,本研究参照定量测定室内质控的方法,基于靶基因Ct值建立室内质控的L-J质控图,可分辨检测过程的系统误差和偶然误差,提高检测的准确性和精密度。本研究共累积2022年1-2月每批次检测的弱阳性质控Ct值97个,对两组靶基因Ct值数据进行正态性检验后,均符合正态分布,适宜采用L-J质控图分析其离散程度和变化趋势。本研究对上述弱阳性质控Ct值进行了L-J图分析,如图3、4所示。结果表明,N基因的CV为1.91%,ORF1ab基因的CV为2.58%,尽管目前没有明确的病毒核酸可接受的CV范围,但可以肯定的是长期统计室内质控CV值是反映实验室每个检测环节的稳定性,能够检测操作中的长期变化趋势,及时发现测定过程中存在的问题[11-12]。
如图4所示,结果表明ORF1ab基因第73批次超过3s属于偶然误差,产生偶然误差的原因可能是(1)核酸提取过程中靶基因丢失、或存在PCR抑制物的残留[13];(2)试剂问题,如反转录酶的失活;(3)人员操作失误。根据Westgard多规则质控法,第31~41批次违反了10x规则属于系统误差,第73~80批次违反了R 4s规则,离散程度较大,同样属于系统误差,通过分析,产生系统误差的原因是PCR反应前10个循环基线波动较大,扩增曲线不平滑,S型曲线在对数增长期斜率偏低。查找原因发现八连排离心管由于质量问题与扩增仪小孔不服帖,导致受热不均匀,影响扩增结果。因此通过弱阳性质控靶基因Ct值的L-J质控图,可分析出偶然误差和系统误差出现的原因,及时采取纠正措施,从而提高核酸检测结果的可靠性。
本研究中,定性室内质控散点图是判断该批次检测是否有效、是否可发出报告的依据,L-J质控图用作回顾性分析荧光PCR检测系统稳定性的方法,分析偶然误差或系统误差的原因,及时发现操作过程失误或试剂耗材质量问题。当定性室内质控散点图和L-J质控图两种方法结果不一致时,本实验室以定性质控散点图“失控”作为质控失败重新复检的依据。
综上所述,本文创新性的提出将定性质控散点图及L-J质控图联合应用于荧光PCR检测新冠病毒的室内质控,能够较全面地反映核酸检测的有效性和稳定性,监控核酸提取、扩增全过程。这2种方法在本实验室已应用近1年时间,效果优于既往的“阴阳性质控在控即合格”单一判断方法,具有很好的预警功能。

