DsbC介导HCV优势抗原表位原核可溶性表达与间接ELISA分析*
肖彭莹,黄国红,王丽君,孙卫国,张灵霞,侯江厚△
1.昆明市妇幼保健院妇女保健部,云南昆明 650013;2.解放军总医院第八医学中心结核病研究所,北京 100091
丙型肝炎病毒(HCV)的抗体检测目前仍是诊断HCV慢性感染和进行献血员筛查的主要方法。随着技术方法的进步,HCV抗体检测试剂已发展到第三代,抗原主要组成为结构区C蛋白、非结构区NS3及NS5区重组抗原,虽然检测的灵敏度得到很大提高,但由于抗原序列包含有较多非保守性序列,导致特异度不强[1],需要通过生物信息学的方法筛选特异度强优势保守抗原序列。同时HCV感染具有异质性特点,存在不同的基因型和亚型,同一型各片段抗原性存在差异,其相应的抗体在体内出现的时间、持续状态及意义有一定的差别[2],在进行抗原筛选时,从我国的主要基因型1b、2a 和 6a 出发,从不同HCV 基因序列不同片段中挑选优势的编码抗原,是进行抗体检测成功的关键。原核系统因为自身的缺陷,在重组外源蛋白时,存在表达量低和容易形成包涵体的缺点,二硫化物异构酶 DsbC 作为伴侣分子,不但可以提高重组蛋白的正确折叠,促使外源蛋白可溶性形式存在,还能提高目的蛋白的表达水平和生物活性[3]。在本研究中,从HCV的结构蛋白与非结构蛋白中,通过生物信息学的方法,筛选出尽可能多并且特异度强的抗原表位,进行串联形成抗原肽,在原核系统内进行重组表达,同时以DsbC 作为融合分子进行融合表达,纯化两组蛋白,评价两组抗原融合肽在HCV 感染者血清诊断中的灵敏度和特异度,评价 DsbC 蛋白作为伴侣分子在重组抗原血清学诊断上提高其灵敏度、特异度和生物活性中的作用。
1 材料与方法
1.1材料 原核表达载体pET-DsbC、pET-28a 和宿主感受态BL21(DE3)由解放军总医院第八医学中心(下称八中心)实验室制作保存;限制性内切酶 NdeⅠ、HindⅢ和XhoⅠ及T4 DNA 连接酶均购自美国 NEB 公司。质粒小提试剂盒、DNA 凝胶回收和PCR产物回收试剂盒为国产天根生物科技公司产品;His标签亲和树脂购为GE公司产品,自行灌装纯化柱;山羊抗人IgG(HRP标记)为索莱宝生物公司产品,酶联免疫吸附试验(ELISA)法抗体检测试剂盒购于北京飞凯生物技术公司。100份HCV阳性血清来源于昆明市妇幼保健院和八中心血液科血清库。100份HCV阴性血清(血液抗-HCV阴性;血液HCV RNA阴性)来源于八中心体检中心。ELISA法严格按照生物安全有关规定操作,遵循实验室操作的常规规定。
1.2方法
1.2.1HCV 优势抗原表位信息学筛选策略 HCV 病毒核心蛋白C、非结构蛋白NS3、NS4和NS5区拥有保守的免疫显性区域[4],其中HCV核衣壳蛋C与NS3蛋白在HCV多种基因型中最为保守[5]。以我国HCV主要基因型1b(GenBank:ACJ37239.1)、2a(GenBank:AGZ91309.1)、 6a(GenBank:BBH 48831.1) 型为分析对象,综合考虑亲水性、柔韧性、表面可及性和抗原指数,采用 Emini Surface Accessibility Prediction、Karplus & Schulz Flexibility Prediction、Kolaskar & Tongaonkar Antigenicity和 Parker Hydrophilicity Prediction 等算法筛选优势表位,通过在线 Blast 分析序列的保守性,剔除特异度低的部分,结合文献[6-8],选取HCV的C蛋白和NS3蛋白的部分序列为主要骨架,加入NS4和NS5优势抗原肽段组成待检测的抗原肽,在短肽之间加入GSG或者AAY进行串联,命名为P367。序列提交北京华大基因进行合成,对应的核酸N端加入限制性酶切位点HindⅢ-NdeⅠ,C端加入终止密码子TAA和限制性酶切位点XhoⅠ序列,合成编号为WHC2112223。
1.2.2pET-P367、pET-DsbC-P367表达载体的构建与鉴定 将合成的克隆载体pUC-P367菌株进行扩大培养后,提取克隆载体,然后分别以限制性内切酶HindⅢ与XhoⅠ、NdeⅠ与Xhol进行双酶切,用DNA电泳凝胶回收试剂盒回收融合基因片段P367,将回收的双酶切片段分别与对应双酶切的表达载体pET-DsbC、pET-28a进行连接,热激法转化表达宿主感受态细胞BL21(DE3),涂含有卡纳抗性固体平板37 ℃隔夜培养,挑选灰白色光滑菌落转接到含有50 μg/mL卡那霉素的5 mL LB培养基中激活,选取阳性克隆送华大基因进行测序以确保阅读框的正确。
1.2.3HCV P367抗原肽原核重组表达与纯化 将筛选到的阳性克隆菌株pET-P367、pET-DsbC-P367接种于LB培养基中(含卡纳霉素50 μg/mL),37 ℃振荡培养过夜。然后按照1∶50的比例接种到100 mL LB培养基中(含卡纳霉素50 μg/mL),37 ℃振荡培养3~4 h;再按照1∶20的比例接种到1 000 mL LB培养基中(含卡纳霉素50 μg/mL),37 ℃振荡培养到吸光度(A600)值为0.6时,加入诱导剂异丙基硫代半乳糖苷(IPTG),终浓度为0.5 mmol,37 ℃恒温摇床震荡诱导7 h,收集1 mL菌液,12 000 r/min离心2 min。沉淀重悬于400 μL的1×SDS上样缓冲液中,沸水浴5 min,取20 μL进行12% SDS-PAGE胶电泳。
4 ℃ 条件下以 6 000 r/min 离心收集表达菌体,1×PBS悬浮混匀冰育,置于冰水状态下进行超声碎菌。高速离心分离上清和沉淀,由于P367以包涵体形式存在,采用柱上复性复性的方法对P367进行纯化,取包涵体以1% triton-100洗涤两次,以7 mol尿素+PBS 充分溶解包涵体,高速离心后取上清以2 mL/min 缓慢结合镍离子螯合的亲和层析柱,缓慢柱流速PBS溶液进行柱上复性,以50 mmol咪唑+PBS洗脱除去杂蛋白、以120 mmol咪唑+PBS 洗脱收集复性后的融合肽 P367;取 DsbC-P367 融合蛋白表达后超声上清,同样以镍离子螯合的亲和层析柱进行亲和纯化,以80 mmol咪唑+PBS洗脱除去杂蛋白、以150 mmol咪唑+PBS洗脱收集复性后的融合肽DsbC-P367。两组纯化的样品分别取20 μL 变性后进行12% SDS-PAGE 电泳分析融合蛋白的纯度,终产品以水透析除去咪唑和盐离子,冰干保存。
1.2.4DsbC-P367、P367多表位抗原融合肽抗原性Western blot分析 纯化后的DsbC-P367、P367蛋白以PBS 配制成1 mg/mL的母液,各取5 μL煮沸变性,12% SDS-PAGE电泳后半干法转移(恒压20 V,30 min)至硝酸纤维系膜(NC膜)上。5%脱脂奶粉37 ℃封闭1 h,37 ℃条件下与1∶50稀释HCV阴阳性血清后孵育1 h,以PBS震荡洗膜5次,再以HRP标记的羊抗人IgG孵育1 h,同样震荡洗涤5次,ECL暗室自动曝光显影分析DsbC-P367、P367蛋白的抗原性及其特异度。
1.2.5HCV两组融合肽DsbC-P367、P367最佳包被浓度 为了验证两组不同融合肽在血清HCV-IgG抗体检测的最佳包被浓度,采用浓度等比梯度对两组重组融合肽进行稀释,以用碳酸盐缓冲液将纯化的重组蛋白DsbC-P367、P367稀释为1.0、2.5、5.0、10.0及20.0 μg/mL,分别取100 μL包被酶标板,37 ℃包被2 h,除去包被液,加入150 μL封闭液37 ℃封闭2 h,甩干封闭液,洗涤5次;每孔加PBS和待测稀释血清各50 μL,每个样品设置两个平行孔,空白孔不加液体,37 ℃温育30 min,洗涤5次,拍干;加入HRP标记山羊抗人IgG(1∶5 000),37 ℃ 孵育20 min后洗涤;每孔加入底物液A和B各50 μL,轻拍混匀,37 ℃ 避光显色10 min;加入2 mol/L H2SO4终止液50 μL进行终止反应,酶标仪450 nm波长下测定各孔A值,选用P/N 值最大 (P为标准阳性血清A450;N为标准阴性血清A450)时的条件为最佳反应条件。
1.2.6HCV两组融合肽DsbC-P367、P367血清抗体间接ELISA差异分析 为了验证两组不同融合肽在血清HCV-IgG抗体检测的差异性和可行性,采用间接ELISA实验进行验证。血清样本为经过“金标准”筛选的阴阳性血清,同时以成熟的商品化试剂盒进行比较。将DsbC-P367、P367两种融合肽以包被缓冲液均稀释成10 μg/mL,ELISA每孔包被100 μL。ELISA实验步骤同方法1.2.5。
1.2.7DsbC-P367、P367间接ELISA特异度、灵敏度和符合率分析 将100份明确HCV阳性血清和100份明确HCV阴性血清以商品化HCV-IgGELISA法检测试剂盒进行复检,操作方法严格遵照说明书进行,同上述实验同批同时操作,检测A值,分析获得的两组重组蛋白用于ELISA血清抗体检测中体现出的灵敏度、特异度和相对试剂盒的符合率。
1.3统计学处理 采用SPSS22.0统计软件进行统计分析;散点图用GraphPad Prism 5.00软件绘制;ELISA测定的A值分布进行Wilcox检验;cut off值以阴性结果A值均值2.1倍作为临界值。用McNemer检验及Kappa一致性检验评价不同检测方法的一致性,以P<0.05为差异具有统计学意义。
2 结 果
2.1HCV优势抗原表位生物信息学分析与筛选、串联 以我国HCV的1b、2a和6a型为分析对象,通过对其抗原优势表位的预测,结合BLAST保守性分析,选择的抗原序列为:HCVC(1b) aa1~60、NS3(1b) aa1201~1301、NS4A(1b)aa1~30、NS4A(2a) aa1~30、NS5A(2a) aa2272~2331等5个抗原区域作为优势抗原表位组合框架,并在合成的C端补充加入NS3(1b) VDFIPVEGDPTTMR、Core(6a)PALSTGLIH、NS4A(2a)SIIGRLHINQRTVVAP、NS4B(1b)SRGNHVSPTHYVPESDA、E2(1b)YEVRNVSGVYH 5种抗原短肽,短肽之间以AAY或GSG相连。合成的序列命名为P367,核酸两端加入相应的酶切位点和终止密码子序列。
2.2DsbC-P367、P367融合肽表达载体的构建与鉴定 全序列合成的克隆载体pUC-P367分别以限制性内切酶HindⅢ与XhoⅠ、NdeⅠ与XhoⅠ进行双酶切,UV灯下观察片段大小,融合肽P367含有367个aa,对应核酸大小为1 100 bp(图1),两组双酶切产生的核酸片段大小均在1 100 bp,符合预期。将双酶切的核酸片段P367进行胶回收后,克隆到原核表达载体pET-DsbC、pET-28上。

注:M为标志物;1为双酶切载体pUC-P367(HindⅢ与XhoⅠ);2为双酶切载体pUC-P367(NdeⅠ与XhoⅠ)。
2.3HCV优势表位融合肽DsbC-P367、P367原核重组表达与纯化 对DsbC-P367、P367两组融合蛋白进行小样表达,SDS-PAGE结果发现,两组蛋白在原核系统均获得高效表达,相对分子质量分别为43.0×103与65.0×103(图2、3),与预期一致。超声破碎后发现,P367融合肽主要以包涵体形式存在,而DsbC-P367融合肽大部分以可溶形式存在超声上清中,实验结果符合实验设计预期,对两组重组蛋白分别采用包涵体柱上复性和上清亲和纯化,SDS-PAGE电泳发现,经亲和纯化后,P367融合肽纯度分别为92%;DsbC-P367融合肽纯度为90%(图4、5),符合后续血清学抗体 ELISA 实验要求。
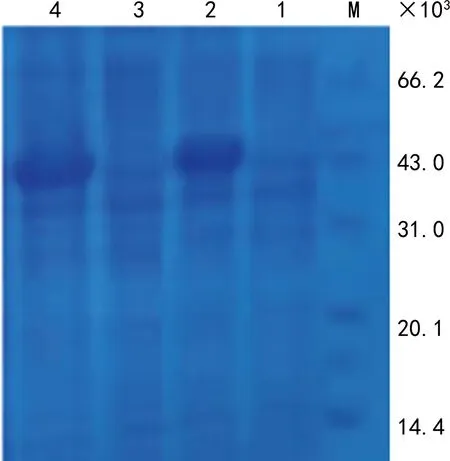
注:M为低分子量蛋白标准;1为未诱导的全菌体;2为诱导P367全菌体蛋白;3为超声破碎后上清;4为超声破碎后沉淀。

注:M为低分子量蛋白标准;1为未诱导的全菌体;2为诱导 DsbC-P367 全菌体蛋白;3为超声破碎后上清;4为超声破碎后沉淀。

注:M为低分子量蛋白标准;1为复性后P367融合肽。

注:M为低分子量蛋白标准;1为亲和纯化后DsbC-P367融合肽。
2.4DsbC-P367、P367 融合肽抗原性 Western blot 实验结果 纯化后 DsbC-P367、P367 两组融合肽均可与 HCV-IgG阳性血清发生特异性反应,通过Western blot 实验初步鉴定了两组蛋白的抗原性。实验中以 HCV 阳性血清作为一抗,HRP 标记的山羊抗人 IgG 为二抗,暗室曝光后在 NC 膜出现单一的条带,分子量同预期一致(图 6),阴性对照无条带显现。

注:1为P367;2、3为DsbC-P367;4为无关蛋白阴性对照。
2.5HCV 两组融合肽DsbC-P367、P367最佳包被浓度确定 通过ELISA实验检测两组不同融合肽在血清 HCV-IgG抗体检测的最佳包被浓度,对抗原浓度进行等比梯度稀释,实验结果确定DsbC-P367、P367最佳包被浓度均为10 μg /m L,P/N 值最大。实验结果见表1。
表1 DsbC-P367、P367蛋白最佳包被浓度的确定
2.6DsbC-P367、P367血清抗体间接ELISA实验分析结果 以获得的两组融合肽作为包被抗原建立间接法ELISA试剂,分别对明确HCV阳性样本和阴性样本各100份进行检测。参照文献,实验中cut off值设为阴性血清的A值均值2.1倍。实验结果发现,DsbC-P367阳性样本A值分布为(1.680±0.068);P367阳性样本A值分布为(1.574±0.047);阴性血清样本A值分布为(0.094±0.009);cut off值为0.197。采用SPSS22.0统计分析,McNemer检验显示:DsbC-P367融合肽与确定阳性样本比较,P=1.00,Kappa=0.950;P367融合肽与确定阳性样本比较,P=1.00,Kappa=0.910。采用商品化试剂盒检测对样本血清进行复检,结果检出阳性92份,假阳性7份,其McNemer检验P=1.00,Kappa=0.910。所得数据分析见图7。
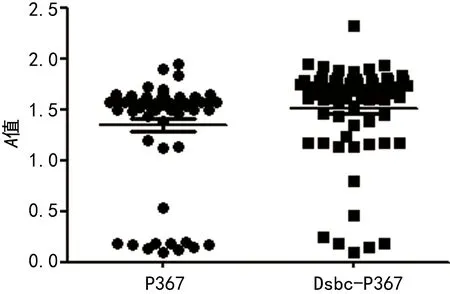
图7 DsbC-P367与P367融合肽在HCV阳性
2.7DsbC-P367、P367间接ELISA特异度、灵敏度与符合率 间接ELISA测定结果发现,DsbC-P367与P367针对明确阳性血清检出样本数分别为96、90,其灵敏度分别为96.0%与90.0%;相对于阴性对照血清检出的假阳性均为0,其特异度均为100.0%,提示DsbC-P367与P367两种融合肽均可作为诊断抗原用于血清学抗体诊断。采用商品化试剂盒检测对样本血清进行复检,结果检出阳性92份,假阳性7份,所得数据分析见表2。结果表明,HCV DsbC-P367抗原融合肽在血清学检测中灵敏度和特异度均优于商品试剂盒,而P367抗原融合肽的检测效果于目前市场上检测试剂盒检出率和灵敏度大致相当。

表2 DsbC-P367、P367特异度、灵敏度与符合率比较
3 讨 论
目前直接抗病毒(DAAs)治疗方法对抗HCV感染非常有效,精确诊断和实验室快速鉴别是实现世界卫生组织2030年消除病毒性肝炎目标的关键。HCV-RNA检测作为HCV感染临床诊断的金标准已得到了广泛地认可,但由于其价格昂贵,检测时间较长,且不适用于HCV感染的初筛实验,血清学检测任然具有广泛的应用价值[9]。由于HCV是一种高度异质性的RNA病毒,不同地区不同基因型的HCV毒株,在核苷酸序列和氨基酸序列上都有很大的不同,从而会影响到相应蛋白的性质和功能。我国HCV主要流行亚型为1b、2a和6a[10]。需要综合考虑三种主要流行亚型的优势抗原表位去提高抗体检测的敏感性,目前常用的抗体检测试剂都使用3~6种重组抗原或合成肽,缺点是增加了非特异性而出现较多假阳性,这就需要通过多表位HCV诊断抗原的筛选加上除去非保守氨基酸序列来完成。
HCV核心多肽(C)抗原性较强,在HCV感染早期即可产生抗核心抗体[11]在各种基因型HCV中最为保守,其核心区的优势表位主要集中在氨基端[12],选择1b型N端1~60位氨基酸,基本包含了核心蛋白大部分疏水区和几乎所有的重要表位;HCV感染者体内抗-NS3出现较早并且持续时间长,NS3蛋白具有强抗原性,在能产生较高滴度的特异性抗体[13],选择1b型NS3蛋白的1 201~1 301位氨基酸;早期研究发现,1型的NS4抗原对于2、3型抗-HCV抗体检测缺乏敏感性[14],在选择抗原时加入了2a型的NS4A、NS4B;NS5a区的高免疫原区位于氨基酸残基2182~2343的位置(162aa)[2],通过在线Blast剔除非保守序列后选择2 272~2 331表位氨基酸抗原。为了提高抗体检测的灵敏度,在抗原选择时,通过软件结合多种筛选算法,筛选出5组优势抗原短肽,放置在合成序列的C端,极大提高了检测的灵敏度。实验室前期试验也已经验证,在重组抗原中含有这5种优势短肽时,检测的灵敏度从86.0%提高到92.0%。
在原核重组时,蛋白质折叠是生物功能和重组蛋白生产的核心,空间结构正确的形成是重组蛋白生物活性的保证,DsbC蛋白作为二硫键异构酶,在原核重组的过程中扮演重要角色,不仅可以促进二硫键正确的配对,还可以让错误折叠的蛋白重新异构化形成正确的空间构象[15]。PALENZUELA等[16]推论NS3蛋白所表现出的高免疫原性很可能是由构象型表位引起。为了促使NS3区构象型空间表位的形成和保持,在融合表达HCV抗原时,融合肽大都选择GST或者Trx蛋白[7,17],它们在提高抗原可溶性上可能起到一些作用,但相对于目的蛋白生物活性的提高和保持,明显DsbC蛋白作用更为优势。其不仅提高了目的蛋白P367的表达量和可溶性,同时,DsbC-P367的检测灵敏度从融合前的90.0%提高到96.0%。
研究已证实,单一结构抗原在血清学抗体诊断上明显灵敏度不足,检测抗原来源于同一基因型的片段也会制约到其他基因型及不同序列HCV感染患者血清标本的检测;不同基因型、同一基因型的不同基因亚型,甚至不同分离株之间由于基因序列的差异都存在有不同的免疫反应性,本课题通过信息学预测与筛选获得的多个优势抗原表位区域结合优势抗原表位短肽,弥补了目前存在的灵敏度不高的问题,在特异度上相对于现有的试剂盒也明显改善了很多,对100份阴性血清检测,特异度达到100.0%。利用DsbC蛋白的伴侣分子功能,使得检测的灵敏度从90.0%提高到96.0%,并且纯化简单,重复好,优于商品试剂盒。

