羌活油抑制沙门菌滑动运动及对感染小鼠的保护作用
姜 鲲,刘 爽,李江波,朱先鹏,于清平,邓旭明,吕强华*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林金梓源生物科技有限公司,吉林 四平 136400;3.吉林省辽源市西安区农林水利工程总站,吉林 辽源 136200;4.吉林省柳河县农业综合行政执法大队,吉林 通化 135300;5.吉林省通化县农业综合行政执法大队,吉林 通化 134100)
沙门菌(Salmonella)一直是欧盟第二大常见的人畜共患病病原菌,作为一种兼性厌氧革兰阴性菌,它在自然界分布广泛,大多数来源于动物性食品[1]。目前,沙门菌主要分为邦戈沙门菌(S.bongori)和肠道沙门菌(S.enterica)2个种属,肠道亚种(enterica)、萨拉姆亚种(salamae)、亚利桑那亚种(arizonae)、双亚利桑那亚种(diarizonae)、豪顿亚种(houtenae)和印度亚种(indica)等6个亚种,血清型共计超过2 600种[2]。沙门菌感染畜禽后可导致胃肠炎、伤寒、副伤寒和系统性感染等,严重危害畜禽养殖业的发展[3]。沙门菌感染人类主要以急性肠胃炎为主,伴有发热、发冷、恶心、头痛、全身乏力、呕吐和腹泻等症状[4]。据报道,法国每年发生的食源性感染病例约50%来源于沙门菌;美国非伤寒沙门菌每年可导致约120万人患病,2万人住院治疗和约450人死亡[5]。2013―2017年,欧洲国家因食用受污染的蛋制品和禽肉而引发的肠炎沙门菌病例不断增加,给畜牧养殖产业带来了巨大的经济损失,严重威胁公共卫生健康和食品安全[6]。
如何有效地防制沙门菌污染和感染成为当前需要迫切解决的问题。尽管抗生素、噬菌体和疫苗等手段可在一定程度上控制沙门菌感染,但多药耐药和泛耐药菌株的不断出现,导致常规防控手段陷入困境。研究表明,沙门菌在鞭毛介导下能够在宿主肠道上皮细胞表面进行滑动运动,黏附定植,最终入侵宿主细胞完成复制和增殖[7]。滑动运动是沙门菌建立感染的前提条件,介导其运动性的关键基因或蛋白缺失后,其致病性显著减弱或丧失[8-9]。相比常规抗菌药物直接杀伤或杀灭病原菌的作用机理,通过抑制或减弱沙门菌的致病性进行的药物筛选和研发也是一种理想的抗耐药感染新策略。
羌活是一种伞形科羌活属多年生草本植物,其根和茎可入药,常用于外感风寒和风湿疼痛等病症。羌活油是羌活中的有效成分之一,具有抗炎、镇痛、解热、抑菌和抗过敏等广泛的药理活性[10-12]。在本研究中,发现羌活油显著抑制沙门菌在半固体培养基上的滑动运动,通过抗菌活性测定、细胞毒性试验(LDH检测)和细胞黏附试验等研究羌活油对沙门菌体外致病性的抑制作用,并评价羌活油对沙门菌感染小鼠的保护作用,旨在为羌活油防治沙门菌感染提供科学依据,以期为抗沙门菌感染提供候选药物。
1 材料与方法
1.1 菌株、细胞与试剂鼠伤寒沙门菌SL1344(链霉素抗性)由北京大学刘小云研究员馈赠;人宫颈癌细胞HeLa购自北京协和细胞中心;羌活油(有效成分含量≥75%)购自江西吉安中香天然植物有限公司;LB培养基和琼脂粉购自青岛海博生物技术有限公司;乳酸脱氢酶(LDH)检测试剂盒购自Roche公司;ELISA检测试剂盒购自Biolegend公司;二甲基亚砜(DMSO)、胎牛血清和DMEM细胞培养基购自Thermo Fisher公司;链霉素购自北京索莱宝科技有限公司;TritonX-100购自Sigma-Aldrich公司。
1.2 试验动物6~8周龄SPF雌性BALB/c小鼠购自辽宁长生生物技术服份有限公司。
1.3 主要仪器生物安全柜(HDL),购自哈东联有限公司;恒温振荡器(THZ-82),购自上海跃进医疗器械厂;电子天平(BSA124S/224S-CW),购自德国赛多利斯;组织研磨仪,购自上海净信生物科技有限公司;酶标仪,购自奥地利TECAN公司。
1.4 羌活油对鼠伤寒沙门菌SL1344滑动运动的影响挑沙门菌(SL1344)单菌落至LB培养基过夜培养(37℃、180 r/min),次日,将收集菌液离心(8 000 r/min)弃上清,用PBS重悬制备菌悬液。取3 μL制备好的菌悬液滴在含不同质量浓度(0.000,0.016,0.032,0.064 g/L)羌活油的0.3%琼脂半固体LB平板中心,37℃水平静置培养12 h,测量沙门菌滑动运动直径拍照并记录。
1.5 羌活油的体外抗菌活性测定
1.5.1最小抑菌浓度(MIC)测定 根据CLSI(Clinical And Laboratory Standards Institute)公布的标准方法M7-A8,测定羌活油对沙门菌SL1344的MIC[13]。将过夜培养的沙门菌稀释至5×105CFU/mL,加入不同质量终浓度的羌活油(0.000,0.004,0.008,0.016,0.032,0.064,0.128,0.256,0.512,1.024 g/L),每孔体系为100 μL。另设LB培养基阴性对照组和未加羌活油的细菌培养物阳性对照组,37℃静置培养24 h,以无细菌生长的最低药物浓度作为MIC。
1.5.2羌活油对沙门菌生长曲线的测定 将过夜培养的沙门菌SL1344按1∶100扩培至100 mL新鲜LB培养基继续培养至600 nm波长吸光度(D600 nm)≈0.3。将菌液等量分装至5只三角锥形瓶中,同时加入不同体积的羌活油(质量浓度分别为0.000,0.016,0.032,0.064,0.128 g/L),置于37℃、200 r/min摇床中继续培养,间隔1 h测定菌液的D600 nm值直至平台期,绘制细菌的生长曲线。
1.6 羌活油对鼠伤寒沙门菌SL1344黏附和内化至HeLa细胞的影响
1.6.1HeLa细胞的培养 将液氮中冻存的HeLa细胞放置于37℃水浴锅中,使之快速融化复苏。1 000 r/min离心5 min后弃去上清,使用含有10%胎牛血清和1×双抗(青霉素/链霉素)溶液的DMEM高糖完全培养基轻柔重悬,将悬液加入细胞培养瓶中,向瓶中补充4 mL完全培养基并混合均匀,置于37℃恒温细胞培养箱,5%CO2条件下培养。待瓶底细胞融合至70%~80%时,继续传代培养。
1.6.2羌活油对HeLa细胞毒性测定 按照2.0×104/孔密度接种HeLa细胞至96孔板过夜培养。次日,分别设不同质量浓度(0.000,0.004,0.008,0.016,0.032,0.064,0.128 g/L)羌活油组、阴性对照组(DMEM处理)和阳性对照组(含0.1% TritonX-100培养基),每组2个重复,1 000 r/min离心10 min,置于37℃温箱培养8 h。1 000 r/min离心10 min取细胞培养上清置于新96孔板,按照乳酸脱氢酶(LDH)试剂盒说明测定492 nm处吸光度。按照如下公式计算各组LDH释放率:LDH释放率=(不同浓度羌活油处理组-阴性对照组)/(阳性对照组-阴性对照组)×100%。
1.6.3羌活油对沙门菌黏附至HeLa细胞的影响 按照3.0×104/孔将HeLa细胞接种于24孔板过夜培养。沙门菌SL1344按1∶100扩大培养,加入不同质量浓度(0.000,0.016,0.032,0.064 g/L)羌活油,置于37℃、200 r/min水平摇床继续培养至对数生长中期(D600 nm=1.0)。1 000 r/min离心10 min收集菌体,PBS清洗3次,制备菌悬液。按照感染复数(细菌∶细胞=100∶1)感染HeLa细胞,1 000 r/min离心5 min,37℃孵育20 min。PBS清洗3次,洗去未黏附细菌,加入0.1% Triton X-100裂解细胞。取细胞裂解液倍比稀释涂布于含链霉素抗性LB平板,37℃过夜培养计数菌落数,计算黏附率。
1.7 羌活油对沙门菌感染小鼠的治疗作用
1.7.1致死剂量感染小鼠存活率测定 将50只BALB/c小鼠随机分为5组,每组10只。感染模型组和不同质量浓度羌活油组沙门菌SL1344攻菌剂量为5×107CFUs/只,体积为100 μL。攻菌后,间隔12 h灌胃不同剂量羌活油和等体积DMSO,间隔12 h统计各组小鼠存活情况,绘制存活率曲线,试验动物分组及处理方法见表1。

表1 致死剂量感染小鼠分组及处理方法
1.7.2亚致死剂量感染小鼠保护作用 将30只BALB/c小鼠随机分为3组,每组10只。感染模型组和100 mg/kg体质量羌活油组灌胃攻菌,剂量为1×107CFUs/只,体积为100 μL。攻菌后,间隔12 h 口服灌胃100 mg/kg体质量的羌活油和等体积DMSO,攻菌后96 h颈椎脱臼处死各组小鼠,观察盲肠组织病理损伤程度、靶器官菌落定植数和盲肠炎性细胞因子释放情况,试验动物分组及处理方法见表2。

表2 亚致死剂量感染小鼠分组及处理方法
1.7.3盲肠组织病理学观察 攻菌后96 h剖检各组小鼠,无菌摘除盲肠肉眼观察病变情况,并且制备HE染色组织切片,镜检观察盲肠组织的病理学变化。
1.7.4靶器官菌落定植数检测 攻菌后96 h剖检各组小鼠,无菌摘除肝脏和脾脏,称质量后制备含0.2% TritonX-100的PBS组织研磨液,倍比稀释涂布于含链霉素抗性LB固体平板,37℃过夜培养计数菌落数,计算肝脏和脾脏的菌落定植数。
1.7.5盲肠炎性细胞因子水平检测 取上述盲肠组织研磨液6 000 r/min离心5 min取上清液,根据ELISA试剂盒使用说明测定盲肠炎性细胞因子(IL-1β和TNF-α)的含量。

2 结果
2.1 羌活油抑制沙门菌的滑动运动通过测定沙门菌在半固体琼脂培养基上的滑动运动,发现相比于无羌活油处理组,质量浓度为0.032 g/L羌活油组沙门菌的滑动运动程度显著降低(图1A);测量不同处理组滑动运动的直径,发现质量浓度为0.032 g/L的羌活油组沙门菌滑动运动率显著低于无羌活油处理组,降低至20%(图1B)。结果表明,羌活油显著抑制鼠沙门菌的滑动运动。

图1 羌活油抑制沙门菌在半固体培养基上的滑动运动
2.2 羌活油对沙门菌无体外抗菌活性不同质量浓度羌活油组沙门菌SL1344的生长曲线与无羌活油组相似,说明在0~0.128 g/L质量浓度范围内,羌活油对沙门菌的生长无显著性影响(图2);同时,羌活油对沙门菌SL1344的MIC值大于0.256 g/L,表明羌活油在有效质量浓度范围内对沙门菌无抗菌活性。

图2 羌活油对沙门菌生长的影响
2.3 羌活油抑制沙门菌黏附至HeLa细胞且无明显细胞毒性通过乳酸脱氢酶(LDH)释放试验测定羌活油对HeLa细胞的毒性。在一定浓度范围(0.000~0.128 g/L)内,羌活油对HeLa细胞无明显药物毒性(图3A)。接下来,测定羌活油对沙门菌黏附至HeLa细胞的影响。结果显示,羌活油在质量浓度为0.032 g/L时,显著抑制沙门菌SL1344黏附至HeLa细胞,相比于无羌活油组,沙门菌的黏附率下降约40%(图3B)。

图3 羌活油抑制沙门菌黏附至HeLa细胞且无明显细胞毒性
2.4 羌活油对沙门菌感染小鼠的治疗作用
2.4.1存活率 如图4所示,空白对照组试验过程小鼠未发生感染,未发生死亡;感染模型组攻菌144 h后小鼠全部死亡;相比于感染模型组,50 mg/kg体质量的羌活油治疗后感染小鼠存活率为20%;100 mg/kg 和200 mg/kg体质量的羌活油治疗后感染小鼠存活率均为40%。结果表明,羌活油显著降低沙门菌SL1344感染小鼠的病死率,综合考虑各方面因素,故推荐100 mg/kg体质量为最佳剂量。
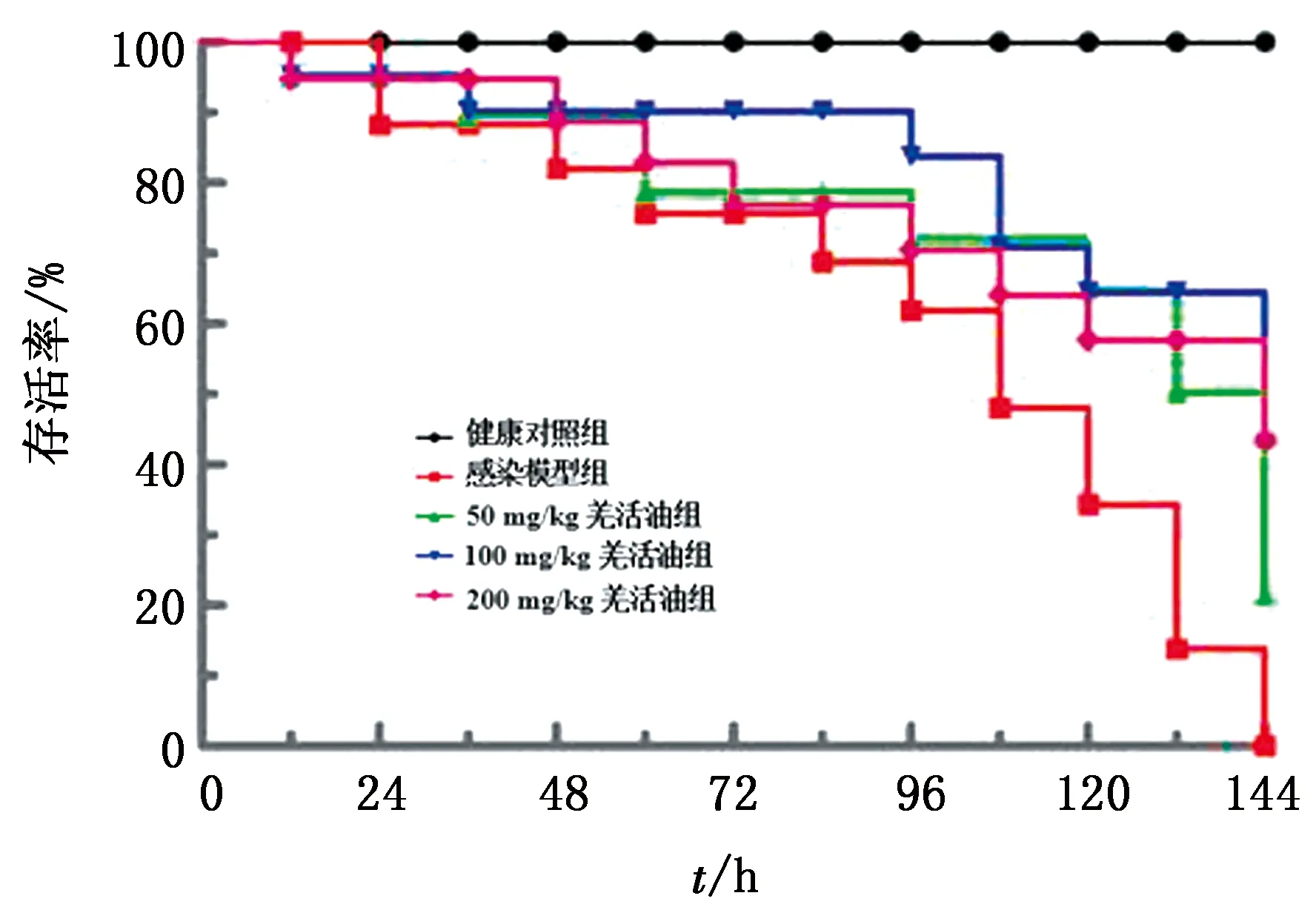
图4 羌活油对沙门菌感染小鼠存活率
2.4.2羌活油缓解沙门菌感染小鼠盲肠病理损伤 如图5A所示,感染模型组小鼠盲肠盲端萎缩和缩短,而100mg/kg体质量羌活油组盲肠肉眼仅见轻微损伤,与健康对照组小鼠盲肠形态相似。同眼观病变一致,镜检发现感染模型组小鼠盲肠上皮变性、坏死和脱落,细胞层溃疡严重并伴随出血,肠绒毛大量崩解脱落,杯状细胞数量显著减少,黏膜肌层水肿并伴随炎性细胞浸润;100 mg/kg体质量羌活油组小鼠盲肠绒毛断裂,少量肠上皮细胞变性、坏死和脱落,并伴随少量出血,少量的炎性细胞浸润;健康对照组肠黏膜上皮相对较完整,无明显病变(图5B)。

A.眼观病变;B.镜检病理变化
2.4.3羌活油缓解沙门菌感染小鼠盲肠组织炎性反应 如图6所示,100 mg/kg体质量羌活油组小鼠盲肠炎性细胞因子(IL-1β和TNF-α)的含量显著低于感染模型组,表明100 mg/kg体质量羌活油能够有效缓解沙门菌感染小鼠盲肠的炎症反应。

图6 羌活油降低沙门菌感染小鼠盲肠炎性细胞因子含量
2.4.4羌活油降低沙门菌感染小鼠靶器官(肝脏和脾脏)菌落定植数 100 mg/kg体质量羌活油组感染小鼠靶器官(肝脏和脾脏)菌落定植数均极显著低于感染模型组(图7)。

图7 羌活油降低靶器官(肝脏和脾脏)菌落定植数
3 讨论
沙门菌的持续存活和广泛传播,引发人类和动物的各种疾病,严重威胁公共卫生和畜禽养殖,造成巨大的经济负担。沙门菌通过利用鞭毛、菌毛、黏附素、生物膜、耐酸耐热性及Ⅲ型分泌系统等不同毒力因子在人和动物消化道及不同食品基质中存活繁殖并广泛传播[14]。随着全球经济的迅速发展和生活条件的不断改善,食源性疾病对全球的影响持续存在,人们越来越重视食品安全,控制沙门菌在食品中的污染仍是今后发展的重要方向[15]。为了从根本上解决沙门菌引起的不同类型的人和动物的疾病,降低食源性疾病发生风险,充分了解沙门菌的致病机理是至关重要的。虽然物理、化学及生物防控措施在防控沙门菌感染方面取得了较大的成功,但耐酸型、耐热型及耐药型沙门菌菌株的大量出现,仍是食品工业所面临的严峻挑战[4]。通过靶向细菌感染致病过程非生命必需成分,以非抑菌或杀菌方式研制新型抗菌药物,给予细菌较小的生存压力可以有效应对目前各种防控策略的弊端。
在本研究中,通过滑动运动、抗菌活性测试、细胞毒性试验、细胞黏附试验和沙门菌感染小鼠治疗试验,研究羌活油对沙门菌体内外致病性的影响。本试验结果表明,羌活油在质量浓度为0.032 g/L时,显著抑制沙门菌的滑动运动能力,显著降低沙门菌黏附至HeLa细胞,且在有效浓度范围内不影响细菌的生长和无明显细胞毒性;体内保护作用研究发现,100 mg/kg体质量的羌活油显著提高沙门菌感染小鼠的存活率,缓解感染小鼠盲肠组织病理损伤,降低感染小鼠靶器官(肝脏和脾脏)菌落定植数和盲肠组织炎性细胞因子(IL-1β和TNF-α)水平。综上所述,羌活油是一种治疗沙门菌感染的有效药物,该研究将会为其临床应用提供科学依据和理论基础。

