混合真菌发酵制备支化β-1,3-葡寡糖
杨泽林,杨雪晨,吴剑荣,夏小乐,张洪涛,詹晓北
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
真菌葡聚糖是一大类结构复杂多样的D-葡聚糖,由于生物来源不同,在结构和性质上有很大差异。根据葡萄糖苷异头碳结构不同,可分为α-D-葡聚糖、β-D-葡聚糖和复合α,β-D-葡聚糖。此外,真菌葡聚糖在糖苷键类型、分支度、支链结构和分子量上也有很大差别[1],其中,以β-1,3-D-葡聚糖为主链、带有不同程度β-1,6支链的葡聚糖因其较好的生物活性受到广泛关注和研究[2]。此类支化β-1,3-D-葡聚糖具有抗肿瘤、免疫调节、降低“三高”、促进伤口愈合、改善肠道菌群等功能,已广泛应用于食品和医药行业[3-4]。真菌葡聚糖的生物活性通常与其结构和分子量有关,而分支度为0.20~0.33的支化β-1,3-葡聚糖被证明具有最高的抗肿瘤活性,分支度更高或者更低则活性都会下降[5-6]。早期研究认为此类真菌葡聚糖的生物活性和它们的三螺旋结构以及大的分子量有关,然而近年来发现小分子的β-1,3-葡寡糖具有更显著的抗肿瘤活性[7-10]。真菌葡聚糖通常分子量较大,如小核菌多糖能达到1.0×107,这导致其水溶性很差,直接影响了其生物活性和应用领域,因为能溶于水的β-葡聚糖生物活性要远好于不能溶于水的葡聚糖生物活性[11]。
通过水解降低真菌葡聚糖分子量是一种有效提高真菌葡聚糖水溶性和生物活性的方法。目前,常用于水解葡聚糖的方法主要有酶水解[12]、酸水解[13]和物理水解[14]。其中,酸水解和物理水解方法存在低聚糖收率低、聚合度(DP)不可控等问题,因此,酶水解是目前制备β-葡寡糖的最佳方法。哈茨木霉能分泌外切β-1,3-葡聚糖酶和内切β-1,3-葡聚糖酶,其内切β-1,3-葡聚糖酶能够沿着多糖链随机切割β-1,3-糖苷键产生寡糖,具有良好的应用价值[12]。笔者所在课题组前期将产热凝胶的土壤杆菌和哈茨木霉混合培养,成功制得了DP 20左右、分子量均一的线性β-1,3-葡寡糖,实验证明其具有良好的水溶性和抗肿瘤活性[15-16]。
本研究以β-1,3-葡聚糖为主链、每3个葡萄糖连接一个β-1,6支链结构的真菌葡聚糖进行水溶性寡糖制备研究,此类真菌葡聚糖来源包括齐整小核菌[17]、裂褶菌[18]和绣球菌[19]等。其中,齐整小核菌所产的小核菌多糖相对产量较高,产量最高可达32.62 g/L[17]。另外,裂褶菌具有药用价值,且比绣球菌更易培养。因此,通过构建齐整小核菌-哈茨木霉以及裂褶菌-哈茨木霉混合培养体系,可直接发酵法制备支化β-1,3-葡寡糖(bOβG),以期为降解真菌多糖提供一种新的方法,并且拓展真菌深层发酵的研究思路。
1 材料与方法
1.1 材料
1.1.1 菌种
齐整小核菌(Sclerotiumrolfsii) WSH-G01,保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2017646;裂褶菌(SchizophyllumcommuneGDMCC 5.43)、哈茨木霉(TrichodermaharzianumGDMCC 3.442),广东省微生物菌种保藏中心。
1.1.2 培养基
齐整小核菌平板培养基(g/L):马铃薯(去皮)200.0、葡萄糖20.0、琼脂20.0;pH自然。种子培养基(g/L):葡萄糖30.0、NaNO33.0、酵母浸粉1.0、KH2PO41.0、MgSO4·7H2O 0.5、KCl 0.5;pH 4.0。发酵培养基(g/L):葡萄糖55.0、NaNO32.5、酵母浸粉0.5、KH2PO41.0、MgSO4·7H2O 0.5、柠檬酸1.5、KCl 0.5;pH 4.0。
哈茨木霉平板培养基(g/L):马铃薯(去皮)200.0、葡萄糖20.0、KH2PO43.0、MgSO4·7H2O 1.5、硫胺素0.008、琼脂20.0;pH 6.0。种子培养基(g/L):葡萄糖20.0、酵母浸粉15.0、(NH4)2SO42.5、KH2PO46.0、MgSO4·7H2O 0.8;pH 6.0。发酵培养基(g/L):茯苓多糖20.0、小麦麸皮20.0、KH2PO45.0、MgSO4·7H2O 0.5;pH 6.0。
共培养上罐培养基(g/L):葡萄糖75.0、NaNO33.0、酵母浸粉1.0、KH2PO41.0、MgSO4·7H2O 0.5、柠檬酸1.5、KCl 0.5;pH 4.5。
1.1.3 仪器与设备
7 L BioFlo115型发酵罐,Eppendorf公司;3K-15型高速冷冻离心机,Sigma-Aldrich公司;SBA-40E型生物传感分析仪,山东省科学院生物研究所;LC 2000型高效液相色谱仪(HPLC),日本岛津公司;基质辅助激光解析电离串联飞行时间质谱仪(MALDI-TOF MS),布鲁克·道尔顿公司;DIONEX ICS-5000+SP-5型离子色谱仪,赛默飞世尔科技公司。
1.1.4 试剂与材料
食品级热凝胶,日本Takeda-Kirin Food Co.公司;硅胶薄层层析板gel 60 F254,德国Merck公司;Sep-Pak C18固相萃取柱(1 g),美国Waters公司;截留分子量500~1 000透析袋,北京索莱宝科技有限公司;其余试剂均为市售分析纯。
1.2 方法
1.2.1 培养方法
摇瓶水平。齐整小核菌于平板培养基上活化,25 ℃培养4 d;从活化好的平板上挑取菌丝接种于种子培养基(装液量50 mL的500 mL三角瓶)中,于30 ℃、220 r/min培养3 d;将种子液均质后以7%(体积分数)接种量接种于发酵培养基(装液量45 mL的250 mL三角瓶)中,于30 ℃、220 r/min培养48 h。哈茨木霉于平板培养基上活化,30 ℃培养3 d;将活化好的平板用生理盐水冲洗打散,制成1×107CFU/mL的孢子悬浮液;接1 mL孢子悬浮液于种子培养基(装液量50 mL的500 mL三角瓶)中,30 ℃、200 r/min培养18 h;以10%接种量将种子液接种于发酵培养基(装液量50 mL的500 mL三角瓶)中,于30 ℃、200 r/min培养18 h。将培养18 h的哈茨木霉发酵液6 010g离心5 min,以齐整小核菌和哈茨木霉发酵液体积比0.9∶1将离心沉淀加入到培养48 h的齐整小核菌发酵液中,并且以20 g/L的质量浓度补加小麦麸皮,30 ℃、220 r/min继续培养直到发酵结束。
7 L发酵罐水平。齐整小核菌和哈茨木霉的平板活化和种子培养方法同摇瓶水平。发酵罐初始装液量3.5 L,搅拌转速400 r/min,温度恒定30 ℃,通气量1 vvm,以5%的接种量接入齐整小核菌种子液。在溶氧为90%时接种培养18 h、孢子浓度为1×108CFU/mL的哈茨木霉种子液,初始接种比为V(齐整小核菌)∶V(哈茨木霉)=1∶1.5,并补加20 g/L的小麦麸皮,同时通过协同调节通气量和转速控制溶氧(DO)保持在50%以上,直至发酵结束。
参照文献[20]进行齐整小核菌菌体干质量及多糖产量的测定。
1.2.3 支化β-1,3-葡寡糖产量测定
将共培养发酵液于9 391g离心10 min,取上清液。上清液中总糖含量采用苯酚-硫酸法[21]测定,残糖含量使用生物传感分析仪测定。支化β-1,3-葡寡糖产量为总糖含量减去残糖含量。
1.2.4 内切β-1,3-葡聚糖酶酶活测定
本研究中,内切β-1,3-葡聚糖酶的单位酶活(U)定义:每1 min水解热凝胶生成1 μg寡糖所需的酶量。具体测定方法参照文献[22]。
1.2.5 支化β-1,3-葡寡糖的提取纯化
取一定体积共培养的发酵上清液,加入10倍体积无水乙醇并于4 ℃醇沉过夜,于6 010g离心10 min获得沉淀,N2吹干沉淀并复溶,溶液过0.22 μm水系膜备用。使用Sep-Pak C18固相萃取柱除去溶液中的蛋白,方法如下:首先使用10 mL乙腈对小柱进行活化,再用20 mL水进行平衡,随后上样1 mL,待样品滴完,最后用10 mL水洗脱,收集洗脱液。上述洗脱液通过旋转蒸发浓缩到一定体积,使用截留分子量500~1 000透析袋透析2 d,除去离子和单糖。最后冻干,得到支化β-1,3-葡寡糖样品。
1.2.6 热凝胶寡糖的制备
沈老七新居落成后,又娶了一房太太。这时的沈家已是大不如从前了。该烧的都已经烧了,眼下沈老七只有田产还可以变成现钱,他为娶这房太太又变卖了50亩上好的河沙地。
热凝胶寡糖是以食品级热凝胶为原料,通过酸水解制得,具体操作方法参照文献[23]。
1.2.7 支化β-1,3-葡寡糖的结构分析
共培养发酵上清液利用高效液相色谱(HPLC)进行分析。具体条件:仪器岛津LC 2000,柱子Superose 12 10/300 GL,流动相0.1 mol NaNO3溶液,流速0.5 mL/min,柱温25 ℃,进样量20 μL。
采用MALDI-TOF MS测定支化β-1,3-葡寡糖的分子量。使用FlexControl和FlexAnalysis 3.4.软件进行数据采集和处理。
参照文献[24]进行支化β-1,3-葡寡糖单糖组成分析。称取5 mg寡糖样品,加入300 μL 2 mol/L的三氟乙酸,100 ℃金属浴6 h,冷却后N2吹干,加入300 μL甲醇再吹干,重复3次,最后溶于水并稀释至10 mg/L。配制10 mg/L的单糖混标溶液,包括岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和果糖。样品过0.22 μm水系膜,使用离子色谱仪进行分析。
DPPH自由基清除率、羟自由基清除率、超氧阴离子自由基清除率的测定方法参照文献[25],还原力测定方法参照文献[26]。
2 结果与讨论
2.1 混合发酵法制备支化β-1,3-葡寡糖
前期实验中对齐整小核菌的生长以及产糖情况进行了研究,结果如图1所示。由图1可知:齐整小核菌菌丝体在0~72 h期间迅速生长,处于对数期,之后进入迟缓期。齐整小核菌菌体干质量在120 h时最高,为2.62 g/L。而小核菌多糖在24 h以后开始大量产生,在96 h时达到最高,为22.6 g/L。以此为基础,进行齐整小核菌-哈茨木霉混合发酵的研究。

图1 齐整小核菌生长曲线Fig.1 Time course of Sclerotium rolfsii
哈茨木霉作为一种生物防治真菌,能够拮抗齐整小核菌这种植物病原真菌,基于此,这2种真菌的共培养只能在一段时间内存在,只有让2株菌在一段时间内都能够得到较好的生长,才能获得较高的寡糖产量。因此,找到2株菌在混菌时合适的生物量至关重要。哈茨木霉相比齐整小核菌生长较快,且能够达到更大的生物量,因此,在齐整小核菌发酵一段时间后,再接种培养18 h的哈茨木霉,并补料小麦麸皮,继续进行混合发酵,发酵结果如图2所示。因为当齐整小核菌单菌培养时,从24 h开始大量产生多糖,此时也达到了一定的生物量,因此从24 h开始接种哈茨木霉进行混合发酵,结果如图2(a)所示。由图2(a)可知:支化β-1,3-葡寡糖的产量先上升后下降,在发酵48 h时接种哈茨木霉,寡糖产量最高,为3.0 g/L。如果哈茨木霉接种过早,抑制了齐整小核菌的生长,没有产生足够的多糖用来被水解生成寡糖,造成寡糖产量不高;而哈茨木霉接种过迟时,齐整小核菌生物量已经较大,且此时产生了大量多糖,发酵体系黏度大造成供氧不足,影响了哈茨木霉的生长,使得哈茨木霉不能产生足够的内切β-1,3-葡聚糖酶来水解多糖,导致寡糖产量很低。因此,选择发酵48 h为哈茨木霉最佳混菌接种时间。

图2 齐整小核菌-哈茨木霉混合发酵制备寡糖的工艺优化Fig.2 Fermentative production of glucan oligosaccharides by co-cultivation with Sclerotium rolfsii and Trichoderma harzianum
另外,在混菌培养时,哈茨木霉的接种量同样也会影响寡糖的产量,因此可通过调整哈茨木霉种子液接种孢子的浓度来控制混菌时哈茨木霉的生物量。实验所制得的哈茨木霉孢子悬浮液原液的浓度约为1×108CFU/mL,而文献[16]中所使用的最低孢子悬浮液浓度为2.5×106CFU/mL,因此对接种孢子悬浮液浓度进行优化实验,结果如图2(b)所示。由图2(b)可知:支化β-1,3-葡寡糖的产量在接种孢子浓度为1×107CFU/mL时达到最高,为4.0 g/L。同时,随着哈茨木霉接种量的提高,内切β-1,3-葡聚糖酶酶活也随之升高。除了内切β-1,3-葡聚糖酶外,哈茨木霉还会产生外切β-1,3-葡聚糖酶,当2种酶酶活过高时,会导致寡糖被继续水解,从而造成产量的下降,而当酶活较低时,寡糖产量也会比较低。因此,选择最佳哈茨木霉接种孢子浓度为1×107CFU/mL。
培养基的pH会影响齐整小核菌的生长和多糖产量,也会影响哈茨木霉的生长和产酶情况。小核菌多糖在pH较低的情况下产量较高,单菌发酵优化的结果是初始pH 4.0时多糖产量最高;而对于哈茨木霉单菌,初始pH 6.0时内切β-1,3-葡聚糖酶产量达到最高。培养基初始pH优化结果如图2(c)所示。由2(c)可知:支化β-1,3-葡寡糖在pH为4.5时最高,为4.07 g/L;而内切β-1,3-葡聚糖酶酶活在pH 5.5时最高,此时寡糖产量较低的原因可能是哈茨木霉生长情况较好,产生的外切酶及内切酶过量,水解了生成的寡糖,导致寡糖产量的下降。因此选择pH4.5为混菌发酵最佳初始pH。
齐整小核菌单菌发酵时间一般为5 d,在研究过程中发现,小核菌多糖产量在4 d时达到最高,而哈茨木霉的发酵时间通常是3~6 d。因此,混合培养时,在齐整小核菌发酵2 d时加入培养18 h的哈茨木霉菌液,结果如图2(d)所示。由图2(d)可知:两菌混合培养后,发酵液的内切β-1,3-葡聚糖酶酶活随着发酵时间的延长而升高,但在4 d时支化β-1,3-葡寡糖产量达到最高,为4.5 g/L。而发酵液中残糖在4 d时就已处在很低的水平,在5 d时则基本耗尽,这为寡糖产量在4 d后开始下降提供了合理的解释。所以,4 d后齐整小核菌可能就不再产生多糖,或者由于拮抗作用,齐整小核菌菌体被哈茨木霉水解消亡,而哈茨木霉产生的酶继续水解寡糖,造成产量下降。因此,在摇瓶中混合发酵时间为4 d时寡糖有最高产量。
2.2 7 L发酵罐水平制备支化β-1,3-葡寡糖
齐整小核菌在7 L发酵罐中的生长曲线如图3所示。由图3(a)可知:菌体干质量在120 h时为8.27 g/L,相比摇瓶水平提高了215%;多糖产量在72 h时最高,为26.31 g/L,相比摇瓶水平提高了16.4%。从16 h到32 h,溶氧(DO)从99.7%迅速下降到27.1%,此后继续降低并一直维持在较低的水平,这可能是菌体进入对数生长期,且大分子量的多糖大量产生,使发酵液黏度迅速升高,造成了溶氧水平的下降。因此,这段时间对于混菌发酵成功与否至关重要。
由于实验条件所限无法完成哈茨木霉单独发酵、再离心混菌的操作,因此选择直接加入摇瓶培养的哈茨木霉种子液进行混合发酵。因为哈茨木霉少了单独培养这一过程,在混菌中的生物量处于劣势,因此与摇瓶培养相比,接种的时间要提前,才能实现共培养的成功,结果如图3(b)所示。由图3(b)可知:在溶氧为90%即齐整小核菌发酵19 h时接种哈茨木霉,获得了较高产量的支化β-1,3-葡寡糖。其中,寡糖的产量先上升后下降,在39 h达到最高,为9.94 g/L,相比摇瓶水平提高了119%。后期寡糖含量开始下降,这可能是因为大量产生的内切酶和外切酶造成产物水解,寡糖产量下降。因此,必须控制好混菌接种的时机,使多糖与内切酶同时产生,从而获得更高的寡糖产量。另外,我们发现直接加入哈茨木霉种子液的方法可以成功制得支化β-1,3-葡寡糖的窗口期很窄,因此在放大实验中,如设备条件允许,还是应该将哈茨木霉单独发酵,再接入齐整小核菌发酵液中进行共培养,这样两株菌能在较长时间内共存,有利于获得更高的产量。
2.3 寡糖的结构表征
将齐整小核菌与哈茨木霉混合发酵制得的支化β-1,3-葡寡糖命名为小核寡糖(Sr.bOβG),将裂褶菌与哈茨木霉通过同样混合发酵方法获得的支化β-1,3-葡寡糖命名为裂褶寡糖(Sc.bOβG)。采用Superose 12凝胶柱对2种发酵上清液进行分析,HPLC结果如图4(a)所示。由图4(a)可知:齐整小核菌、裂褶菌与哈茨木霉共培养得到的发酵上清液中只含有小分子量的寡糖(保留时间为34.646 min),不含大分子量的多糖(保留时间40.147 min为溶剂峰)。单糖组成的结果如图4(b)所示。由图4(b)可知:小核寡糖和裂褶寡糖均只含有葡萄糖。因为高效液相色谱的结果只能得到一个粗略的分子量范围,并不能准确得出所产支化β-1,3-葡寡糖的具体聚合度,所以,将上述样品再进行MALDI-TOF MS分析,结果如图5所示。通过计算,小核寡糖的聚合度(DP)为5~12,裂褶寡糖的DP为5~15。由此可知,混合发酵所产支化β-1,3-葡寡糖的分子量分布范围较小。另外,将摇瓶和发酵罐培养不同时间的样品都进行了MALDI-TOF MS分析,得出的结果都是一致的,因此这种混合培养的方法能得到固定分子量范围的支化β-1,3-葡寡糖。

图4 小核寡糖和裂褶寡糖HPLC谱图及单糖组成分析Fig.4 HPLC profile and monosaccharide composition analysis of Sr.bOβG and Sc.bOβG
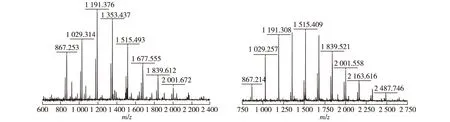
图5 小核寡糖和裂褶寡糖MALDI-TOF MS分析结果Fig.5 MALDI-TOF MS analysis of Sr.bOβG and Sc.bOβG
2.4 寡糖体外抗氧化活性研究
天然多糖具有良好的抗氧化活性[7-10],因此本研究进一步测试不同支链和线性葡寡糖的抗氧化活性,结果如图6所示。由图6(a)可知:当寡糖质量浓度为10 mg/mL时,裂褶寡糖对DPPH自由基的清除率为95.53%,小核寡糖的清除率为50.55%,热凝胶寡糖的清除率为0.64%。因此,与热凝胶寡糖相比,2种支链寡糖清除DPPH自由基活性明显提高,其中裂褶寡糖又好于小核寡糖,虽都低于维生素C(Vc),但仍证明2种支链寡糖有较好的抗氧化活性。另外,羟自由基在生物体内很容易与许多大分子进行反应,如氨基酸、蛋白质和DNA等,从而对生命体造成损伤[26]。因此,对羟自由基的清除能力是天然产物抗氧化活性评价的重要组成部分。
β-1,3-葡寡糖的羟自由基清除效果如图6(b)所示。由图6(b)可知:当质量浓度为10 mg/mL时,裂褶寡糖对羟自由基的清除率为99.2%,小核寡糖的清除率为97.31%,两者基本接近Vc的水平。另外,热凝胶寡糖也有一定的效果,但相比之下效果较差。同时,从随浓度变化的趋势来看,清除羟自由基的活性从大到小为Vc、裂褶寡糖、小核寡糖、热凝胶寡糖。因此,2种支链β-1,3-寡糖有比较好的抗氧化活性。
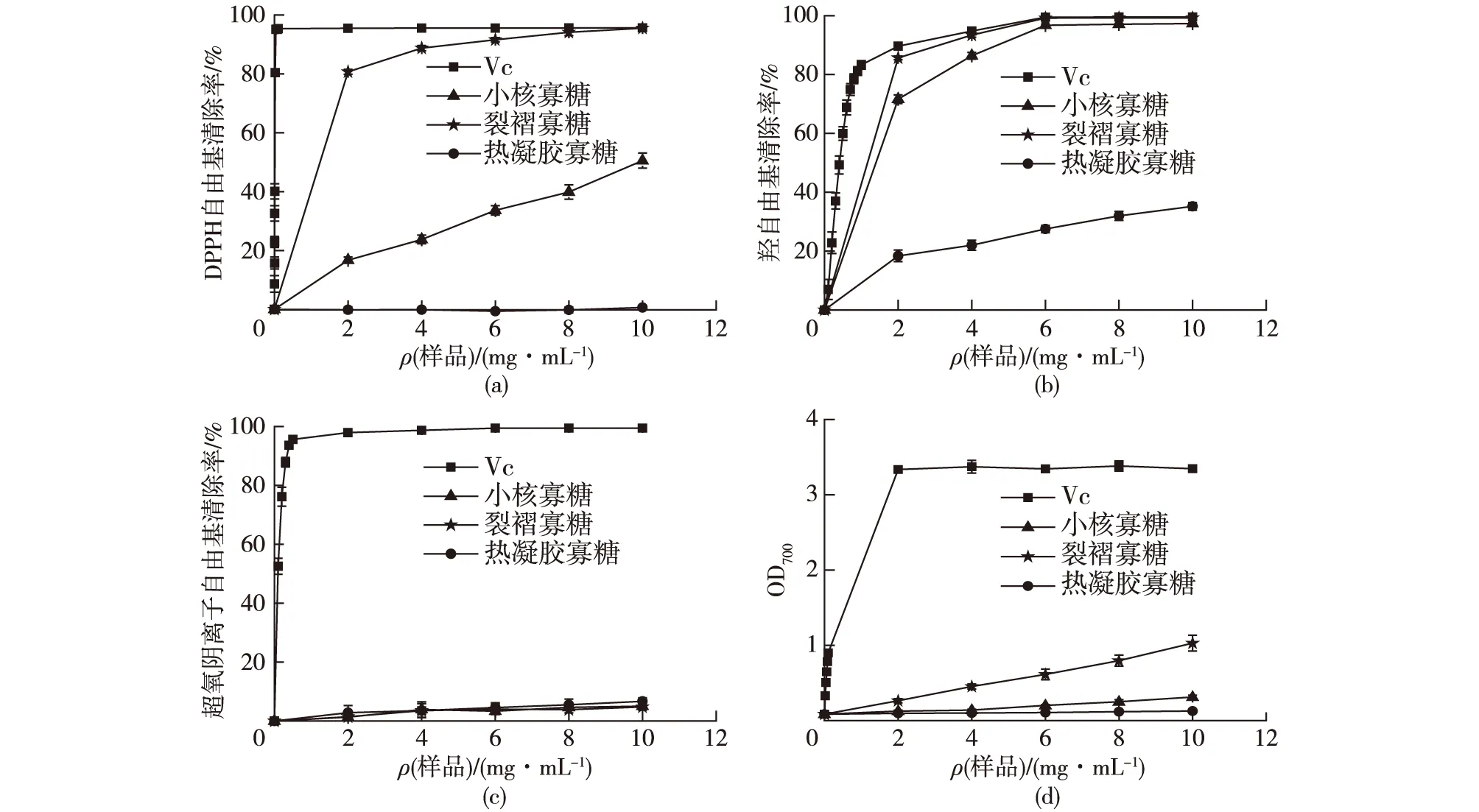
图6 寡糖抗氧化活性分析Fig.6 Antioxidant activity analyses of oligosaccharides
与其他自由基相比,超氧阴离子自由基具有更低的反应活性和更长的存在时间,使得可以参与进一步的反应,并导致更多活性氧的生成,从而损伤机体[26]。β-1,3-葡寡糖对超氧阴离子自由基的清除效果如图6(c)所示。由图6(c)可知:3种β-1,3-葡寡糖均未表现出清除超氧阴离子自由基的活性。因此,该类结构的β-1,3-葡寡糖以及连接β-1,6支链的葡寡糖均不具有清除超氧阴离子自由基的能力。另外,对β-1,3-葡寡糖的还原力进行测定,结果如图6(d)所示。由图6(d)可知:当β-1,3-葡寡糖质量浓度为10 mg/mL时,裂褶寡糖的OD700为1.029,小核寡糖的OD700为0.312,热凝胶寡糖的OD700为0.126。因此,裂褶寡糖还原力大于小核寡糖,而热凝胶寡糖还原力较差。
综合以上4种抗氧化活性的评价方法,验证了支化的小核寡糖和裂褶寡糖具有较好的抗氧化活性,其中裂褶寡糖优于小核寡糖,而采用化学法制备的线性热凝胶寡糖效果很差,也证明支链寡糖比热凝胶寡糖有更好的活性,更具有研究价值。此外,同时采用大分子量的小核多糖和裂褶多糖在相同浓度下进行了4种抗氧化活性研究,均无效果,进一步证明该种结构的寡糖相比多糖具有更好的活性。
微生物之间的相互作用关系非常复杂,利用好这些相互作用关系能够提高目标产物的产量,或者产生新的物质。本实验室近年来一直研究通过建立混合培养体系,利用内切β-1,3-葡聚糖酶水解β-1,3-葡聚糖以制得β-1,3-葡寡糖。前期我们将土壤杆菌与哈茨木霉混合培养,成功制得DP为19~25的β-1,3-葡寡糖,产量最高达到17.31 g/L,并证明具有一定的抗肿瘤活性[16]。另外,李菲菲等[27]进一步建立土壤杆菌与毕赤酵母混合培养体系,也成功制得β-1,3-葡寡糖,DP为17~22,最高产量为4.3 g/L。该类大分子量葡聚糖水溶性差,直接酶解效率低下,且聚合度分布范围较广。在混合培养体系中,葡聚糖和水解酶同时生成,边产糖边酶解,因此具有成本低廉、操作简单、水解效率高、产物聚合度均一的优点。
3 结论
本研究成功构建了齐整小核菌-哈茨木霉和裂褶菌-哈茨木霉混合发酵体系以制备支化β-1,3-葡寡糖,分别命名为小核寡糖和裂褶寡糖,其DP分别为5~12和5~15。2种寡糖具有良好水溶性,结构表征证明2种寡糖均由葡萄糖构成。抗氧化活性测定表明,相比多糖与直链β-1,3-葡寡糖,支链β-1,3-葡寡糖具有更好的抗氧化活性,其中裂褶寡糖抗氧化活性优于小核寡糖。本文建立的新的混合培养体系为制备支化β-1,3-葡寡糖提供了新的方案,也为混合发酵法拓展了新的领域。后续实验还需对寡糖的抗肿瘤活性等进行研究,以拓展支化β-1,3-葡寡糖的应用领域。

