经皮内镜椎板间入路椎间盘切除术治疗重度脱垂型腰椎间盘突出症
徐 凯,杨 斐,祁建华,吴昊阳,陈日高
腰椎间盘突出症(LDH)是较常见的腰椎疾病,相当一部分患者存在椎间盘不同程度的脱垂[1-2]。重度脱垂型(脱垂椎间盘延伸超过上椎弓根下缘3 mm或超过下椎弓根中心[3-4])LDH患者常伴严重的腰痛和坐骨神经痛,可导致皮肤感觉改变和运动无力,采用非手术治疗效果不佳,需手术干预。显微镜下腰椎间盘切除术被认为是治疗LDH的标准术式[5],但用于治疗重度椎间盘脱垂时,必须切除额外的椎板或关节突关节,所以术后易出现医源性腰椎不稳,导致手术失败[6]。随着器械的改进和微创外科技术的发展,经皮内镜椎板间入路椎间盘切除术(PEID)因具有创伤小、恢复快、对椎旁肌及正常骨质结构破坏少的优势逐步用于治疗重度脱垂型LDH[7-8]。其操作原理类似于传统的开放式椎间盘切除术,可通过有限的椎板切除扩大手术范围,顺利取出脱垂的髓核组织,从而避免了椎弓根等解剖结构的限制,弥补了经椎间孔入路内镜下腰椎间盘切除术(PETD)治疗重度脱垂型LDH髓核取出不彻底的缺点。本研究回顾性分析2016年12月~2018年11月在我科采用PEID治疗的31例重度脱垂型LDH患者资料,报道如下。
1 材料与方法
1.1 病例资料本组31例,男11例,女20例,年龄29~74(51.32±12.08)岁。体重指数17.60~ 29.70(24.61±2.84) kg/m2。椎间盘脱垂节段:L3~43例,L4~518例,L5~S110例。脱垂类型:向上型10例,向下型21例。病程5~24(14.68±5.56)个月。患者均有长期腰腿痛病史,非手术治疗>4周未见好转。临床表现:间歇性跛行,单次步行距离<250 m,腰痛伴单侧或双侧下肢放射痛,感觉运动功能减退。术前X线片显示腰椎退行性改变,无骨质破坏及腰椎失稳表现;MRI检查显示向上或向下重度脱垂的椎间盘突出导致椎管狭窄,硬膜囊与神经根受压。手术均由同一位具有丰富微创脊柱外科经验的医师主刀完成。
1.2 手术方法全身麻醉。患者俯卧位于弓形架上,保持腰部适当弯曲以扩大椎板间隙。C臂机透视定位椎板间隙水平线,以椎间隙正中线旁开约1 cm处确定为皮肤穿刺点,画线标记后垂直进针。C臂机透视确认穿刺针抵达椎板间隙,经穿刺针插入导丝并小心拔出穿刺针,以穿刺点为中心在棘突旁做长约8 mm的切口,逐级放置一系列扩张器导管并建立工作通道。沿工作通道置入内镜头,并在连续生理盐水冲洗下进行操作。镜下可见椎板上下缘与椎间隙,根据移位椎间盘的位置,用高速磨钻和椎板咬骨钳咬除椎板的头部或尾部,如有必要可切除部分内侧小关节。显露完成后,小心剥离黄韧带可见硬膜囊、神经根,通过调整内镜角度探查神经根肩部及腋下,使受压神经根和脱垂椎间盘完全显露在视野下。使用髓核钳摘除脱垂的髓核组织,若发现椎间隙内仍有游离的松散碎片,则需进一步探查并取出。减压完成后可见硬膜囊搏动良好,使用射频电极对潜在出血点进行止血,再次确认神经根松弛后缓慢退出工作通道。逐层缝合切口,无菌敷料包扎。
1.3 术后处理常规静脉注射非甾体类抗炎药预防感染。术后1 d患者开始在床上行直腿抬高锻炼,并佩带腰围直至术后8周。
1.4 观察指标及疗效评价① 手术时间,住院时间,疼痛VAS评分,ODI评分,术后并发症发生情况。② 采用改良MacNab标准评价临床疗效。

2 结果
患者均获得24个月随访。手术时间62~99(73.39±9.50) min,住院时间2~6(3.71±1.01) d。术后5例出现下肢皮肤痛觉过敏,均口服甲钴胺片4周后症状消失,术后并发症发生率5/31。腰、腿痛VAS评分:见表1。术后3、12、24个月均明显低于术前(P<0.05),术后各时间段比较差异均无统计学意义(P>0.05)。ODI评分:见表1。术后3、12、24个月均明显低于术前(P<0.05),术后12、24个月均明显低于术后3个月(P<0.05),术后24个月与12个月比较差异无统计学意义(P>0.05)。末次随访时采用改良MacNab标准评价临床疗效:优18例,良10例,可3例,优良率28/31。
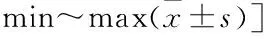
表1 手术前后疼痛VAS评分、ODI评分比较[n=31,分,
典型病例见图1~5。
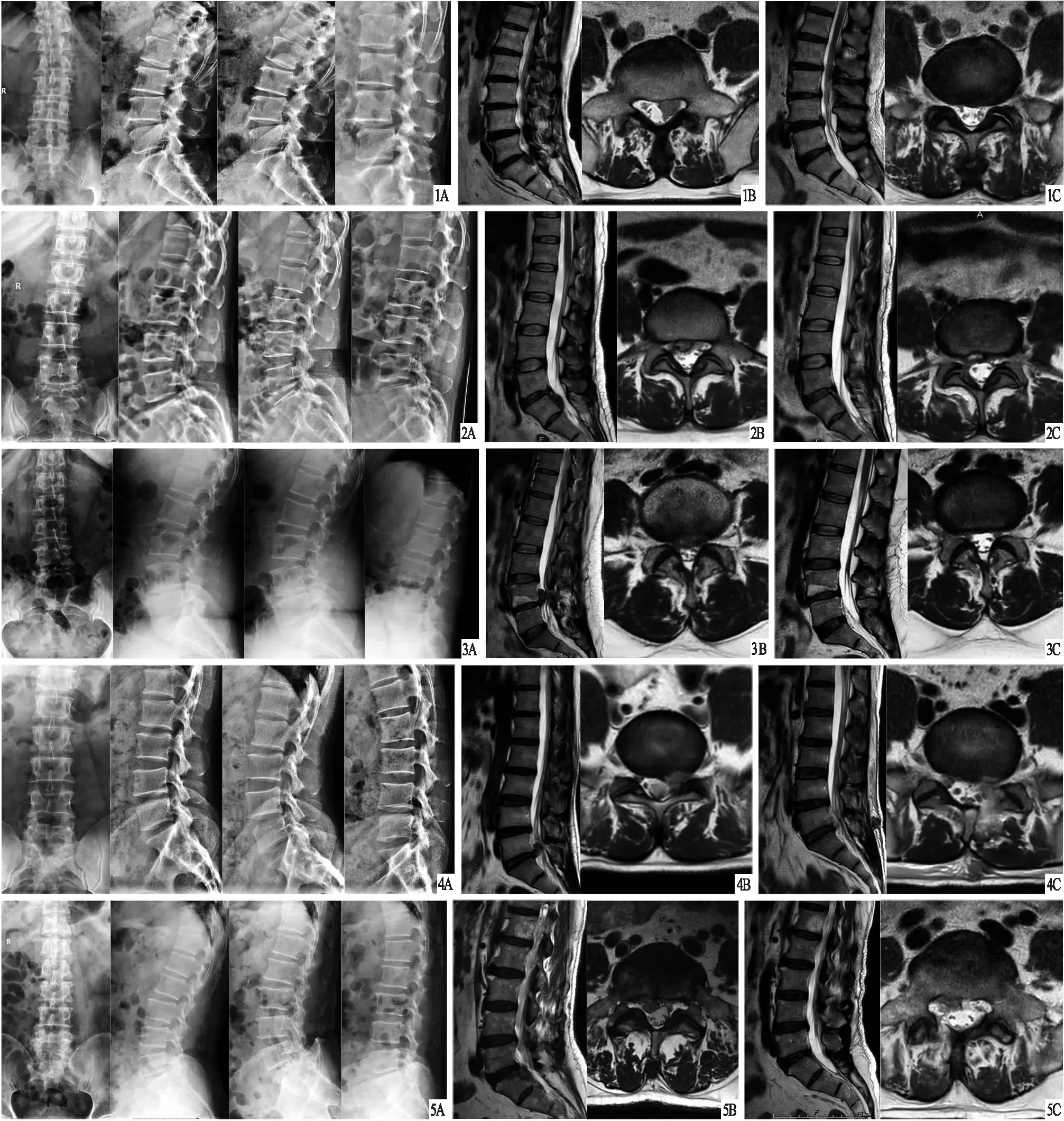
图1 患者,男,56岁,L5~S1节段重度脱垂型LDH,髓核向下游离,左下肢根性症状,采用PEID治疗 A.术前腰椎正位、侧位、过伸位、过屈位X线片,显示无骨质破坏及腰椎失稳表现;B.术前MRI,显示L5~S1节段腰椎间盘重度脱垂;C.术后MRI,显示脱垂髓核被彻底摘除,局部无残留 图2 患者,女,48岁,L5~S1节段重度脱垂型LDH,髓核向下游离,右下肢根性症状,采用PEID治疗 A.术前腰椎正位、侧位、过伸位、过屈位X线片,显示无腰椎失稳表现;B.术前MRI,显示L5~S1节段腰椎间盘重度脱垂;C.术后MRI,显示脱垂髓核被彻底摘除,局部无残留 图3 患者,女,49岁,L4~5节段重度脱垂型LDH,髓核向上游离,双下肢根性症状,采用PEID治疗 A.术前腰椎正位、侧位、过伸位、过屈位X线片,显示无腰椎失稳表现;B.术前MRI,显示L4~5节段腰椎间盘重度脱垂,髓核向上游离;C.术后MRI,显示脱垂髓核被彻底摘除,局部无残留 图4 患者,男,50岁,L5~S1节段重度脱垂型LDH,髓核向上游离,左下肢根性症状,采用PEID治疗 A.术前腰椎正位、侧位、过伸位、过屈位X线片,显示无腰椎失稳表现;B.术前MRI,显示L5~S1节段腰椎间盘重度脱垂,髓核向上游离;C.术后MRI,显示脱垂髓核被彻底摘除,局部无残留 图5 患者,男,52岁,L5~S1节段重度脱垂型LDH,髓核向下游离,右下肢根性症状,采用PEID治疗 A.术前腰椎正位、侧位、过伸位、过屈位X线片,显示无腰椎失稳表现;B.术前MRI,显示L5~S1节段腰椎间盘重度脱垂;C.术后MRI,显示脱垂髓核被彻底摘除,局部无残留
3 讨论
3.1 重度脱垂型LDH的治疗传统开放术式因需要剥离较多的椎旁肌、韧带,切除额外的椎板和关节突关节,可能会加重脊柱节段不稳定性并导致术后腰椎手术失败综合征。一项为期10年的研究[9]发现,在标准开放椎间盘切除术治疗LDH后,临床疗效往往会随着时间的推移而变差。另一项研究[10]也表明,22.2%经显微镜下腰椎间盘切除术治疗的重度脱垂型LDH患者术后患有严重的下腰痛,且随着时间推移手术满意度不断下降。虽然经皮脊柱内镜下腰椎间盘切除术(PELD)在临床上得到广泛运用,但由于腰椎小关节和椎弓根的阻挡,传统的PELD入路很难直接观察到远端脱垂的髓核组织,同时脱垂的髓核经常以碎片的形式出现,故手术疗效的优良率较低[11]。近年来,改良的PELD技术已广泛用于治疗脱垂型LDH并取得了良好的临床疗效[12]。有学者们[13]采用经椎弓根钻孔的方法治疗重度脱垂型LDH;也有学者们[14]通过PETD联合PEID来降低术后髓核残余率。临床上对此尚未达成共识。但总的来说,这些手术均操作复杂、耗时较长,且易受到解剖结构的限制。
3.2 PEID治疗重度脱垂型LDH的优点与注意事项PEID治疗重度脱垂型LDH的优点:① 对椎旁肌损伤较小且不影响脊柱稳定性;② 手术切口小且全程在水介质中进行,与操作显微镜相比,经皮脊柱内镜的可视化程度更高。但需注意以下事项:① 术前必须根据患者影像学资料仔细测量椎板间隙大小,确定椎板成形的范围;② 术中应尽量减少器械对神经根的刺激。本研究中,术后5例出现下肢皮肤痛觉过敏的并发症,服用甲钴胺片4周后症状均消失,考虑与术中神经根被双极射频电极反复刺激及工作通道压迫有关。本研究中,腰、腿痛VAS评分:术后3、12、24个月均明显低于术前(P<0.05),说明术后患者疼痛缓解明显,手术效果较好。ODI评分:术后3、12、24个月均明显低于术前(P<0.05),术后12、24个月均明显低于术后3个月(P<0.05)。考虑这与患者术后均遵医嘱佩带腰围,并在家多休息有关,因此术后12个月以上的生活质量较术后3个月更好。末次随访时采用改良MacNab标准评价临床疗效:优18例,良10例,可3例,优良率28/31。
综上所述,采用PEID治疗重度脱垂型LDH,患者术后腰腿痛缓解明显,未发生严重并发症,临床效果满意。但本研究样本量较小,需更多前瞻性大样本量随机对照研究进一步验证。

