四川小金县野生羊肚菌多糖的结构解析及体外抗肿瘤活性初探
周丽倩,黄 瑶,鲁 艳,叶姿妤,刘欣岚,丁 祥,侯怡铃*
1西华师范大学生命科学学院 西南野生动植物资源保护教育部重点实验室;2西华师范大学环境科学与工程学院,南充 637009

羊肚菌(Morchellaesculenta)也被俗称为“羊肚菜”“羊肚子”等,是低温腐生型蕈菌,属于子囊菌亚门盘菌纲、盘菌目、羊肚菌科、羊肚菌属,是世界上珍贵稀有的食药用大型真菌之一,在我国分布广泛,主要分布在我国云贵川、东三省以及西北部的新疆、西藏等地区[7]。羊肚菌多糖是从羊肚菌子实体、菌丝体或发酵提取液中提取的天然活性产物,是羊肚菌的有效活性成分之一。天然多糖具有抗氧化、抗衰老、抗肿瘤、调节免疫等功能[7]。目前四川小金县的野生羊肚菌多糖的结构及其抗肿瘤活性尚未见报道。本研究通过热水浸提法从四川小金县野生羊肚菌中提取到多糖(Morchellaesculentapolysaccharide,ME-P),利用傅里叶红外光谱、高效液相色谱、气相质谱联用、核磁共振波谱等技术进行ME-P一级结构的解析。同时选取贴壁生长的巨噬细胞(RAW 264.7)检测其药物毒性,并以结肠癌细胞(CT26.WT)和胃癌细胞(MFC)为例对其体外抗肿瘤活性进行研究。拟为四川小金县羊肚菌资源的开发利用提供科学依据。
1 材料与方法
1.1 材料试剂与设备
羊肚菌购自四川省小金县;ME-P经热水浸提及纯化获得[8];巨噬细胞株RAW 264.7、结肠癌细胞CT26.WT、胃癌细胞MFC(上海生物化学与细胞生物学研究所);重水D2O;碘甲烷(批号2020040601,分析纯);六甲基二硅烷胺(批号20111017,分析纯);三甲基氯硅烷(生工科技有限公司,批号2020040801,分析纯);吡啶(上海麦克林生化科技有限公司,货号P816288,分析纯);溴化钾KBr(分析纯);三氟乙酸TFA(世贸化工有限公司,货号LK60S11,色谱级);乙腈(美国Thermo Fisher,色谱级);RPMI1640培养基(Gibco公司,货号11835055);胎牛血清(Gibco公司,货号16140071);CCK-8 A cell counting kit(上海碧云天生物技术研究所,产品编号C0038)。
HWS28 恒温水浴锅(上海一恒科学仪器有限公司);ST40离心机(德国Eppendorf公司);TΜ-1901/1900系列傅里叶红外光谱仪(美国Thermo Fisher公司);1260高效液相仪、7890A GC-MS仪(美国Agilent公司);Bruker DRX-600(300)超导核磁共振仪(德国Bruker公司);Epoch酶标仪(Wultiskam Go,Gene有限公司)。
1.1 傅里叶红外光谱(FT-IR)分析
称取2 mg 冷冻干燥后的ME-P和200 mg KBr于研钵中,研磨充分后用压片机制片,将片置于傅里叶红外光谱仪中,在波数500~4 000 cm-1范围内进行扫描[9]。
1.3 ME-P的高效液相色谱(HPLC)分析
称取20 mg ME-P,加入摩尔浓度为2 mol/L的三氟乙酸(TFA)溶液5 mL,封瓶后水浴(100 ℃)水解6 h,12 000 r/min 离心5 min弃沉淀,将三氟乙酸挥发除尽后干燥得到水解后的多糖。以75%乙腈作为溶剂分别将完全水解后的多糖ME-P和单糖标准品配制成质量浓度为5 μg/mL的待测样品,经HPLC测定后,与单糖标准品的保留时间比对,对ME-P的单糖组分及比例进行判定。
HPLC条件:RID检测器;1.4 mL/min流速;上样体积10 μL;柱温恒定35 ℃;流动相为75%乙腈。
1.4 ME-P的气相质谱联用(GC-MS)分析
对ME-P进行甲基化处理后,用三氟乙酸水解,2 mL的无水嘧啶复溶,加入2 mL六甲基二硅烷胺、1 mL三甲基氯硅烷进行硅烷化衍生,50 ℃水浴20 min后12 000 r/min离心取上清进行气相质谱分析测定[10]。
色谱条件为:Dionex ICS-3000离子色谱仪;电导检测器;30 m×0.25 nm×0.25 μm的石英毛细管柱(DB-5MS);载气为高纯氦;升温程序为初始柱温80 ℃,保持3 min,以10 ℃/min的速率升温至200 ℃,保持10 min;进样口温度250 ℃;进样量10 μL。
1.5 ME-P的核磁共振(NMR)分析
将50 mg ME-P充分溶于600 μL重水(D2O),高速(12 000 r/min)离心10 min,取上清置于干燥核磁管中,以内参四甲基硅烷(TMS)测定得到1H NMR、13C NMR、1H-1H COSY、HMQC谱图,用MestReNova 9.0软件进行分析。
1.6 ME-P的药物毒性检测及对肿瘤细胞的抑制作用
将处于对数生长期、状态良好的细胞(巨噬细胞株RAW 264.7、小鼠结肠癌细胞株CT26.WT、小鼠胃癌细胞株MFC)消化后稀释至密度为1×105个/mL后分别加入96孔板中,每孔100 μL,为避免边缘效应在边缘孔加入200 μL PBS缓冲液。在37 ℃、5% CO2孵箱中恒温培养至细胞已完全贴壁且状态稳定后进行药物毒性检测及抗肿瘤活性检测。
药物毒性检测:按100 μL/孔的加样量依次加入不同质量浓度(1.25、5、10、20 μg/mL)的ME-P溶液作实验组;巨噬细胞阳性对照组加入100 μL质量浓度为10 μg/mL的脂多糖(LPS)溶液、空白对照组(CK)加入等体积的培养基,每组设置三个重复孔。恒温培养24、48 h后,向每孔分别加入5 μL CCK-8试剂,再继续培养3 h检测其在波长450 nm处的吸光度值。
抗肿瘤活性检测:按100 μL/孔的加样量依次加入不同质量浓度(1.25、5、10、20 μg/mL)的ME-P溶液作实验组,肿瘤细胞阳性对照组加入100 μL质量浓度为10 μg/mL的甘露聚糖肽(MAN)溶液,空白对照组(CK)加入等体积的培养基,每组三个重复。肿瘤细胞恒温培养24 h后,加入CCK-8检测其细胞活力。
上述检测结果按下式计算细胞(增殖)抑制率。
式中:p为细胞(增殖)抑制率;A1为空白对照组孔的吸光度值;A2为实验组孔、阳性对照组孔的吸光度值。
数据采用SPSS 16.0软件进行分析处理,对所有数据进行单因素方差分析(ANOVA)统计学分析,数据用平均标准偏差表示,进行Tukey检验和t检验。P<0.05表示具有统计学意义。绘图采用GraphPad Prism 8.0软件。
2 结果与讨论
2.1 红外光谱
ME-P的FTIR(见图1)在4 000~500 cm-1范围内有明显信号峰。在1 250~500 cm-1的指纹峰区域,1 114 cm-1处、1 187 cm-1处的信号峰分别为吡喃糖环上C-O-C和C-OH的伸缩振动峰[11]。在4 000~1 250 cm-1的特征区,指定1 399 cm-1处信号峰为C-H的变角振动峰;1 634 cm-1处的信号峰归属为C=O的非对称伸缩振动峰;3 138 cm-1处的信号峰是糖环上次甲基C-H的伸缩振动峰;3 432 cm-1处信号峰为ME-P的O-H的伸缩振动峰[12]。以上特征吸收峰表明ME-P是含吡喃糖环的多糖。

图1 ME-P的红外光谱Fig.1 Fourier transform infrared spectra of ME-P
2.2 高效液相分析
高效液相色谱结果如图2 所示,单糖标准品(见图2a)的保留时间显示葡萄糖保留时间为14.214 min、半乳糖为16.704 min、甘露糖为18.614 min,ME-P(见图2b)水解单糖的组分保留时间分别为14.194、16.693、18.608 min,与单糖标准品比对后显示ME-P的单糖组分为葡萄糖(Glc)、半乳糖(Gal)、甘露糖(Man)三种,根据各水解单糖的峰面积(见表1)提示Man、Glc、Gal含量比为4∶4∶1。

图2 单糖标准品(a)及ME-P(b)的高效液相色谱图Fig.2 High performance liquid chromatogram of standards(a) and ME-P(b)
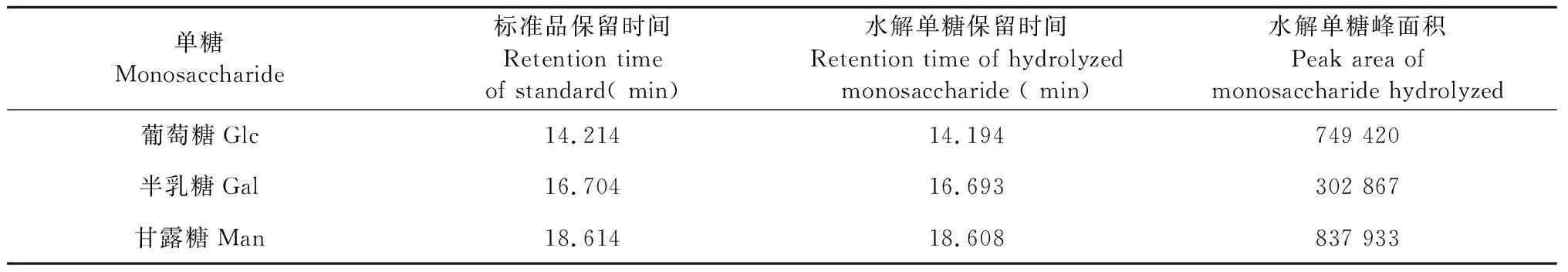
表1 ME-P水解单糖的保留时间Table 1 Retention time of hydrolyzed monosaccharide from ME-P
2.3 气相质谱联用分析
气相质谱联用分析结果显示(见表2、图3),ME-P中有两种类型的甘露糖(Man)残基碎片离子峰,分别为1,2,3,4,6-五-O-三甲基硅基-D-吡喃甘露糖及1-O-甲基-2,3,4,6-四-O-三甲基硅基-D-吡喃甘露糖,提示在ME-P中甘露糖(Man)残基分别以1,2,3,4,6-方式及2,3,4,6-方式连接(见图3a、3b)。在ME-P中葡萄糖(Glc)的碎片离子峰有2,3,4-三-O-甲基-1,6-二-O-三甲基硅基-D-吡喃葡萄糖和1,2,3,6-四-O-甲基-4-O-三甲基硅基-D-吡喃葡萄糖两种,提示葡萄糖(Glc)在羊肚菌多糖中分别以1,6-方式和4-方式连接(见图3c、3d)。而半乳糖(Gal)残基在ME-P中则只存在1种,碎片离子峰为3,4-二-O-甲基-1,2,6-三-O-三甲基硅基-D-吡喃半乳糖(见图3e),提示半乳糖(Gal)以1,2,6-方式连接。
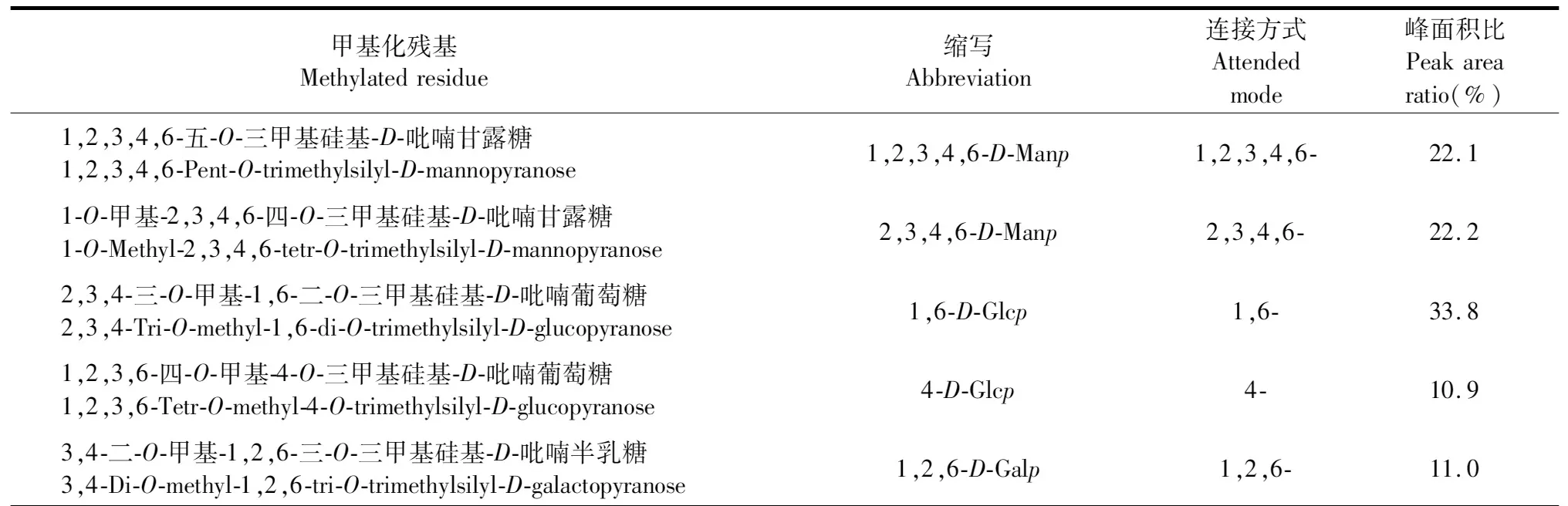
表2 ME-P中单糖残基的连接位点Table 2 Linkage sites of monosaccharides in ME-P

图3 ME-P气质联用碎片离子峰Fig.3 Fragment ion peak of ME-P by GC-MS
综上,ME-P由1,2,3,4,6-D-Manp、2,3,4,6-D-Manp、1,6-D-Glcp、4-D-Glcp、1,2,6-D-Galp残基组成,各单糖残基的含量显示甘露糖为44.3%,葡萄糖44.7%,半乳糖11.0%,其Man∶Glc∶Gal摩尔比为4∶4∶1。其中,葡萄糖的2种残基1,6-D-Glcp、4-D-Glcp的含量分别为33.8%和10.9%,摩尔比为3∶1。
2.4 核磁共振分析
ME-P的1H NMR谱如图4所示,异头质子区δ4.5~5.5范围内有9个共振信号峰,化学位移分别为δ5.22、5.19、5.11、5.06、5.03、5.01、4.98、4.90、4.85。各异头质子信号峰的积分比为1.13∶1.76∶1.25∶1.16∶1.57∶1.74∶1.00∶0.31∶0.47。位于δ3.00~4.50区域内的信号峰为ME-P单糖糖环上C2~C6的氢原子信号重叠。
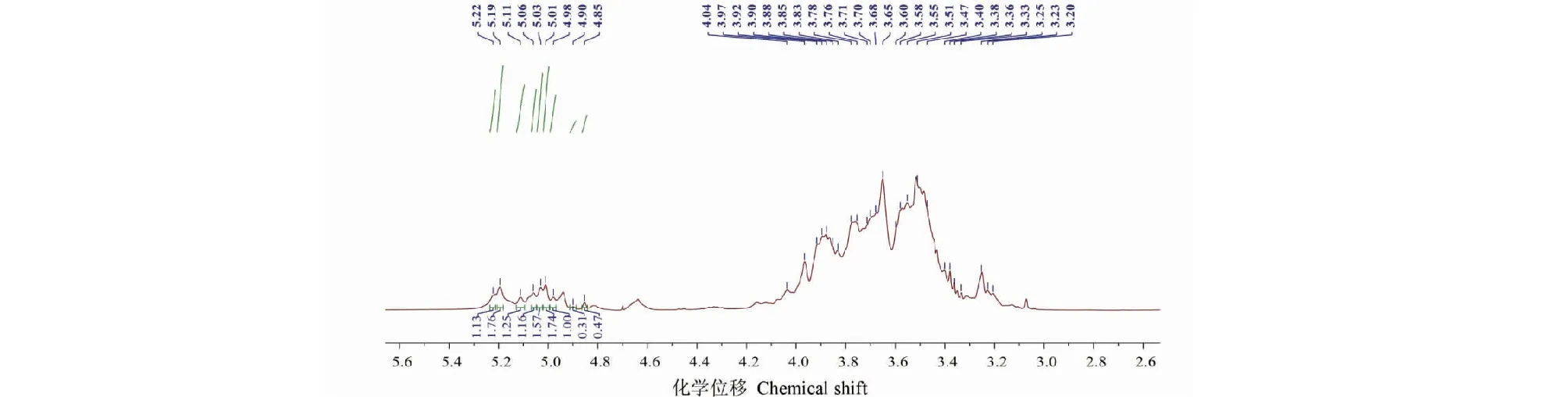
图4 羊肚菌多糖(ME-P)的1H NMR图谱Fig.4 The 1H NMR spectrum of ME-P
ME-P的13C NMR谱(见图5)可以看出在δ90~110共振区域有9个异头碳的共振峰,化学位移分别为:δ109.2、108.1、104.8、104.2、102.2、100.6、99.4、98.2、97.8。δ60~81共振区域为多糖残基C2~C6信号位移的重叠。在δ82~88区域内无吸收信号,表明ME-P均由吡喃糖构成[13]。在范围为δ67~70有信号,提示ME-P中存在(1→6)糖苷键,而δ80~83的信号则表明ME-P中存在(1→3/4)糖苷键[14]。
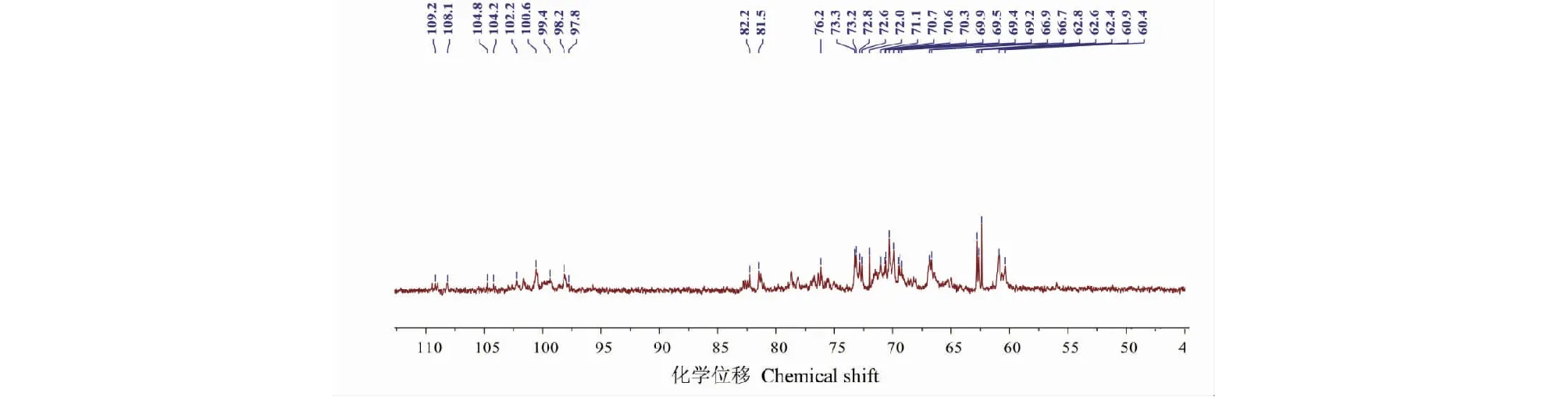
图5 ME-P 的13 C NMR图谱Fig.5 The 13C NMR spectrum of ME-P
1H-1H COSY谱反映氢原子之间的位移关系,根据ME-P的1H-1H COSY谱(见图6)可解析所有单糖残基氢的化学位移。A~I峰为异头氢与相邻碳上的氢之间的化学信号,以A峰(δ5.22/δ3.42)为例:其异头氢化学位移为δ5.22,对应的邻位氢化学位移为δ3.42,则位于δ5.22/δ3.42的信号峰归属为1,6-D-Glcp残基H1与H2的共振耦合信号,并依次将B峰(δ5.19/δ3.97)、C峰(δ5.11/δ3.91)、D峰(δ5.06/δ3.83)、E峰(δ5.03/δ3.93)、F峰(δ5.01/δ4.01)、G峰(δ4.98/δ3.77)、H峰(δ4.90/δ3.88)、I峰(δ4.85/δ3.65)分别归属于1,6-D-Glcp、1,6-D-Glcp、2,3,4,6-D-Manp、2,3,4,6-D-Manp、1,2,3,4,6-D-Manp、1,2,6-D-Galp、4-D-Glcp、1,2,3,4,6-D-Manp残基上H1与H2的共振耦合信号。综上,每个单糖残基上H1~H6的信号位移归属见表3。根据氢谱中积分曲线结果显示,羊肚菌中各单糖残基摩尔比为Man∶Glc∶Gal为4∶4∶1,该结果与高效液相结果一致。

图6 ME-P的1H-1H COSY图谱Fig.6 1H-1H COSY spectrum of ME-P

表3 ME-P 的H原子的化学位移Table 3 Chemical shift of H atom of ME-P
HMQC能反映直接相连的碳氢关系,根据异头氢与异头碳的共振耦合信号,可以将其进行归属,例如A峰H1/C1(δ5.22/δ108.1)即归属为1,6-D-Glcp的H1与C1的共振耦合信号,并依次指定B峰H1/C1(δ5.19/δ99.4)、C峰H1/C1(δ5.11/δ100.6)、D峰H1/C1(δ5.06/δ109.2)、E峰H1/C1(δ5.03/δ104.8)、F峰H1/C1(δ5.01/δ104.2)、G峰H1/C1(δ4.98/δ98.2)、H峰H1/C1(δ4.90/δ102.2)、I峰H1/C1(δ4.85/δ97.8)分别为1,6-D-Glcp、1,6-D-Glcp、2,3,4,6-D-Manp、2,3,4,6-D-Manp、1,2,3,4,6-D-Manp、1,2,6-D-Galp、4-D-Glcp、1,2,3,4,6-D-Manp的H1与C1的耦合信号,分别与1H-1H COSY谱中A~I峰相对应(见图7)。根据各单糖残基质子信号的位移依次归属C2~C6信号位移,结果见表4。
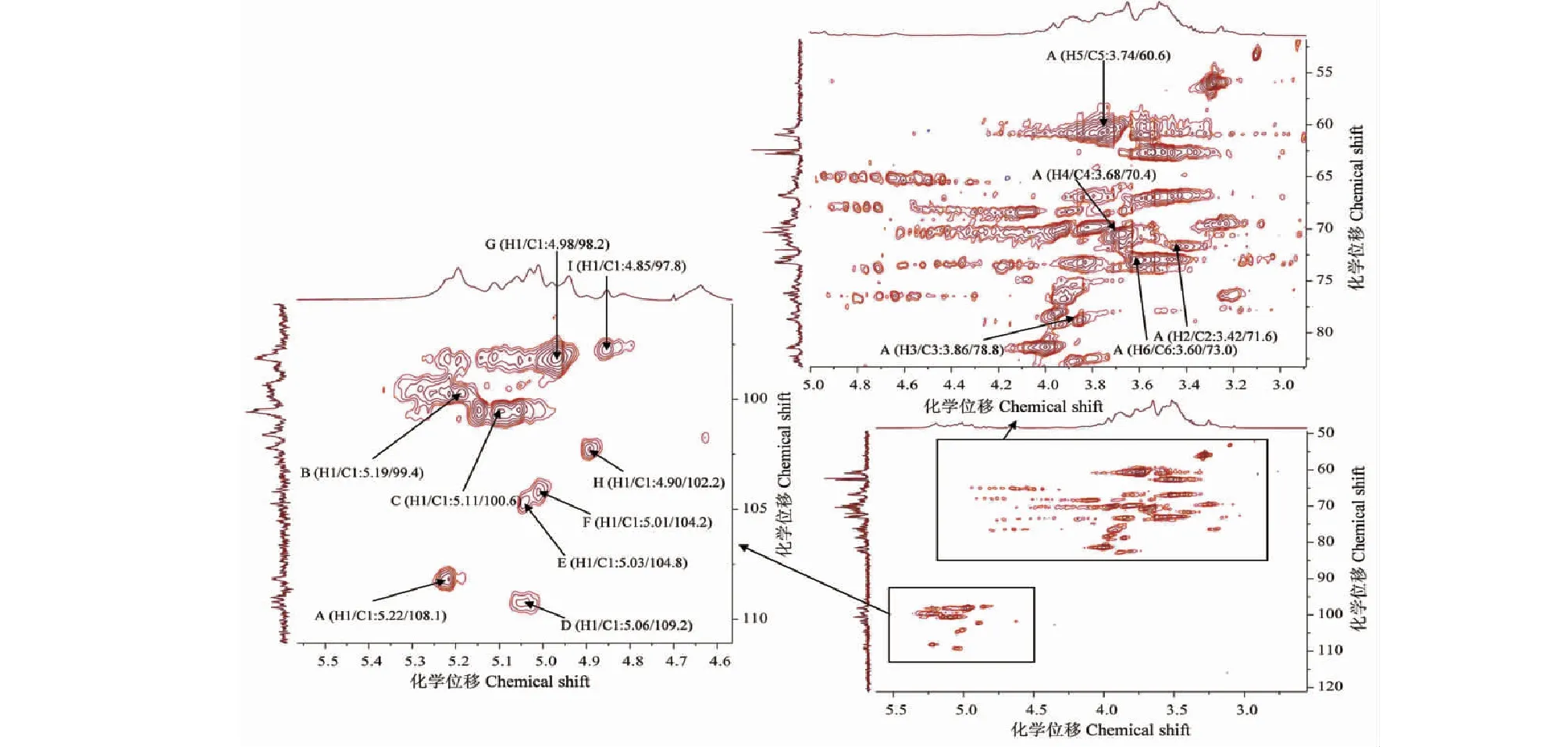
图7 ME-P的HMQC图谱Fig.7 HMQC spectrum of polysaccharide ME-P

表4 ME-P 的C原子的化学位移Table 4 Chemical shift of C atom of ME-P
综合以上HPLC、FT-IR、GC-MS和NMR的结果显示,ME-P由甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)组成,比例为4∶4∶1;其一级结构是以1,2,3,4,6-D-Manp与2,3,4,6-D-Manp交替连接为骨架,1,6-D-Glcp、1,2,6-D-Galp作为支链,4-D-Glcp与1,2,6-D-Galp连接作为末端糖的重复单位,经Scifinder查新结果显示,ME-P为一种结构新颖的多糖(见图8)。

图8 ME-P的一级结构Fig.8 Primary structure of ME-P注:a、e为1,2,3,4,6-D-吡喃甘露糖;b、f为2,3,4,6-D-吡喃甘露糖;c、d、g为1,6-D-吡喃葡萄糖;i为4-D-吡喃葡萄糖;h为1,2,6-D-吡喃半乳糖。Note: a,e are 2,3,4,6-D-mannopyranose;b,f are 2,3,4,6-D-mannopyranose;c,d,g are 1,6-D-glucopyranose;i is 4-D-glucopyranose;h is 1,2,6-D-galactopyranose.
2.5 ME-P的药物毒性检测
与空白对照组相比,ME-P刺激巨噬细胞24 h后显示极显著(P<0.01)促进细胞增殖的作用,在1.25 μg/mL浓度的细胞活力最佳,增殖率可高达79.5%。在ME-P刺激巨噬细胞48 h的结果中,药物组均能极显著(P<0.01)提高细胞增殖活力,在浓度为10 μg/mL,增殖率可达53%(见图9)。以上结果表明ME-P对正常免疫细胞无药物毒性,且有显著的增殖作用。

图9 不同浓度ME-P处理RAW 264.7细胞24 h(左)、48 h(右)后的增殖率Fig.9 Proliferation rate of RAW 264.7 cells treated with different concentrations of ME-P for 24 h (left) and 48 h (right)注:CK为空白对照组,LPS(脂多糖)为阳性对照组。与空白对照组比较,*P<0.05,**P<0.01。Note: CK is blank control group,and LPS (Lipopolysaccharide) is positive control group.Compared with blank control group,*P<0.05,**P<0.01.
2.6 ME-P对肿瘤细胞的抑制作用
2.6.1 ME-P对小鼠结肠癌细胞CT26.WT的抑制作用
ME-P对CT26.WT细胞增殖的抑制实验结果如图10所示。与空白组相比,在1.25~20 μg/mL浓度范围内,ME-P对CT26.WT细胞的增殖有抑制作用,其中,在ME-P质量浓度为1.25 μg/mL时,有显著(P<0.05)抑制作用,且抑制率最高,为28.20%。

图10 不同浓度ME-P处理CT26.WT细胞后的抑制率Fig.10 Inhibition rate of CT26.WT cells treated with different concentrations of ME-P注:CK为空白对照组;MAN(甘露聚糖肽)为阳性对照组。与空白对照组比较,*P<0.05,**P<0.01。Note: CK is blank control group,and MAN (mannan peptide) is positive control group.Compared with blank control group,*P<0.05,**P<0.01.
Yang等[15]研究表明裂褶菌多糖对结肠癌细胞增殖有抑制作用,抑制率可高达45.32%;Guo等[16]发现灵芝多糖对结肠癌细胞也有显著抑制作用,且呈剂量依赖关系,浓度为10 mg/mL时抑制率可达99.43%。我们的结果显示,低浓度的羊肚菌多糖对体外培养的CT26.WT细胞增殖显著抑制作用。
2.6.2 ME-P对小鼠胃癌细胞MFC的抑制作用
ME-P对MFC细胞的处理结果如图11所示。ME-P处理组抑制率在浓度范围内,随着浓度升高,多糖的抑制作用减弱。在ME-P质量浓度为1.25 μg/mL和5 μg/mL时,其抑制效果均为极显著(P<0.01),而当ME-P的质量浓度为1.25 μg/mL时,抑制效果最佳,抑制率为34.23%。Lv等[17]发现黄精多糖能够显著抑制MFC细胞,且对TLR4/NF-κB信号通路有显著影响。我们的结果表明低浓度的羊肚菌多糖对MFC细胞有极显著抑制作用。

图11 不同浓度ME-P处理MFC细胞后的抑制率Fig.11 Inhibition rate of MFC cells treated with different concentrations of ME-P注:CK为空白对照组,MAN(甘露聚糖肽)为阳性对照组。与空白对照组比较,*P<0.05,**P<0.01。Note: CK is blank control group,and MAN (mannan peptide) is positive control group.Compared with blank control group,*P<0.05,**P<0.01.
值得注意的是,在本实验中,ME-P的抑瘤率并不呈浓度依赖性增长,He等[18]发现铁皮石斛圆球茎多糖对小鼠肝癌细胞H22的抑瘤率随着多糖浓度升高而降低。Gan等[19]则发现枸杞多糖对S180肿瘤的抑瘤效果低浓度(5 mg/kg)多糖抑瘤率高于高浓度(20 mg/kg)枸杞多糖。同时,多糖抗肿瘤机制不同,显示出不同的剂量依赖关系。如Guo等[20]发现仿刺参多糖对HepG-2细胞直接杀伤作用,抑制率呈剂量依赖型,对Hca-F肝癌细胞的抑制则是通过调节免疫系统,抑制率并不呈剂量依赖性。本实验中羊肚菌多糖(ME-P)的抗肿瘤细胞结果显示低浓度效果优于高浓度,其相关机制还有待于进一步研究。
3 讨论与结论
羊肚菌作为名贵野生食药用真菌,其多糖的生物活性及其分子机制成为研究热点。研究发现,不同羊肚菌所含多糖的组分比例有差异。He等[21]通过酶辅助法提取的梯棱羊肚菌多糖由葡萄糖、甘露糖和半乳糖三种单糖组成,摩尔比为0.64∶0.55∶0.27,Xiong等[22]从六妹羊肚菌提取的多糖MSP由甘露糖,葡萄糖及半乳糖组成,各占比约为9∶1∶6。Peng等[23]提取到的梯棱羊肚菌多糖由木糖、葡萄糖、半乳糖以及少量的岩藻糖组成,比例为9.21∶8.59∶3.73∶1.00。以上研究表明羊肚菌多糖中甘露糖与葡萄糖含量较高,半乳糖含量较少,同时有少量岩藻糖、木糖。而本实验中采用热水浸提法从四川小金县羊肚菌中提取的ME-P,经HPLC、FT-IR、GC-MS和NMR测定后显示ME-P由甘露糖、葡萄糖、半乳糖组成,各自比例约为4∶4∶1,单糖均为吡喃构型,且单糖含量符合以往研究规律。
不同结构的多糖显示出不同的体外抗肿瘤活性,在单糖组分中含有甘露糖和葡萄糖的多糖一般具有抗癌活性[13],同时以β-(1→3),α-(1→4)连接的葡聚糖主链,侧链以β-(1→6)作为分支点的多糖则抗肿瘤活性强[1]。Zhu等[24]从橙盖鹅膏分离出一种是以α-(1→4)-D-葡萄糖和α-(1→3)-D-葡萄糖为骨架,α-(1→3)-D-葡萄糖6-C上连接一个→1)-α-D-来苏糖为侧链的多糖(AC-1),并发现AC-1对MFC细胞有抑制作用,当AC-1浓度为20 μg /mL时抑制率高达30.09%。Liu等[25]从羊肚菌中提取的多糖MEPN-B-II鼠李糖、木糖、甘露糖、葡萄糖、半乳糖组成,摩尔比10.6∶13.1∶3.2∶29.8∶43.3;形成重复单元以→1)-α-D-Galp-(4→和→1)-β-D-Glcp-(4→连接构成主链,→1)-α-D-Manp-(2→为分支连接→1)-α-D-Glcp-(4→为非还原性末端的多糖结构,该多糖能够体外抑制结肠癌细胞(HT-29)且抑制率可高达87%,最适浓度为1 000 μg/mL。实验结果显示,ME-P是具有以1,2,3,4,6-D-甘露糖、2,3,4,6-D-甘露糖交替连接为骨架,1,6-D-葡萄糖、1,2,6-D-半乳糖作为支链,4-D-葡萄糖与1,2,6-D-半乳糖连接作为末端糖的重复单位的多糖,在ME-P为1.25 μg/mL浓度时,对MFC和CT26.WT的抑制率分别为34.23%和28.20%。同一多糖对不同癌细胞效果不一,一般以甘露糖,葡萄糖,半乳糖占比大的多糖抗肿瘤效果好。同时不同骨架的多糖对于不同肿瘤细胞的抑制效果亦有差异,例如以葡萄糖为主骨架、分支少的多糖比以甘露糖为主链、葡萄糖为支链的多糖对胃癌细胞(MFC)抑制率低,而以半乳糖为主链、甘露糖为支链的多糖对结肠癌细胞的抑制效果很明显。Liu等[26]发现榆耳多糖中单糖组成为半乳糖、葡萄糖、甘露糖和木糖的GI1-3比只含葡萄糖、甘露糖和木糖的GI1-4b抑瘤效果好。巨噬细胞有对甘露糖和葡萄糖具有高度专一性的受体,使得含葡萄糖、甘露糖的多糖体内通过免疫系统达到抑癌作用的效果明显[13]。我们在检测药物毒性时亦发现含有较大比例甘露糖和葡萄糖的ME-P对巨噬细胞RAW 264.7有极显著(P<0.01)增殖作用。
综上所述,本研究利用傅里叶红外、核磁共振、气相质谱联用等技术解析了四川小金县羊肚菌多糖的一级结构,ME-P由甘露糖、葡萄糖、半乳糖以4∶4∶1的比例组成,是以1,2,3,4,6-D-甘露糖 与2,3,4,6-D-甘露糖为主链,1,6-D-葡萄糖和1,2,6-D-半乳糖作为支链,4-D-葡萄糖与1,2,6-D-半乳糖连接作为末端糖的重复单位的结构新颖的多糖。药物毒性检测显示ME-P对巨噬细胞无毒害作用,且能极显著提高细胞增殖活力,增殖率可达79.5%。体外抗肿瘤活性显示ME-P对结肠癌细胞和胃癌细胞均有抑制作用,在质量浓度为1.25 μg/mL时,对CT26.WT结肠癌细胞和MFC胃癌细胞的抑制率分别为28.20%和34.23%。以上研究结果表明ME-P的结构新颖,无毒副作用并具有一定的抗肿瘤活性,该结果为羊肚菌多糖的开发与应用提供了一定的科学依据。

