麝香多肽分离纯化及其抗炎作用机制研究
弋 静,尹竹君,全云云,陈世龙,郎吉瑞,黎 勇,赵军宁,李 莉*
1西南医科大学药学院,泸州 646000;2四川省中医药科学院中医药转化医学四川省重点实验室,成都 610000;3四川逢春制药有限公司,德阳 618000
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种严重、复杂的呼吸系统疾病,临床主要表现为肺泡上皮细胞及血管内皮细胞损伤、低血压和肺泡水肿,最终导致急性低氧性呼吸衰竭[1]。ALI/ARDS的发病机制复杂,其中炎症反应失调、肺内皮细胞和肺上皮通透性增加导致肺微血管屏障破坏是ALI/ARDS病理生理紊乱的核心[2]。Wu等[3]报道巨噬细胞焦亡参与了脂多糖诱导的ALI/ARDS发病机制,且Caspase-1特异性抑制剂Ac-YVAD-CMK可以减轻肺组织损伤,减少促炎因子产生。
麝香(Moschus)是鹿科动物林麝MoschusberezovskiiFlerov、马麝MoschussifanicusPrzewalski 或原麝MoschusmoschiferusLinnaeus成熟雄体香囊中的干燥分泌物[4]。麝香,性温,味辛,归心脾经,具有开窍醒神,活血通络,消肿止痛的功效。现代医学研究发现,麝香化学成分及其复杂,具有抗炎、抗痴呆、抗肿瘤、抗脑缺血、免疫调节和激素调节的药理作用[5-7]。Zhu等[8]在小鼠巴豆油耳部炎症、大鼠酵母性和琼脂性关节炎、大鼠烫伤性炎症等多种体内炎症模型中均证实麝香多肽具有很强的抗炎活性,但抗炎作用机制尚不明确。本课题从天然麝香中提取、纯化麝香多肽,在脂多糖诱导的THP-1体外细胞模型和急性肺损伤小鼠模型中研究麝香多肽的抗炎活性并探讨其潜在的分子作用机制,以期为名贵中药材麝香的进一步研究开发和临床应用提供参考。
1 材料与方法
1.1 细胞系
THP-1细胞系自中国科学院细胞库购买。
1.2 实验动物
SPF级Balb/c雄性小鼠36只,6~8周龄,20~25 g,购自江苏集萃药康生物科技股份有限公司成都分公司(许可证号:SYXK(川)2018-100)。实验动物伦理通过四川省中医药科学院实验动物伦理委员会批准(授权编号:R20210302-1)。
1.3 实验药物
天然麝香(林麝香囊的干燥分泌物),四川逢春制药有限公司麝养殖基地提供,符合2020年版《中国药典》麝香的相关标准。地塞米松磷酸钠注射液(dexamethasone,Dex),购自国药集团容生制药有限公司,批准文号国药准字H41020036。
1.4 实验试剂
离子色谱柱(2020110501)、Claricep Flash手拧纯化柱(2020110501)购自博纳艾杰尔;离子交换树脂(2020121101)、Q Bestarose FF(2020121101)购自博格隆;脂多糖(lipopolysaccharide,LPS,L4005-100MG)购自Sigma;再生纤维素透析袋(1 kDa,S08D7G264)购自源叶生物;Mouse TNF-α(EM008-96)、Mouse IL-6(EM004-96)ELISA试剂盒购自依科赛;NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)抗体(Bs-10021R)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)抗体(Bs-6741R)、半胱天冬酶-1(Caspase-1)抗体(Bs-10743R)、IL-18抗体(Bs-0529R)购自Bioss;Anti-Gasdermin D(Ab219800)、Anti-IL-1β(Ab283818)购自Abcam;多聚甲醛(20190408)购自国药集团化学试剂有限公司;HE染液套装(G1005)购自武汉谷歌生物科技有限公司。
1.5 实验仪器
制备型离子色谱仪(Newstyle,汉邦科技);功能酶标仪(SUNRISE RC/STEEVOLYZER,Tecan);超级混匀仪(BE-3100,海门市其林贝尔仪器制造有限公司);全自动洗板机(APW-200,杭州奥盛仪器有限公司);脱水机(JJ-12J,武汉俊杰电子有限公司);包埋机(JB-P5,武汉俊杰电子有限公司);冷冻台(JB-L5,武汉俊杰电子有限公司);病理切片机(RM2016,徕卡);组织摊片机(KD-P,浙江省金华市科迪仪器设备有限公司);正置光学显微镜(Nikon Eclipse E100,尼康);成像系统(NIKON DS-U3,尼康)。
1.6 麝香多肽提取、纯化
在麝香粗品中分批次加入Tris-HCl缓冲液(pH 8.0,0.025 mol/L),最终的料液比为1∶100(麝香质量与溶剂体积之比,W/V),研磨1 h后,混合液在冰水浴超声提取(超3 s停7 s,循环30次,10% P)。超声结束后,混合液离心(12 000 r/min,5 min)取上清保存,沉淀继续加入Tris-HCl(W/V=1∶100)混合,超声破碎提取。离子交换层析柱对上清液纯化,以20 mmol/L Tris-HCl(pH 8.0),20 mmol/L NaCl溶液为流动相A相,20 mmol/L Tris-HCl(pH 8.0),500 mmol/L NaCl溶液为流动相B相。依次用5% B缓冲液冲洗,10%B缓冲液洗脱P1流分,35% B洗脱P2流分,45% B洗脱P3流分,100% B洗脱P4流分,1 mol/L NaCl洗脱P5流分,按220 nm波长出峰收集各流分。麝香多肽各流分经脱盐、冷冻干燥后得到固体粉末。
1.7 麝香多肽定性鉴定
点样毛细管(0.3 mm×100 mm)吸取2 μL麝香多肽样品分别点样至硅胶G板,硅胶板置于浓盐酸氛围酸解(110 ℃,100 min);取出硅胶G板,置于展开缸,展层液系统采用正丁醇-冰乙酸-水(4∶1∶5,V/V/V,上层);样品展开后吹干硅胶板溶剂,喷显色剂(2%茚三酮乙醇溶液),110 ℃加热25 min,显色。
1.8 麝香多肽抗炎活性筛选
1.8.1 细胞培养及模型复制
THP-1细胞生长于含有10%胎牛血清和1%青霉素-链霉素的RPMI 1640培养基,于37 ℃、5%CO2的恒温培养箱中孵育。当细胞密度达到90%左右时,对细胞进行传代用于后续实验。取生长状态良好的THP-1细胞接种于适合的培养板,100 ng/mL佛波酯(phorbol 12-myristate 13-acetate,PMA)作用24 h诱导THP-1细胞分化为巨噬细胞,更换无PMA的完全培养基静息培养24 h,最后用1 μg/mL LPS作用24 h诱导细胞炎症反应。
1.8.2 细胞活力实验
取生长状态良好的THP-1细胞以5×104个/孔接种96孔板,THP-1细胞分化为巨噬细胞;细胞分为空白组、SXP1组、SXP2组、SXP3组、SXP4组、SXP5组,另设置一个背景对照组(无细胞),背景对照组、空白组加入完全培养基,其余组分别加入SXP1~SXP5(1、10、100、1 000 μg/mL);SXP1~SXP5孵育24 h后,弃旧培养基,加入CCK8工作液;继续孵育30~60 min后,酶标仪450 nm波长处检测OD值。
1.8.3 细胞因子检测实验
取生长状态良好的细胞,以5×105个/孔接种于24孔板,THP-1细胞分化为巨噬细胞;细胞分为对照组(control,Con)、模型组(model,Mod)、SXP1组(100 μg/mL)、SXP2组(100 μg/mL)、SXP3组(100 μg/mL)、SXP4组(100 μg/mL)、SXP5组(100 μg/mL)及地塞米松组(Dex,1 μg/mL)。药物预处理2 h后,给药组加入终浓度为1 μg/mL LPS刺激24 h;收集细胞上清液,分装,-80 ℃冰箱保存;酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测细胞上清液中TNF-α、IL-1β的含量。
1.9 SXP4含量及分子量测定
经“1.8.3”中THP-1体外炎症模型筛选出SXP4有明显的抗炎活性。随后,采用BCA法测量SXP4中多肽的含量。称取5 mg SXP4,以磷酸盐缓冲液(phosphate buffer saline,PBS)为溶剂,配成5 mg/mL的SXP4母液。以BCA试剂盒检测SXP4中多肽含量,具体操作步骤按照BCA试剂盒说明书进行。
采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测SXP4分子量的分布范围。总体实验过程分为制胶、制样、上样、电泳、染色、脱色和显影。各步骤参数分别为配胶(12%分离胶和4%浓缩胶)、制样(SXP4与loading buffer体积比4∶1混合后煮沸8 min)、上样(marker上样6 μL,SXP4上样20 μL)、电泳(30 V电泳30 min、100 V电泳20 min、150 V电泳60 min)、染色(固定液振荡固定1 h,考马斯亮蓝染液振荡染色1 h)、脱色(高火加热1 min,脱色液脱色30 min,重复脱色2次)、显影(凝胶成像系统拍照)。
1.10 动物实验
1.10.1 动物分组和给药
取Balb/c雄性小鼠36只,适应性喂养一周,小鼠随机分为对照组(control,Con)、模型组(model,Mod)、SXP4低剂量组(SXP4 low dose,SXP4-L;5 mg/kg)、SXP4中剂量组(SXP4 medium dose,SXP4-M;15 mg/kg)、SXP4高剂量组(SXP4 high dose;SXP4-H,50 mg/kg)、地塞米松组(Dex,5 mg/kg),每组6只。SXP4低中高剂量组和地塞米松组分别尾静脉注射相应剂量药物(注射容积0.1 mL/10 g),连续注射3天,每天1次(注射容积0.1 mL/10 g),其余组注射等体积的生理盐水。末次给药1 h后,除空白组腹腔注射生理盐水(0.1 mL/10 g)外,其余各组腹腔注射5 mg/kg LPS(注射容积0.1 mL/10 g)。
1.10.2 小鼠血清炎症因子检测
在LPS处理小鼠6 h后,戊巴比妥钠(30 mg/kg)腹腔注射麻醉小鼠,小鼠眼眶采血,分离血清-80 ℃保存待测。ELISA法检测小鼠血清总TNF-α、IL-6的含量。
1.10.3 小鼠肺组织病理分析
取肺组织于4%多聚甲醛固定24 h以上。肺组织脱水、包埋制成石蜡切片,石蜡切片脱蜡、苏木精-伊红(hematoxylin-eosin staining,HE)染色、封片后在光学显微镜下观察,分别采集图像。
1.10.4 免疫组织化学
石蜡切片脱蜡、抗原修复、阻断内源性过氧化物酶及封闭,肺组织用一抗4 ℃孵育过夜,回收一抗,二抗室温孵育,DAB显色,苏木素复染细胞核,脱水,封片。切片于100倍下观察全部组织,分别采集图像。
1.11 统计学处理
2 结果
2.1 麝香多肽定性鉴定
通过茚三酮显色反应对麝香提取物进行多肽定性鉴定。麝香多肽定性实验结果如图1所示。根据斑点显示,SXP1~SXP4流分为多肽类物质,SXP5流分可能不含多肽。

图1 SXP1~SXP5茚三酮显色Fig.1 The ninhydrin reaction of SXP1-SXP5
2.2 麝香多肽对THP-1巨噬细胞活力的影响
麝香多肽各流分在不同浓度下分别作用24 h后细胞相对活力如图2所示。在1~100 μg/mL浓度范围内,SXP1~SXP5对正常THP-1源巨噬细胞无明显的细胞毒性作用。
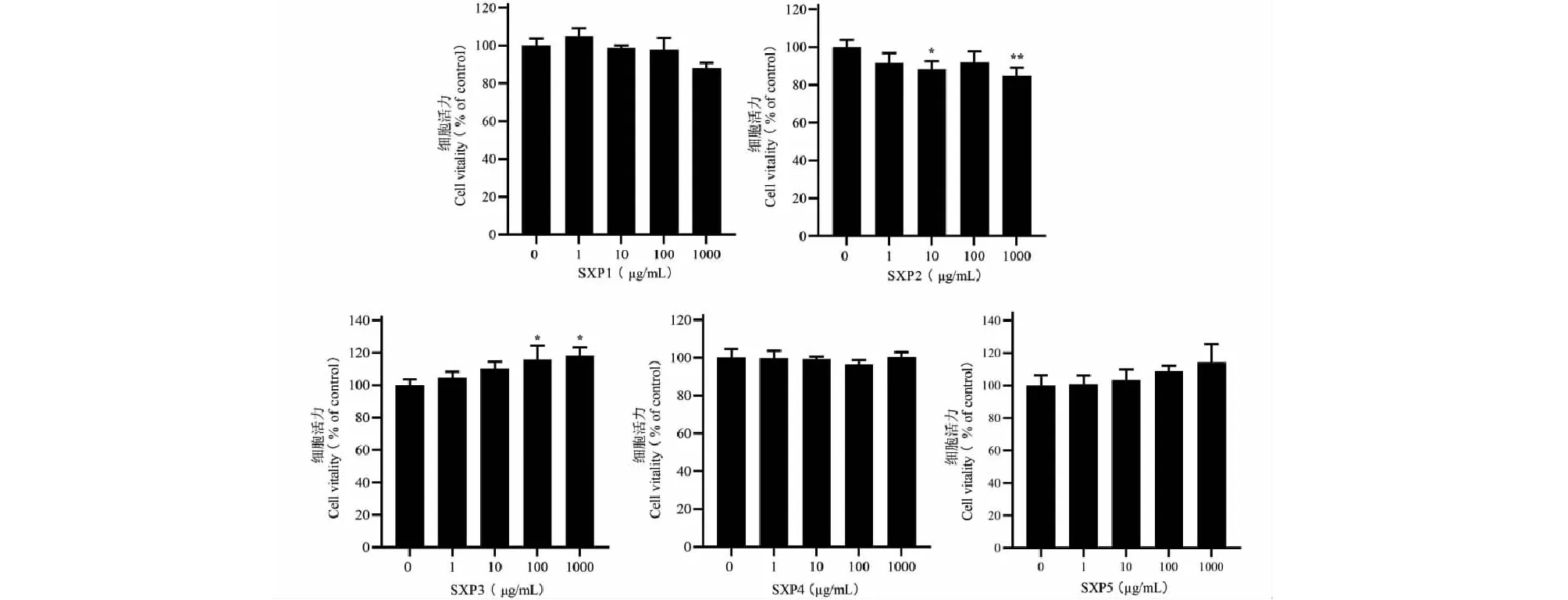
图2 麝香多肽不同流分对THP-1源巨噬细胞的细胞活力的影响Fig.2 The effects of different components in polypeptide from Moschus on THP-1 macrophages viability( 注:与空白组比较,*P<0.05,**P<0.01。Note:Compared with control group,*P<0.05,**P<0.01.
2.3 麝香多肽对LPS诱导的THP-1巨噬细胞中炎症因子的影响
如图3中所示,与空白组比较,模型组中细胞上清液中TNF-α和IL-1β明显升高,统计学差异显著(P<0.01);与模型组比较,SXP4(100 μg/mL)明显减少TNF-α和IL-1β产生,统计学差异显著(P<0.01),SXP1、SXP2、SXP3、SXP5(100 μg/mL)对IL-1β产生无明显影响,差异无统计学意义(P>0.05);SXP1(100 μg/mL)升高TNF-α含量,统计学差异显著(P<0.05),SXP2、SXP3、SXP5对TNF-α含量无明显影响,差异无统计学意义(P>0.05)。
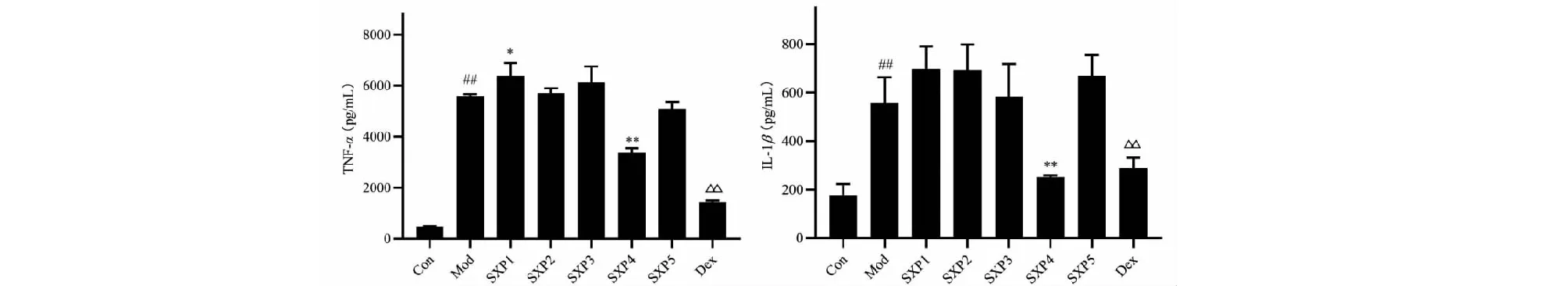
图3 麝香多肽不同流分对LPS诱导的THP-1源巨噬细胞炎症模型TNF-α和IL-1β分泌的影响Fig.3 The effect of different components of polypeptide from Moschus on the secretion of TNF-α and IL-1β in LPS-induced THP-1 macrophages( 注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01,与地塞米松组比较,△△P<0.01。Note:Compared with Con,##P<0.01;Compared with Mod,*P<0.05,**P<0.01;Compared with Dex,△P<0.05,△△P<0.01.
2.4 SXP4中蛋白质含量及多肽分子量
通过BCA法检测SXP4冻干品中蛋白质多肽的浓度为2.96 mg/mL。采用SDS-PAGE分析SXP4的分子量,结果如图4所示。SXP4为一混合型多肽,分子量大多分布在10~26 kDa范围内。
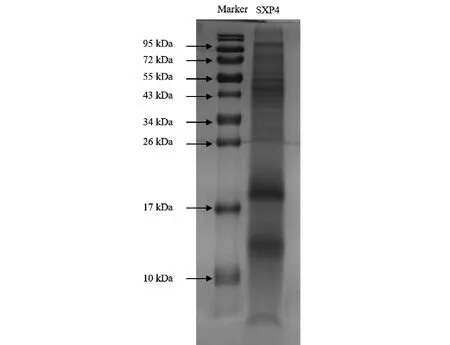
图4 SXP4的SDS-PAGE分析Fig.4 The SDS-PAGE analysis of SXP4
2.5 SXP4对小鼠血清中炎症因子的影响
ELISA法检测小鼠血清中TNF-α和IL-6浓度,结果如图5所示。与空白对照组相比,模型组小鼠血清中TNF-α和IL-6的含量明显增多,统计学差异显著(P<0.05);与模型组相比,SXP4(5、15、50 mg/kg)预防给药的小鼠血清中促炎细胞因子TNF-α和IL-6的含量明显降低,统计学差异显著(P<0.05或P<0.01)。
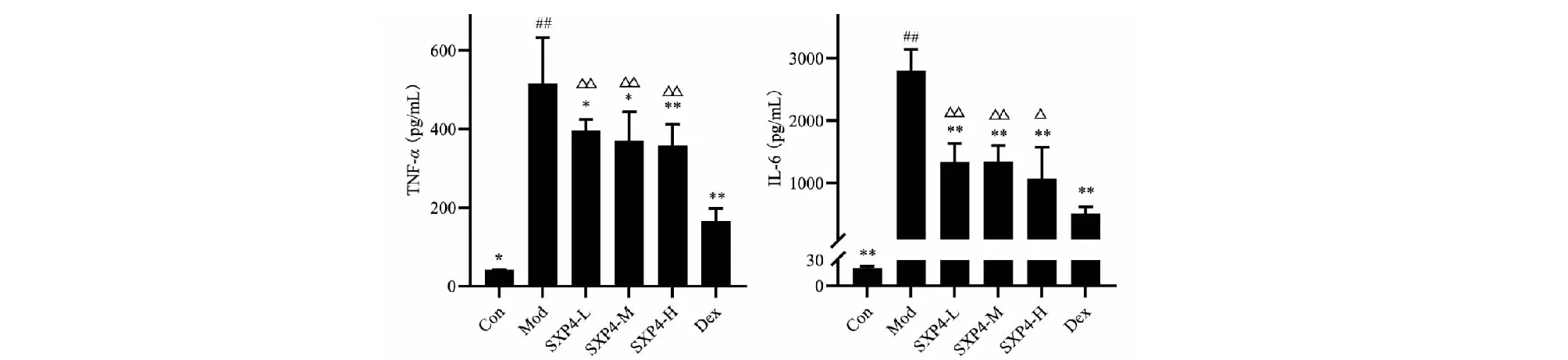
图5 SXP4对急性肺损伤小鼠血清中炎症因子的影响Fig.5 The effect of SXP4 on cytokines in serum of mice with acute lung injury注:与空白组比较,##P<0.01,与模型组比较;*P<0.05,**P<0.01;与地塞米松组比较,△P<0.05,△△P<0.01。Note:Compared with Con,##P<0.01;Compared with Mod,*P<0.05,**P<0.01;Compared with Dex,△P<0.05,△△P<0.01.
2.6 SXP4对小鼠肺组织中炎症因子的影响
如图6、7和表1所示,与空白对照组相比,模型组小鼠肺组织中IL-1β和IL-18的表达明显增多,统计学差异显著(P<0.01);与模型组相比,SXP4(5、15、50 mg/kg)预防给药的小鼠肺组织中IL-1β和IL-18的表达明显降低,统计学差异显著(P<0.01)。
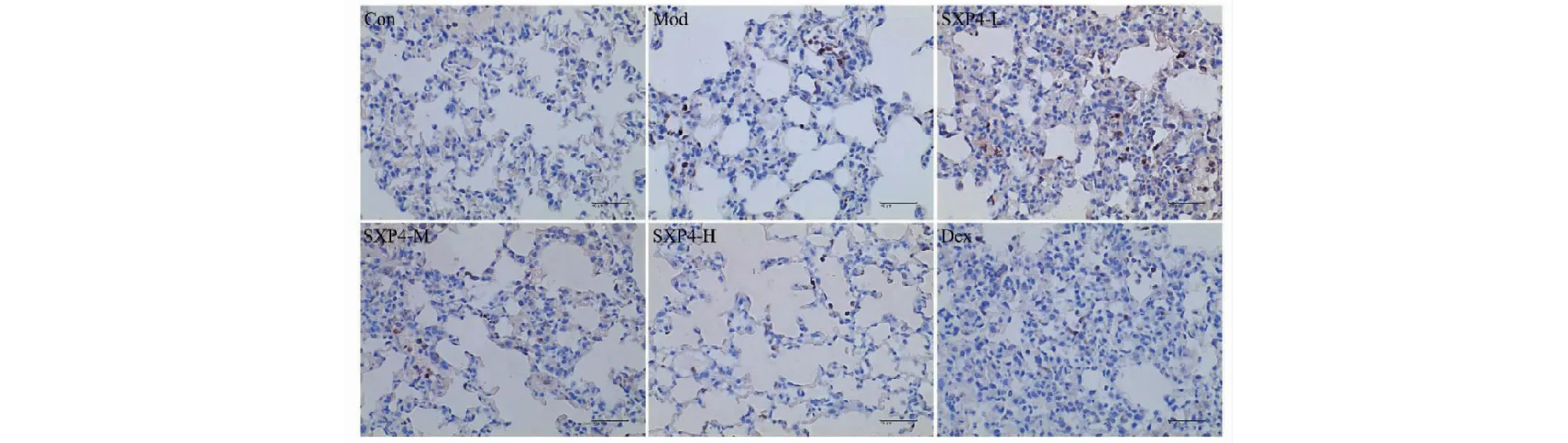
图6 SXP4对急性肺损伤小鼠肺组织中IL-1β蛋白表达的影响(×400)Fig.6 The effect of SXP4 on the protein expression of IL-1β in lung of mice with acute lung injury (×400)
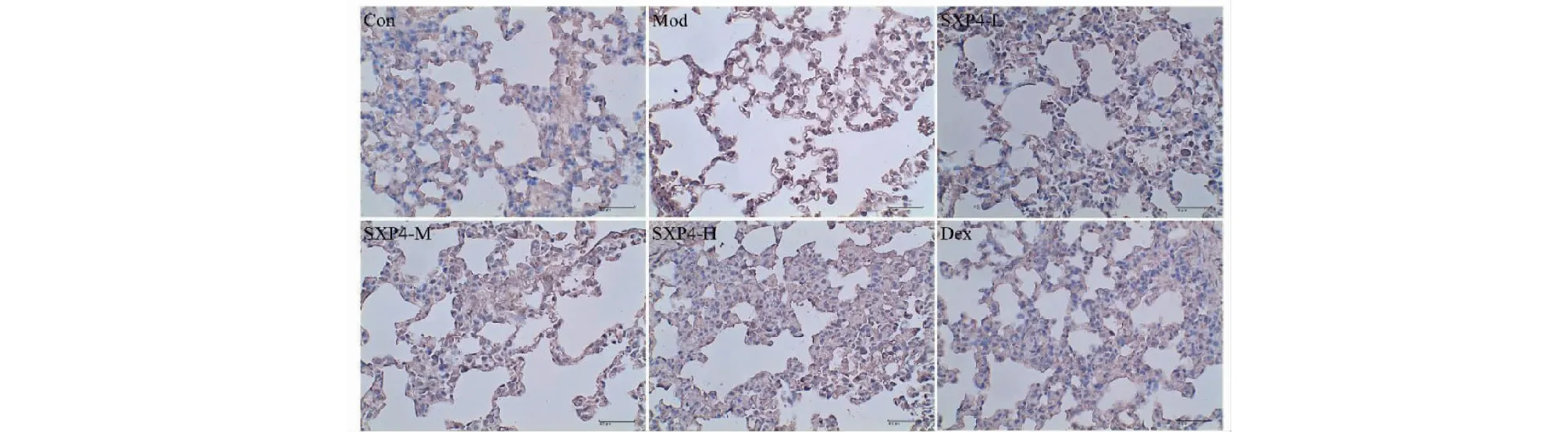
图7 SXP4对急性肺损伤小鼠肺组织中IL-18蛋白表达的影响(×400)Fig.7 The effect of SXP4 on the protein expression of IL-18 in lung of mice with acute lung injury(×400)
表1 小鼠肺组织中IL-1β、IL-18阳性面积Table 1 The positive tissue of IL-1β and IL-18 in lung of mice with acute lung injury(
2.7 SXP4对小鼠肺组织病理损伤的影响
采用HE染色观察肺组织病理变化,评估麝香多肽对脂多糖引起的肺组织损伤的影响。如图8所示,与空白对照组相比,模型组小鼠肺组织出现炎症细胞聚集、肺泡壁增厚,肺组织结构的完整性被破坏;与模型组相比,麝香多肽预给药后,小鼠肺组织中炎症细胞浸润减少,肺泡壁增厚减少,肺组织病理损伤得到缓解。

图8 SXP4对急性肺损伤小鼠肺组织病理损伤的影响(×200)Fig.8 The effect of SXP4 on pathological injury of pulmonary tissue in mice with acute lung injury (×200)
2.8 SXP4对小鼠肺组织中NLRP3/Caspase-1介导的焦亡通路相关蛋白的影响
采用免疫组化检测小鼠肺组织中NLRP3、ASC、Caspase-1、Gasdermin D蛋白阳性表达,结果如图9~12和表2所示。与空白对照组相比,模型组小鼠肺组织中NLRP3、ASC、Caspase-1、Gasdermin D蛋白的阳性表达明显增多,统计学差异显著(P<0.01);与模型组相比,SXP4(5、15、50 mg/kg)预防给药的小鼠肺组织中NLRP3、ASC、Caspase-1、Gasdermin D蛋白的阳性表达明显降低,统计学差异显著(P<0.01)。
表2 小鼠肺组织中NLRP3、ASC、Caspase-1、Gasdermin D阳性面积Table 2 The positive tissue of NLRP3,ASC,Caspase-1 and Gasdermin D in lung of mice with acute lung injury(
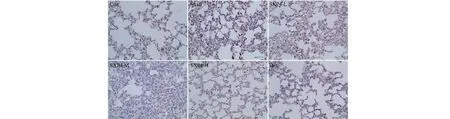
图9 SXP4对急性肺损伤小鼠肺组织中NLRP3蛋白表达的影响(×400)Fig.9 The effect of SXP4 on the protein expression of NLRP3 in pulmonary tissue of mice with acute lung injury (×400)
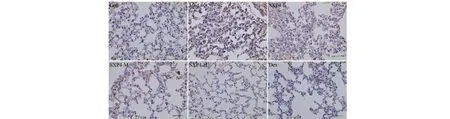
图10 SXP4对急性肺损伤小鼠肺组织中ASC蛋白表达的影响(×400)Fig.10 The effect of SXP4 on the protein expression of ASC in pulmonary tissue of mice with acute lung injury (×400)
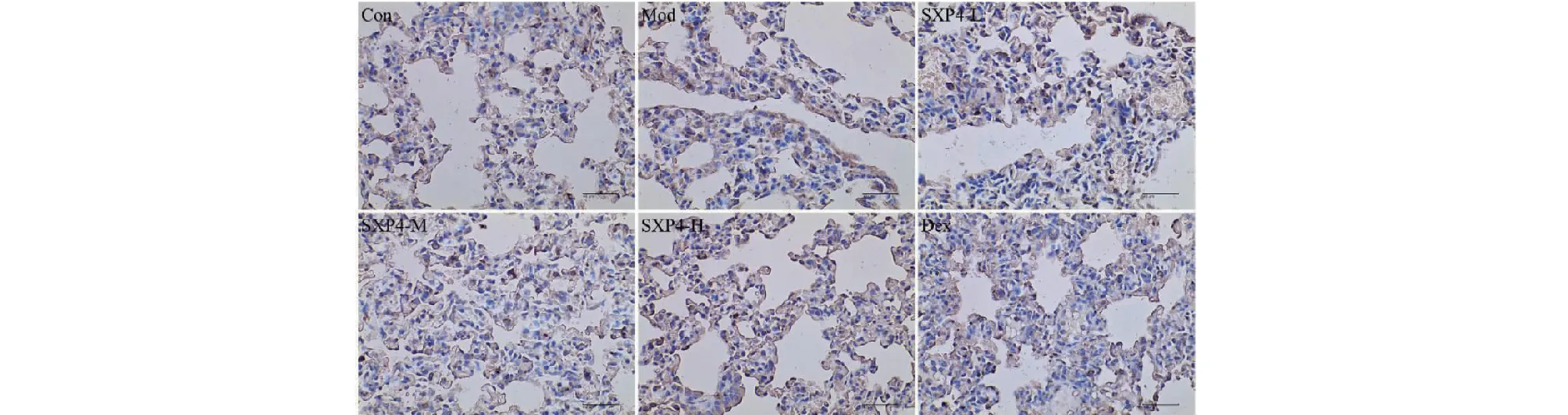
图11 SXP4对急性肺损伤小鼠肺组织中Caspase-1蛋白表达的影响(×400)Fig.11 The effect of SXP4 on the protein expression of Caspase-1 in pulmonary tissue of mice with acute lung injury (×400)
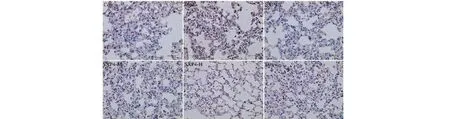
图12 SXP4对急性肺损伤小鼠肺组织中Gasdermin D蛋白表达的影响(×400)Fig.12 The effect of SXP4 on the protein expression of Gasdermin D in pulmonary tissue of mice with acute lung injury (×400)
3 讨论与结论
生物活性肽由于具有高选择性,体内代谢可预测性,低毒性和易合成等优点,可作为多种疾病的潜在治疗药物,受到国内外研究人员的广泛关注[9]。据报道,麝香多肽是天然麝香中抗炎活性成分之一。日本学者木村正康等人首次从麝香分离出分子量约为1000的多肽,具有很强的抗炎活性,能显著抑制豚鼠白细胞游走,其作用强度约为氢化可的松的40余倍[10]。Zhu等[8,10]在巴豆油致小鼠耳肿胀模型中证实,麝香-21的抗炎作用是氢化可的松的3倍,麝香-65的抗炎作用约为氢化可的松的6倍,麝香1号的抗炎强度是氢化可的松的36倍。Liu等[11]通过凝胶过滤法分离得到分子量在20万左右的Mu-a-1,对巴豆油小鼠耳部炎症具有明显的抑制作用,炎症抑制率为72.3%。THP-1单核细胞经PMA诱导可分化成巨噬细胞,具有与人原代巨噬细胞相似的表型和功能[12,13]。THP-1细胞系已被广泛用作人单核细胞和巨噬细胞的体外模型,用于炎症性疾病的机制研究[14]。LPS是革兰氏阴性菌细胞壁的活性成分,可以引起强烈的炎症反应,常常被用作体内、体外炎症模型的诱导剂[15,16]。在本次研究中,作者采用离子交换色谱层析柱从天然麝香提取液中分离纯化获得了5个流分,即SXP1、SXP2、SXP3、SXP4、SXP5。在LPS诱导的THP-1巨噬细胞模型中发现,SXP4能显著抑制TNF-α、IL-1β产生,具有较强的抗炎活性。此外,SDS-PAGE检测发现SXP4中多肽蛋白质分子量主要分布于10~26 kDa。
急性肺损伤及发展更为严重的急性呼吸窘迫综合征具有极高的死亡率,以感染、创伤、肺组织挫伤或胃内容物误吸等诱因引起的肺部炎症为特征[17,18]。本研究发现,SXP4可以明显改善小鼠肺组织的病理损伤,减少脂多糖诱导的急性肺损伤小鼠血清中TNF-α、IL-6和肺组织中IL-1β、IL-18的表达。细胞焦亡(pyroptosis)是一种程序性细胞死亡形式,依赖Caspase家族成员的酶活性,介导Gasdermin家族蛋白在细胞膜上形成跨膜孔,引起细胞肿胀破裂和IL-1β、IL-18、HMGB1等炎症介质释放,促进炎症反应[19]。研究表明,肺泡巨噬细胞焦亡在急性肺损伤中扮演着重要的作用[3,20,21]。因此,抑制细胞焦亡是急性肺损伤的潜在治疗靶点。
细胞焦亡有两条激活途径,即Caspase-1依赖的经典途径和Caspase-4,-5/-11依赖的非经典途径,这两条途径都伴随着Gasdermin D(GSDMD)裂解和IL-1β、IL-18释放[22]。经典的细胞焦亡通路由“炎症小体”介导。炎症小体是细胞内的大分子复合物,由传感器NOD样受体(NLRs)、衔接蛋白凋亡相关斑点样蛋白(ASC)和效应器Caspase-1前体(Pro-Caspase-1)组成。其中NLRP3是NLRs家族中研究最为广泛的成员。Grailer等[23]发现NLRP3炎症小体和Caspase-1在急性肺损伤发病机制中有至关重要的作用。在LPS诱导的急性肺损伤小鼠中,NLRP3-/-小鼠和Caspase-1-/-小鼠的肺组织损伤和炎症反应明显减弱。活化的NLRP3募集ASC和Pro-Caspase-1组装成NLRP3炎症小体,将Pro-Caspase-1剪切为活性形式Caspase-1,Caspase-1切割GSDMD暴露出GSDMD的氨基酸端结构域,诱导细胞膜穿孔,导致细胞肿胀和裂解[24]。同时,Caspase-1也会对IL-1β、IL-18前体(Pro- IL-1β、Pro-IL-18)加工,通过细胞膜上的孔洞释放出成熟的IL-1β、IL-18。本研究的免疫组化结果表明,SXP4可以明显减少急性肺损伤小鼠肺组织中NLRP3、ASC、Caspase-1和GSDMD的表达水平(见图13)。
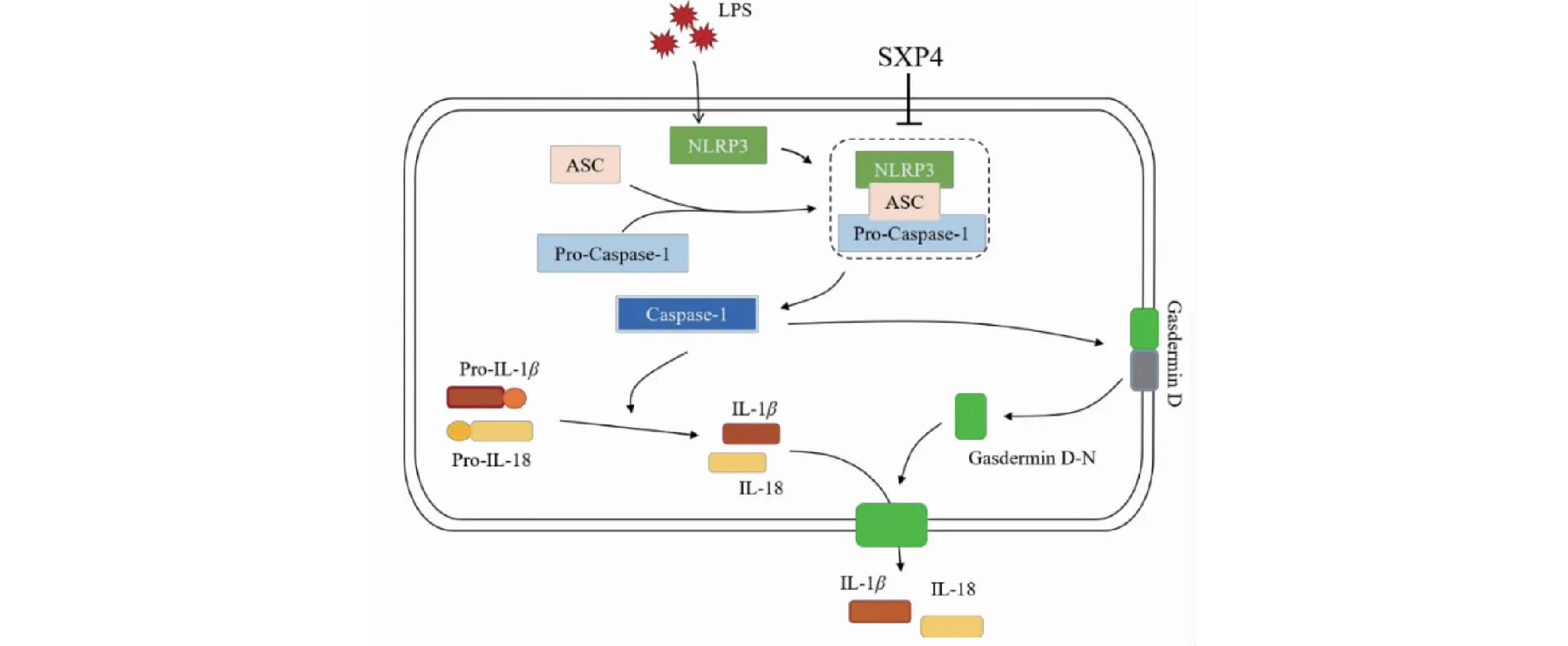
图13 麝香多肽(SXP4)的抗炎作用分子机制Fig.13 The anti-inflammatory mechanisms of polypeptide from Moschus (SXP4)
综上所述,麝香多肽SXP4可能通过抑制NLRP3/Caspase-1介导的细胞焦亡途径减少促炎细胞因子产生,减轻急性肺损伤小鼠体内的炎症反应并缓解肺组织病理损伤。

