堆肥中纤维素降解菌的筛选及复配菌降解性能研究
王继莲 李明源 周 茜 茹仙古丽·尤努斯 张 甜
(1喀什大学生命与地理科学学院,新疆 喀什 844000;2新疆帕米尔高原生物资源与生态重点实验室,新疆 喀什 844000)
我国作为农业大国,每年产生的固体有机废弃物,如作物秸秆、尾菜、畜禽粪污等数量庞大[1-2]。这些低品位废弃生物质资源仅有小部分被科学利用,绝大多数被随意弃置或就地焚烧,不仅浪费资源,而且严重污染生态环境[3]。将这些农业废弃物变废为宝,循环利用,是应对环境问题,解决能源危机的重要手段。目前,对农业废弃物无害化、减量化、资源化的治理方式主要包括焚烧、堆肥、卫生填埋、拆解法、化学法等[4]。
堆肥是在一定条件下,通过微生物的发酵作用,将有机固体废弃物转变成有机肥料的生物化学处理过程。堆肥终产品中含有作物必需的多种养分,是一种良好的土壤改良剂[5-6]。微生物作为堆肥过程的工作主体,其代谢活动直接影响物质转化速率,且对木质纤维素的充分降解是堆肥充分腐熟的关键[7-8]。在木质纤维素中,纤维素、半纤维素和木质素相互交联形成牢固的三维网状结构,尤其纤维素的不溶性和异质性使其成为抗微生物和酶攻击的屏障。但有些微生物可分泌多种纤维素酶,加速纤维素的分解转化。如李林超等[9]结合刚果红染色法、滤纸条崩解试验和纤维素酶活力测定,从玉米秸秆堆肥中筛选出3 株高效纤维素降解菌(GD16、C31 和C37),3 d 即可将滤纸条完全降解或崩解为不定形状,分别归属为类芽孢杆菌(Paenibacillus pabuli)、放线菌(Streptomyces drozdowiczii)和黄麻链霉菌(Streptomyces corchorusii);李娜等[10]根据透明圈和滤纸降解情况,从小兴安岭山区土壤中分离的低温降解菌青霉菌(Penicilliumsp.)C1,15 d 内对秸秆的降解率达55.6%。
筛选纤维素高效降解菌剂已成为有机固体废弃物高效腐解的新途径之一[11]。但当前研究多聚焦单菌株的降解性能,而单菌株所产水解酶的种类和数量有限,应对环境变化的缓冲能力不高,降解效果并不理想。复合菌系则是将不同类型的纯培养物配伍组合,其酶系相比单菌株更均衡,可通过相互间的协同作用提升纤维素转化率,降解覆盖率更高[12]。因此,相对于单一降解菌的筛选和应用而言,复合菌系的研究更值得关注。本研究拟从玉米秸秆堆肥中筛选高效纤维素降解菌,并基于菌株特性有效组配构建复合菌系,分析复合菌系的产酶特性及其对纤维素的降解效率,以期为堆肥接种剂的开发及农业废弃物的循环再利用提供菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 采集新疆喀什地区玉米秸秆高温期堆肥样品,低温条件运回实验室,4 ℃冷藏箱保存备用。
1.1.2 培养基 羧甲基纤维素钠(carboxymethylcellulose,CMC)培养基:羧甲基纤维素钠10 g·L-1、K2HPO41 g·L-1、NH4NO31 g·L-1、CaCl20.02 g·L-1、MgSO4·7H2O 0.2 g·L-1、FeCl3·6H2O 0.05 g·L-1、琼脂20 g·L-1。
滤纸条液体培养基:(NH4)2SO41 g·L-1、MgSO4·7H2O 0.5 g·L-1、KH2PO41 g·L-1、酵母膏0.1 g·L-1、滤纸条(1 cm×4 cm)3条/三角瓶,pH值7.0。
玉米秸秆培养基:(NH4)2SO42 g·L-1、K2HPO42 g·L-1、MgSO4·7H2O 0.05 g·L-1、CaCO32 g·L-1、NaCl 0.2 g·L-1、玉米秸秆粉20 g·L-1。
产酶培养基:取2 g烘至恒重的玉米秸秆段(长度约2~3 cm),加100 mL营养液。营养液组分:KH2PO41 g·L-1、NaNO33 g·L-1、KCl 0.5 g·L-1、MgSO4·7H2O 0.5 g·L-1、FeCl3·6H2O 0.01 g·L-1。
1.2 纤维素降解菌初筛
取样品1 g,溶于适量无菌水后28 ℃、150 r·min-1条件下振荡2 d,制备含有秸秆腐化菌的富集液。吸取1 mL 富集液逐级稀释,将10-7~10-4浓度的稀释液均匀涂布于CMC培养基平板上,28 ℃培养24~36 h,每个稀释度3个重复。待菌落长出后,挑取形态颜色各异、菌落直径较大的菌株反复划线纯化。纯菌株用1 mg·mL-1刚果红染液染色15~20 min,弃染液,加入1 mol·L-1NaCl 溶液,洗涤15 min 后测量菌落直径(d)和降解圈直径(D)。视D/d 较大者为高羧甲基纤维素酶(carboxymethyl cellulase,CMCase)活力菌株。
1.3 滤纸条崩解试验
滤纸的崩解能力表征了微生物所产各种纤维酶的综合酶活力水平[13]。为进一步复筛优良菌株,将高CMCase 活力菌株的菌悬液按比例接种于100 mL 滤纸条液体培养基中,以不接种任何菌液为对照,置于恒温摇床中28 ℃、60 r·min-1条件下低速振荡培养,定期观察滤纸条断裂情况。
1.4 拮抗试验
吸取各菌液0.5 mL涂布于CMC培养基平板上,将无菌滤纸条(1 cm×4 cm)在菌液中充分浸湿,然后平铺于CMC 平板上,置于28 ℃恒温培养箱中培养2 d。参考张必周等[14]的方法,检查滤纸条与CMC培养基周围是否形成无菌区,有无菌区形成则表示两菌株间有拮抗性,不能配伍。
1.5 复合菌系的构建及纤维素酶活力测定
基于菌株的CMCase活力、滤纸条崩解能力及兼容性,设置xw1 等单菌株组,并以3~5 株菌为基础,等体积混合构建复合菌系。分别将单菌株和复合菌系按5%比例接种至100 mL产酶培养基中,150 r·min-1条件下振荡培养5 d,12 000 r·min-1条件下离心,所得上清作为粗酶液进行酶活力测定。
1.5.1 滤纸酶活力测定 参照萨如拉等[15]的方法,利用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法制作葡萄糖标准曲线。分别取单菌株和复合菌系的粗酶液0.2 mL,加入0.1 mol·L-1的醋酸-醋酸钠缓冲液(pH 值4.8)1 mL 和2 条1 cm×4 cm 的滤纸条,50 ℃水浴60 min。以灭活的酶液为对照,测定单菌株和复合菌系的滤纸纤维素酶(filter paper cellulase,FPase)活力。在反应条件下,每分钟催化水解纤维素产生1µg葡萄糖所需的酶量为1个酶活力单位(U)。
1.5.2 酶的耐高温性 秸秆在堆肥腐熟过程中会释放大量热量,产生高温,影响菌剂的酶活力,因此设计试验验证复合菌剂所产纤维素酶的高温耐受性。以滤纸条为底物,分别测定复合菌系在40、45、50、55、60、65 ℃等6个温度下的FPase活力,分析其耐高温性。
1.6 复合菌系的纤维素降解特性
1.6.1 滤纸腐解 以滤纸为直观指标,考察复合菌系构建前后的纤维素分解能力差异。将复合菌系按一定比例接种到100 mL滤纸条液体培养基中,28 ℃、60 r·min-1条件下低速摇瓶培养。以不接菌为对照,定期观察滤纸条崩解情况,对比分析复合菌群重构前后的滤纸崩解效果。
1.6.2 秸秆降解试验 分别将单菌株和复合菌系接种到100 mL 玉米秸秆培养基中,以不接种任何菌系为对照(CK),28 ℃、150 r·min-1条件下培养发酵10 d。过滤发酵液,秸秆粉用蒸馏水反复冲洗3 次,随后用稀酸溶液冲洗2次去除附着的菌体和CaCO3沉淀等,最后再用蒸馏水冲洗2次,80 ℃烘干至恒重,以失重率计为秸秆降解率[16]。
1.7 菌株鉴定
采用CW0552试剂盒(北京康为世纪生物科技股份有限公司)对优良复合菌系中的单菌株进行DNA提取。采用一对通用引物27F(5′-AGAGTTGATCATGGCTCAG-3′)和1492R(5′-TAGGGTTACCTTGTTACGACTT-3′)[17]对16S rDNA 进行PCR 扩增。PCR 体系(50 µL):模板1 µL,引物27F 和1492R(10 µmol·L-1)各1 µL,2×Taq MasterMix 25µL,加ddH2O 至50µL。测序结果在美国生物技术研究中心(National Center for Biotechnology,NCBI)数据库中进行BLAST 比对,在GenBank 中寻找相似性最大菌株的基因序列进行多重比对,用MEGA7.0 软件包中的邻接(Neighbor-Joining)算法构建系统发育树。
2 结果与分析
2.1 纤维素降解菌株的分离
利用刚果红染色法,从堆肥样品中获得29 株具有纤维素降解能力的分离物。对透明圈和菌落直径比值D/d较大者进一步筛选,最终得到11株高CMCase 活力菌株,如表1所示。
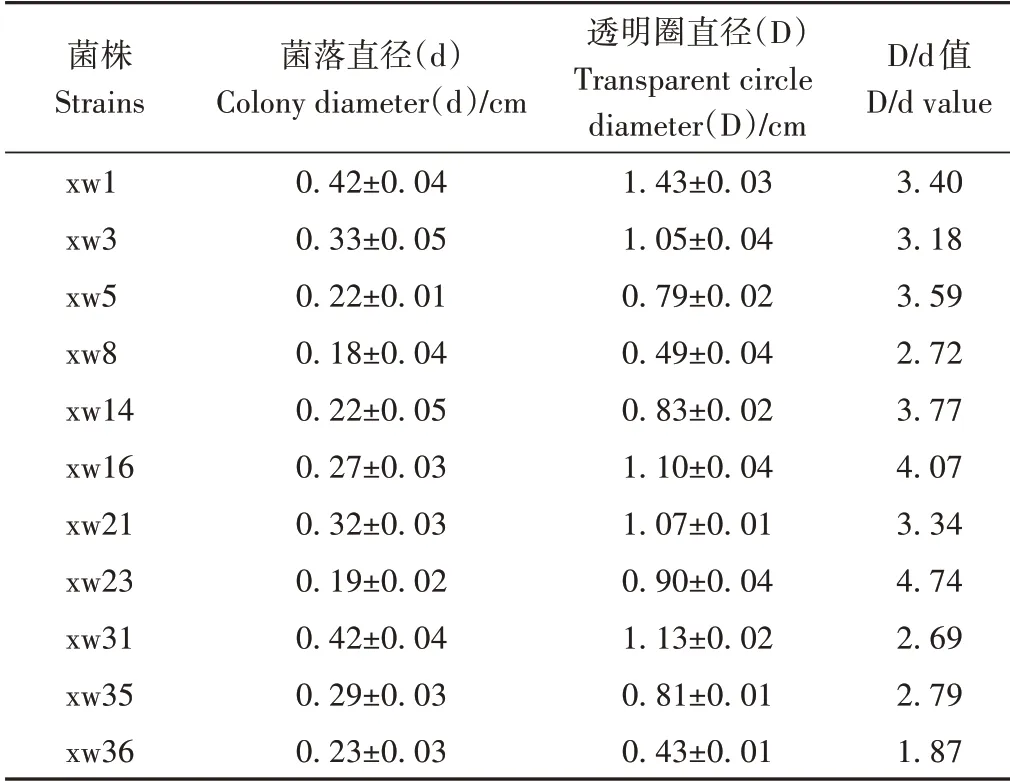
表1 纤维素降解菌的初筛Table 1 Screening of cellulose degrading microorganisms
2.2 不同菌株的滤纸条崩解效果
通过滤纸条崩解进一步复筛优良菌株,由表2可知,11 株高CMCase 活力菌株均能有效崩解滤纸条,但降解能力不同。菌株xw1 的降解能力最强,7 d 内可将滤纸条崩解为近似糊状;菌株xw3 次之,5 d 内可将滤纸条崩解为不定形状,11 d 完全崩解;菌株xw16和xw31 在7 d 内才能将滤纸条崩解为不定形状。其余菌株则在7~15 d 内陆续使滤纸条软化或降解为短片段,最长需20 d 才能将其完全崩解。而未接菌的对照组,滤纸条仍保持完整无破裂状态,呈片状堆积(图1)。

表2 各菌株的滤纸崩解效果Table 2 Filter paper degradation effect of isolates

图1 菌株培养5 d的滤纸条崩解效果Fig.1 Filter paper degradation effects of isolates cultivated for 5 d
2.3 菌株复配结果
菌株相互间的兼容性结果如表3所示,菌株xw1与xw5、xw14、xw23的相交处均形成了无菌区,说明它们之间存在拮抗作用,不能组合。同样,xw3、xw5均与xw14、xw23有拮抗,x35与xw5、xw14、xw16有拮抗,不能复配。

表3 单菌株间的拮抗关系Table 3 Antagonistic relationship of isolates
综合菌株的CMCase活力,滤纸条崩解能力及兼容性,以3~5 株菌为基础进行复配,共构建了6 组复配菌系,分别为A(xw3、xw5、xw8、xw16、xw21),B(xw1、xw3、xw8),C(xw1、xw3、xw21、xw31),D(xw16、xw21、xw31),E(xw8、xw16、xw23),F(xw3、xw5、xw8、xw21、xw31)。
2.4 复合菌系纤维素酶活力测定
2.4.1 复合菌系的滤纸酶活力测定 滤纸酶活力是以滤纸为底物来测定纤维素酶对天然纤维素的总分解能力,是所有纤维素酶系共同作用结果的反应,对菌株分解纤维素能力的评价更客观,因此测定滤纸酶活力比较菌群构建前后效果。总体上看,除复合菌系F外,其余复合菌系的酶活力均显著高于单一菌株(P<0.05),说明通过构建复合菌系的方法可显著提高纤维素降解潜力(图2)。单菌株中xw23 的酶活力最高,为15.4 U·mL-1,但前期崩解滤纸条的能力并非最强;其次是xw3,为14.4 U·mL-1;xw5、xw21、xw31 间的酶活力无显著差异(P>0.05),均高于xw16,但崩解滤纸条能力均不如xw16。复合菌系中则以B 菌系酶活力最高,为22.8 U·mL-1,比其中的最强单菌株xw3高出58.3%;其次为D 菌系,酶活力为20.4 U·mL-1,比其中的最强单菌株xw21 高出68.6%。初步表明复配菌系B、D 相比其他菌系具有更高的降解潜力。

图2 发酵液的滤纸酶活力Fig.2 Filter paper enzyme activity of fermentation broth
2.4.2 不同温度下的滤纸酶活力 堆肥过程中纤维素的降解主要发生在高温期,因此菌剂在高温下的生物降解活力对堆肥腐熟具有重要意义[18]。各复合菌系在不同温度下的滤纸酶活力如图3所示,其对高温的耐受性有明显差异。复合菌系F在各温度下的酶活力一直最低,A、C的酶活力则随温度升高呈下降趋势,高温耐受性较差,复合菌系E 能耐受55 ℃高温,但超过60 ℃后酶活力骤然下降,只有9.6 U·mL-1。而复合菌系B、D 所产纤维素酶能耐受40~55 ℃高温,至65 ℃时滤纸酶活力仍维持在14.1、11.7 U·mL-1,耐高温性强。
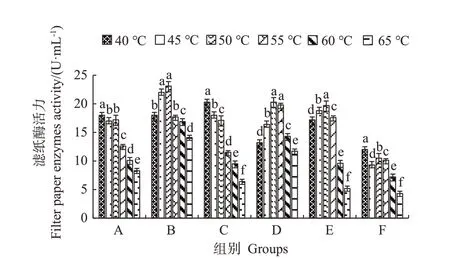
图3 不同温度下的滤纸酶活力Fig.3 Enzyme activity of filter paper at different temperatures
2.5 复合菌系的纤维素降解特性研究
2.5.1 滤纸条降解 对滤纸条崩解能力的观察能更方便、直观地比较菌群重构前后的降解效果。结果显示,复合菌系B、D 的滤纸条降解效率较高,接种1 d 即发生软化,3 d 后断裂,5 d 内崩解为糊状,崩解时间比单菌株短;复合菌系C、E 降解能力次之,培养3 d 后滤纸条边缘模糊,7 d才被完全崩解,但也优于单菌株;而复合菌系F 的降解效果相比单菌xw3、xw31 没有太大差异,13 d 才将滤纸条完全崩解。图4显示了复合菌系B 对滤纸条的崩解情况。总体上,除复合菌系F 外,其他复合菌系崩解滤纸条的能力均优于单菌株。

图4 复配菌系B对滤纸条的崩解效果Fig.4 Filter paper degradation effects of the compound strains B
2.5.2 秸秆降解 为进一步验证复合菌系对实际材料的降解能力,将单菌株和复合菌系接种于玉米秸秆液体培养基中培养10 d后,测定秸秆降解率,结果显示不同处理效果差异较大(图5)。相比而言,复合菌系的降解效果要优于单一菌株,尤以B、D 的降解率较高,分别为24.5%、21.9%,比其中的最强单菌株xw8、xw31 增加9.4 和4.7 个百分点。复合菌系A、C 的效果次之,分别为20.2%、19.8%,比其中的最强单菌株xw21、xw31 增加4.8 和2.6 个百分点。复合菌系中F的降解效果最弱,比单菌株xw31 降低了19.2 个百分点。
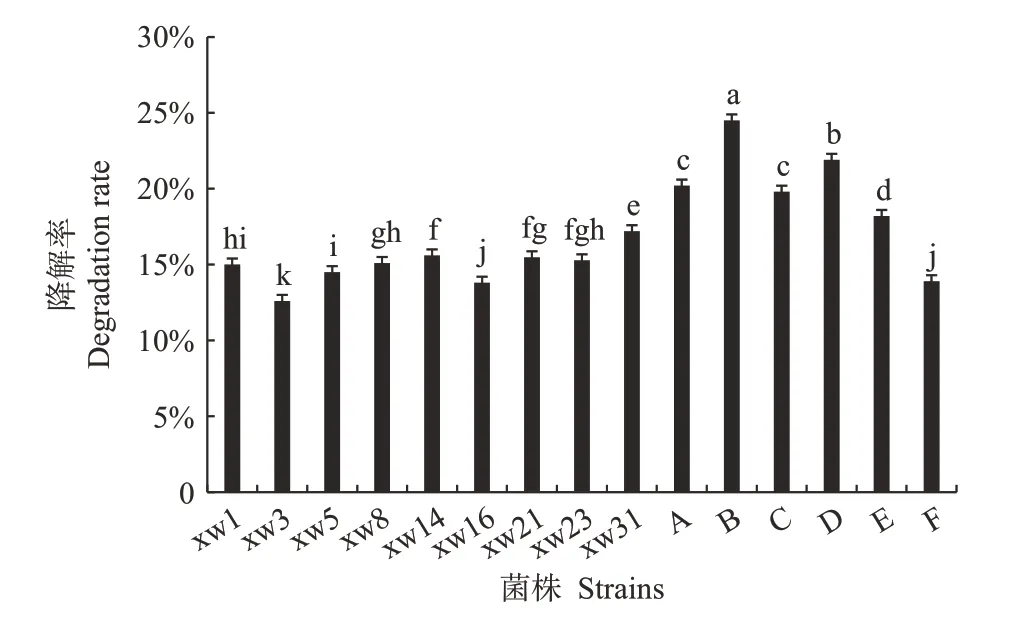
图5 不同菌系处理的秸秆降解率Fig.5 Degradation rate of straw treated by different strains
2.6 菌株鉴定
利用16S rRNA 通用引物进行聚合酶链式反应(polymerase chain reaction,PCR),获得各菌株的16S rRNA 基因序列,运用MEGA 7.0 软件进行多重序列比较并绘制系统发育树(图6)。结果表明,复合菌系B中的菌株xw1 为微杆菌属(Microbacteriumsp.),xw3、xw8为类芽孢杆菌属(Paenibacillussp.)。而复合菌系D 中的xw16 和xw21 均为芽孢杆菌属(Bacillussp.),xw31为类芽孢杆菌属(Paenibacillussp.)。
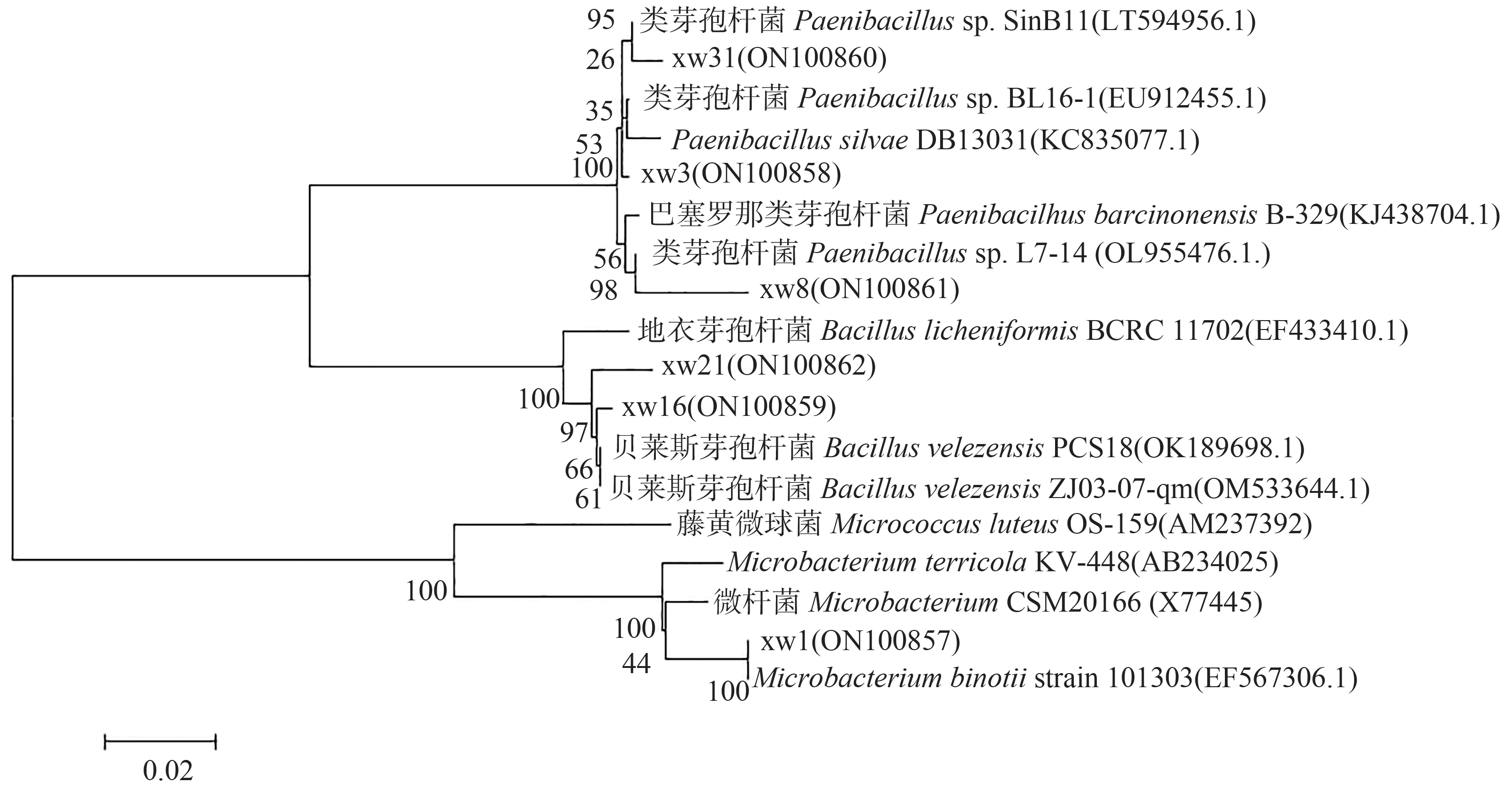
图6 纤维素分解菌的系统发育树Fig.6 Phylogenetic tree of 16S rRNA sequences of the celluloses-degrading strains
3 讨论
纤维素分解菌在加速堆肥腐熟进程、提高堆肥效率方面发挥着重要作用,如芽孢杆菌B01 可提高园林废弃物堆肥中的纤维素和木质纤维素降解率[19]。滤纸是聚合度和结晶度都居中等的天然结晶类纤维素,以其为底物的滤纸酶活力表征了纤维素酶系的总糖化能力[20],在纤维素高效腐解菌的选育中被广泛应用。但多数菌株对纤维素的降解是通过细胞表面酶进行的,需要附着在材料表面才能将其降解[21],因此菌株的滤纸酶活力只能反映胞外酶活力大小,而非对真实底物的实际腐化能力[11]。本研究发现单菌株xw23 的滤纸酶活力最高,但对滤纸的崩解能力却次于菌株xw1。另一方面,仅通过测定纤维素酶活力来评价微生物的分解能力是不全面的。如刘东阳等[22]研究证实,虽然蜡状芽胞杆菌的滤纸酶活力不是最高的,但其分解小麦秸秆的能力最强,酶活力和实际降解能力并不趋同。原因可能是不同碳源(滤纸、玉米秸秆)对酶生成的诱导性不同[23],虽然滤纸特性接近天然纤维素,但与天然材料依然存在差异。因此,菌株降解性能测定还需结合其他指标,采用多重评价标准对其进行综合分析。
纤维素分子是由吡喃葡萄糖单元以β-1,4糖苷键缩合而成的直链同聚多糖,结构致密,结晶度高,其确切的降解机理至今尚无定论。目前接受度较高的是协同理论,即需要内切-β-1,4-葡聚糖酶(endo-β-1,4-glucanase)、外切葡聚糖酶(exoglucanses)和β-葡萄糖苷酶(β-glucosidase)3 种酶的共同作用[24]。内切酶作用于纤维素链的非结晶区,产生纤维素反应末端;外切酶作用于结晶区,产生纤维二糖或葡萄糖;β-葡萄糖苷酶则将纤维寡糖水解成单糖分子,三者的作用顺序没有固定性,协同完成纤维素分子降解[25]。本研究发现,复合菌系B、D 的滤纸酶活力及滤纸崩解能力均优于单菌,与李静等[26]、张必周等[14]的研究结果一致,说明通过菌群重构的方法可补充完善体系中的降解酶系,提升降解潜力。进一步的秸秆降解试验表明,复合菌系B、D 发酵10 d 后对玉米秸秆的降解率分别为24.5%、21.9%,而市售腐熟剂培养15 d 后的降解率约11.5%[27],复配菌的秸秆崩解程度更高,进一步证实了菌群内部的协同合作可赋予复合菌系更丰富的生理代谢功能。但也有例外,如复合菌系F 对滤纸条和秸秆的降解效果相比单菌株并没有显著增加,滤纸酶活力甚至有所降低。原因可能是该混合群体在养分含量有限的环境下出现了营养竞争现象,影响了各菌株的生长状态,抑制其产酶能力,导致酶系组分不齐全,最终未起到互补效应。
国内外对微生物分解转化纤维素的研究已有较多报道,以霉菌居多,对细菌的研究相对较少。但霉菌在培养过程中常伴随酸败霉腐气味,并具有一定毒性,产酶周期也较长,制约其在食品发酵、畜禽饲料等领域的应用[28]。而细菌的稳定性和环境适应性较好、培养方便,且基因组精简无内含子,可直接克隆目的基因,这既方便研究纤维素酶基因的多样性,也利于构建不同功能酶协同作用的工程菌[29]。本研究分离的微杆菌、类芽孢杆菌和芽孢杆菌属均属于厚壁菌门,是秸秆自然发酵过程中的优势菌门[30-31]。微杆菌和类芽孢杆菌对多种有机物有降解能力[32-33],而芽孢杆菌生理特性丰富多样,可产生多种胞外水解酶类,以感受态基因X(competence gene X,ComX)信息素和感受态及产孢因子为信号分子介导群体感应的调控过程[34]。推测复合菌系D 中的芽孢杆菌能够起到信号传递的功能,与环境中的类芽孢杆菌协同作用,促进秸秆降解。
秸秆的腐解是在高温下进行的,而多数微生物所产纤维素酶的热稳定性不理想,影响了纤维素降解效果。本研究发现,复合菌系B、D 分泌的纤维素酶能耐受40~55 ℃高温,65 ℃时仍保持一定酶活力,具有高温耐受性,这是其作为高温堆肥菌剂的潜在优势,在热加工要求较高的重金属污染修复、纸浆造纸等行业也具有广阔的应用前景。
4 结论
本研究从堆肥中分离到29 株纤维素降解菌,并基于单菌株特性构建了6 个复合菌系。以复合菌系B(xw1、xw3、xw8)、D(xw16、xw21、xw31)的酶活力最高,分别为22.8、20.4 U·mL-1。复合菌系B、D 在培养5 d时可将滤纸崩解为糊状,发酵10 d 后对玉米秸秆降解率分别达到24.5%、21.9%。经16S rDNA 分子鉴定,复合菌系B 由微杆菌属(Microbacteriumsp.)、类芽孢杆菌属(Paenibacillussp.)组成,复合菌系D由芽孢杆菌属(Bacillussp.)、类芽孢杆菌属(Paenibacillusp.)组成。

