肥料袋控缓释对苹果新根生长和氮素吸收的影响
张守仕 谢克英 常介田 徐明辉 韩 芳 柴梦颖 乔宝营 孙文英
(河南农业职业学院,河南 郑州 451450)
随着“药肥双减”项目的持续推进,缓释肥因其养分利用率高[1]、省工[2]等优点在水果生产中得到重视[3-4]。颗粒包膜型缓释肥因成本高,影响了其在果树生产中的推广应用。与颗粒包膜型缓释肥相比,采用纸塑材料包裹袋内肥芯,包装机热封封口做成的袋控缓释肥成本降低30%~50%,取得了良好效果[5],且袋内肥芯释放完后纸塑材质在土壤中易降解,在山东、陕西等国内果品生产大省得到推广应用。张亚飞等[6]研究认为桃树施用袋控缓释肥后土壤养分含量保持稳定,细根的发生增多,根系寿命延长,氮肥利用率提高,果实品质提高。前人在探讨桃、苹果等果树使用缓释肥后养分利用率提高的原因时,多从缓释肥养分释放和土壤养分供应角度出发,认为与普通化肥撒施法相比,缓释肥施用后养分释放慢[7],土壤养分浓度变化幅度小[6-8]。
根系是果树吸收养分的主要器官,尤其是新生根系吸收养分的能力更强[9]。新生根系生长一段时间后会变为褐色,吸收养分的能力也会下降,甚至有些根系会死亡。能够进行次生生长的新根发育成为多年生骨干根固定植株,作为养分运输通道[10]。与骨干根相比,新根数量增多,根系变褐时间延长,寿命延长,有利于吸收养分。刘照霞等[11]以烟富3矮化中间砧苹果为试验材料,研究萌芽前不同位置施氮对新梢旺长期细根分布、氮素吸收的影响,发现施氮增加了细根根长密度,且根长密度和氮素利用率因施肥位置而异。Baldi等[12]研究表明,与撒施氮肥相比,施用有机肥提高了桃细根数量,延长了褐变时间和细根寿命;该研究还发现根系寿命与土壤硝态氮含量相关。从养分释放速度看,有机肥比化肥缓慢、平稳,缓释肥与有机肥类似,但缓释肥对果树根系生长、发育的影响研究尚鲜见。因此,研究缓释肥施肥对根系生长、发育的影响,尤其是新根产生、褐变、死亡等动态变化情况,从根系自身角度找到养分利用率提高的原因具有重要意义。施肥对果树地上部生长发育的影响研究较多[13-14],但受观测难度大的影响,对果树根系生长、发育的研究相对较少。通常研究者采用挖掘法[15]、根钻法[16]、根窖法[17]等研究果树根系,但存在对根系扰动大,仅体现阶段性结果,且准确度不高等问题。微根管法对根扰动较小,可通过摄像机及分析软件获得根系的生长和死亡动态,目前已广泛应用于植物根系研究[18]。基于此,本研究采用微根管观察比较袋控缓释肥等不同肥料施用下苹果根系细根生长情况,结合15N同位素示踪技术从细根生长、发育角度探讨袋控缓释肥提高苹果氮肥利用的原因,以期为苹果产业绿色发展提供理论依据。
1 材料与方法
1.1 试验设计
试验地位于河南省大宗水果中牟综合试验站内,供试品种为自主繁育的弘前富士。2013年3月定植,采用南北行向栽培,株行距为2 m×4 m,树形为细长纺锤形。果园土壤类型为砂质壤土,土壤有机质含量11.26 mg·g-1,pH 值7.68,铵态氮含量5.07 mg · kg-1,硝态氮含量12.43 mg·kg-1,有效磷含量86.58 mg·g-1,速效钾含量143.84 mg·g-1。2018年3月初挑选大小均匀一致的5年生苹果树24株,分为2组,第一组15株用于根系观察试验,第二组9 株用于15N 示踪试验。试验设肥料袋控缓释施肥(BCRF)、撒施施肥(SA)、不施肥(CK)3 个处理,根系观察试验每处理5次重复,15N 示踪试验每处理3次重复,单株重复。
1.2 试验处理与样品采集
肥料袋控缓释施肥处理在2018年3月20日株施12 袋(规格95 g/袋)袋控缓释肥,每袋含有尿素40 g、二铵14 g、硫酸钾41 g,挖坑施肥。施肥坑分别在苹果树冠地面投影内东西、南北方向距树干40、80、120 cm处,施肥时铁锹入土深20 cm,将铁锹略前倾撬开土后将一袋袋控缓释肥放入底部,抽出铁锹,踩实施肥位置。以后每年3月中旬在上一年施肥处外移5 cm 以同样量进行施肥。撒施施肥处理施肥位置和施用量与肥料袋控缓释施肥处理相同,分两次进行,60%在3月份进行,剩余40%在8月下旬进行。不施肥处理只挖土不施肥。施肥后在正东南侧距树干60 cm 处埋入长70 cm、外径粗70 mm、管壁厚3.2 mm 的透明丙烯酸塑料材质微根管。微根管与地面呈45°夹角,管口距地5 cm 左右,管底距地面垂直距离40 cm,安装前管底密封,微根管漏出地面部分先用黑色胶带包裹,再加一层铝箔,试验过程中注意保护微根管,防止扰动,避免水分进入。微根管安装后需要稳定一段时间,数据采集从2018年6月开始,生长季内观测周期为2 周,分别在每月1日和15日观察,休眠期观测周期为4周,仅在每月15日观察。采用CID-CI600 植物根系生长监测系统(美国CID 公司)进行根系图片的采集。根据微根管编号、观测层次、取样时间、细根编号建立新根数据库。图像采集面积为21.59 cm×19.57 cm,利用系统所带ROOTSNAP 根系图像分析软件(美国CID 公司)进行根系数量分析。白色与褐色新根定义为活根,黑色或皱缩的根和两次观测期间消失的根定义为死根。
15N 示踪试验于2018年3月进行,处理试材和处理方法同上,袋控缓释施肥每个肥料袋内装有4 g15N尿素(上海化工研究院,丰度10.10%)和36 g 普通尿素;撒施施肥处理两次施肥时分别混有2.4 g 和1.6 g15N 尿素。当年冬季苹果植株落叶后对植株进行破坏性取样,整株解析为细根(直径<2 mm)、粗根(直径≥2 mm)、中心干、多年生枝、一年生枝。样品洗净后,105℃杀青30 min,80 ℃烘干至恒重,称量干物质质量,不锈钢电磨粉碎后过60 目筛,混匀后装入自封袋中备用。采用Isoprime100 型质谱仪(英国Elementar 公司)测定植株样品15N 丰度。植物样品经浓硫酸-过氧化氢消煮后,用BDFIA8000 流动注射分析仪(北京宝德仪器有限公司)铵态氮模块测定样品含氮量。
于2018年3月底、6月初、8月底、11月底用不锈钢土钻在苹果树冠地面投影内两施肥方向中间位置、距树干40~100 cm范围处取土样,土样分为0~20 cm、20~40 cm两层,带回实验室进行土壤矿质态氮(mineral nitrogen,Nmin)(NH4+-N+NO3--N)测定。将土壤样品过2mm筛,2mol ·L-1KCl 溶液浸提后用BDFIA8000 流动分析仪(北京宝德仪器有限公司)的铵态氮、硝态氮模块进行测试。
于2018年8月底、12月底在苹果树冠地面投影内两施肥方向中间位置、距树干40~100 cm 范围处用土钻取土样。土样冲洗后保留根系,采用氯化三苯基四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)还原法测定新根根系活力。
1.3 数据处理与统计分析
新根中值寿命指存活率为0.5 时对应的生存时间,采用SPSS 19.0 软件中的生存分析进行计算。通过对数秩检验对新根中值寿命进行单因素比较,并检验其差异显著性。新根年周转率为年新根死亡量与年新根现存量之比。
Ndff(g)指植株器官从肥料中吸收分配到的15N量。Ndff(%)指Ndff(g)对该器官全氮量的贡献率,反映植株器官对肥料15N的吸收征调能力。相关计算公式如下:
Ndff(%)=[样品中的15N 丰度(%)-自然丰度(0.366%)]/[肥料中15N的丰度(%)-自然丰度(0.366%)]×100%;
总N量(g)=干物质质量(g)×N浓度(%);
Ndff(g)=总N量(g)×Ndff(%);
氮肥利用率=Ndff(%)×植株总N量(g)/施15N量(g)×100%。
使用SPSS 19.0 软件分析数据,Excel 2019 绘制图表,不同处理间差异性分析采用Duncan新复极差法检验。
2 结果与分析
2.1 肥料袋控缓释对土壤Nmin的影响
土壤NH4+-N 和NO3--N 可以被根系直接吸收,两种氮素之和被称为Nmin。由表1和表2可知,土壤NH4+-N含量相比NO3--N含量处于较低水平。0~20 cm土层肥料撒施施肥处理NH4+-N含量变化范围在9.62~33.34 mg·kg-1之间,变异系数为58.4%,变化较大;袋控缓释处理NH4+-N 含量变化范围在12.46~21.34 mg·kg-1之间,变异系数为21.8%,变化较小;随施肥时间延长,袋控缓释处理NH4+-N 含量高于肥料撒施处理。20~40 cm 土层肥料撒施施肥处理NH4+-N 含量变化范围为8.94~15.86 mg·kg-1,变异系数为23.4%,变化较大;袋控缓释处理变异系数为9.8%,变化较小;袋控缓释处理NH4+-N 含量在采样期内均显著高于不施肥处理和撒施施肥处理。

表1 肥料袋控缓释对土壤NH4+-N含量的影响Table 1 Effect of bag-controlled release fertilizer on soil ammonium nitrogen content(/mg·kg-1)
0~20 cm 土层肥料撒施施肥处理后土壤NO3--N含量迅速提高,之后随取样时间延长开始降低,变化范围为21.67~386.56 mg · kg-1。20~40 cm 土层肥料撒施处理土壤NO3--N含量变化范围为15.48~315.68 mg · kg-1,两土层变异系数分别为116%和129%。袋控缓释处理土壤NO3--N含量在前两次取样时低于肥料撒施处理,后期开始高于肥料撒施处理,0~20 cm 土层NO3--N 含量维持在54.39~98.48 mg · kg-1,20~40 cm土层NO3--N含量维持在45.25~79.69 mg·kg-1,两土层变异系数分别为25.8%和27.4%(表2)。

表2 肥料袋控缓释对土壤NO3--N含量的影响Table 2 Effect of bag-controlled release fertilizer on soil nitrate nitrogen content(/mg·kg-1)
2.2 肥料袋控缓释对苹果新根生长的影响
由表3可知,3年试验观察到的苹果新根数量以肥料袋控缓释处理最多,其次为撒施处理,不施肥处理最少,各处理3年总和分别为647、482、348 条,肥料袋控缓释处理比撒施处理提高34.2%。2018年、2020年各个观测期内各处理之间差异显著,2019年肥料袋控缓释处理和撒施处理显著高于不施肥处理。由图1可知,各处理均在2018年8月、2019年3月和8月、2020年3月和7月出现生长高峰,7月或8月生长高峰苹果新根数量高于3月份。

表3 肥料袋控缓释对苹果新根数量的影响Table 3 Effect of bag-controlled release fertilizer on number of apple new born root

图1 肥料袋控缓释对苹果新根发生动态的影响Fig.1 Effect of bag-controlled release fertilizer on dynamic of apple new born root
2.3 肥料袋控缓释对苹果新根褐变和寿命的影响
苹果新根颜色的变化反映了苹果根系呼吸、吸收能力的变化。由图2可知,不施肥处理平均根系褐变时间约34 d,撒施处理约41 d,肥料袋控缓释处理约58 d,肥料袋控缓释处理显著高于撒施和不施肥处理。
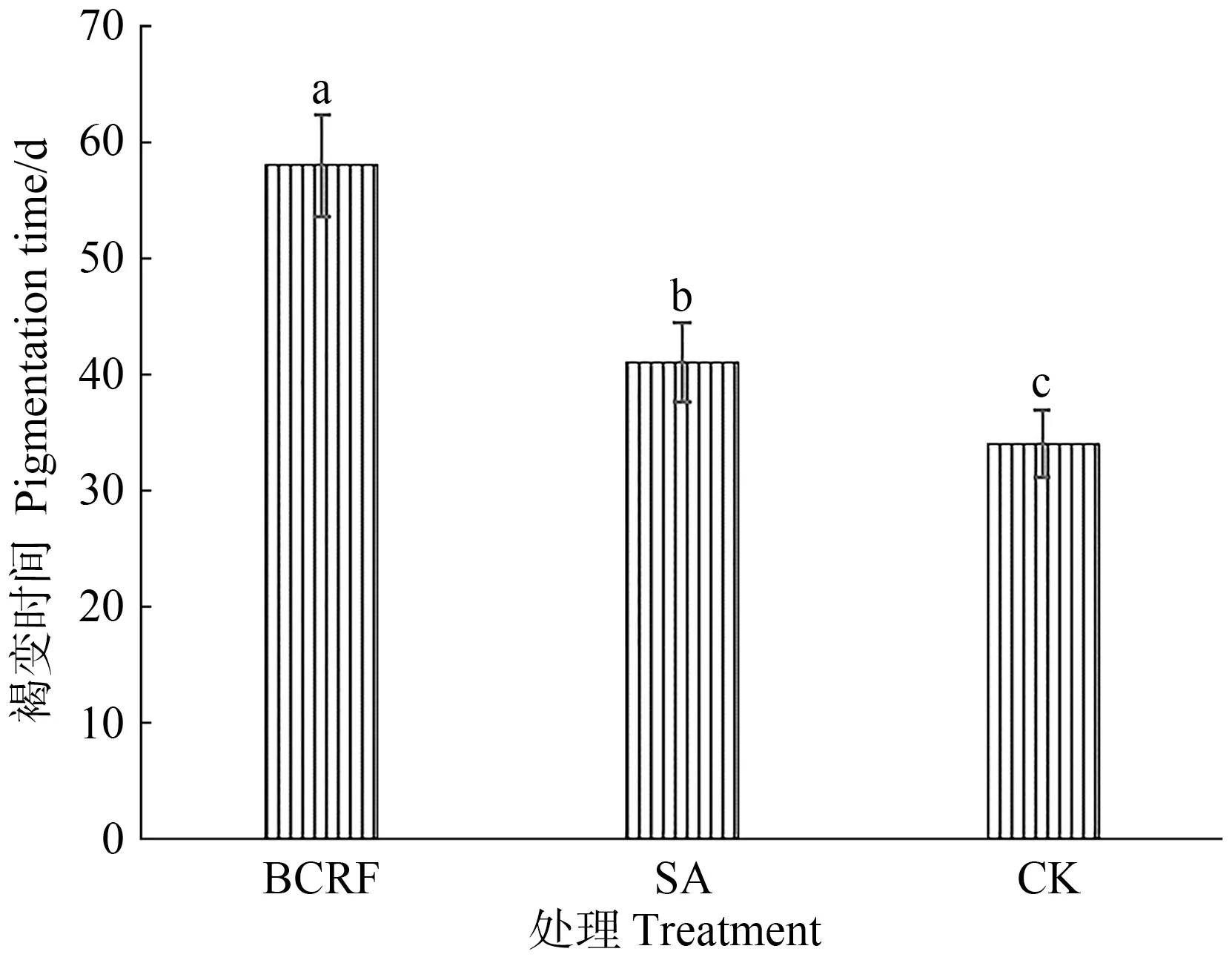
图2 肥料袋控缓释对苹果新根褐变的影响Fig.2 Effect of bag-controlled release fertilizer on the period of time until apple new born root became pigmented
根系中值寿命计算结果表明,肥料袋控缓释处理为224 d,撒施处理为182 d,不施肥处理为142 d,肥料袋控缓释处理显著延长了根系中值寿命(P<0.05)(图3)。

图3 肥料袋控缓释对苹果新根寿命的影响Fig.3 Effect of bag-controlled release fertilizer on survival probability of apple new born root
2.4 肥料袋控缓释对苹果新根现存量和周转率的影响
由图4可知,试验观察期内,肥料袋控缓释处理根系现存量显著高于肥料撒施处理和不施肥处理,2018、2019 和2020年分别为225、90 和102 条,肥料撒施处理3年分别为102、81 和76 条,不施肥处理3年分别为77、57和60条。
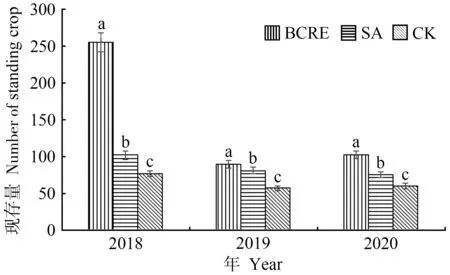
图4 肥料袋控缓释对苹果新根现存量的影响Fig.4 Effect of bag-controlled release fertilizer on standing crop of apple new born root
由表4可知,2018年各处理间根系周转率存在显著差异,各年内数据均以袋控缓释施肥处理最低。2019年、2020年撒施施肥处理和不施肥处理间差异不显著,但显著高于肥料袋控缓释处理。
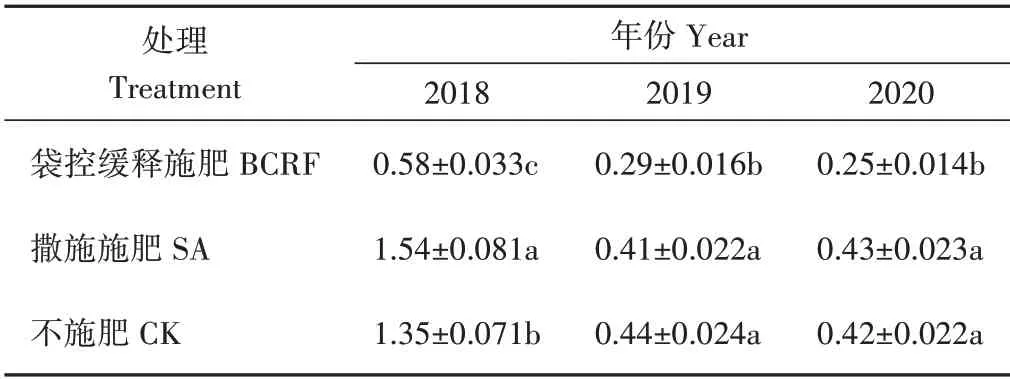
表4 肥料袋控缓释对苹果新根年周转率的影响Table 4 Effect of bag-controlled release fertilizer on annual turnover rate of apple new born root
2.5 肥料袋控缓释对苹果新根根系活力的影响
由图5可知,2018年8月底,肥料袋控缓释处理根系活力达82.54 mg·g-1·h-1,显著高于撒施处理和不施肥处理。11月底各处理间的根系活力均处于较低状态,且各处理间差异不显著。

图5 肥料袋控缓释对苹果新根根系活力的影响Fig.5 Effect of bag-controlled release fertilizer on root activity of apple new born root
2.6 滴灌施肥对苹果氮养分吸收的影响
由表5可知,两处理间细根和一年生枝的干物质量、氮浓度差异显著,肥料袋控缓释处理细根干物质量、细根和一年生枝氮浓度显著高于肥料撒施处理,而一年生枝干物质量显著低于肥料撒施处理。Ndff值表示来源于肥料的氮占总氮的比率,肥料袋控缓释施肥处理各部位Ndff(%)显著高于肥料撒施处理,肥料袋控缓释施肥处理细根、多年生枝和一年生枝Ndff(g)显著高于肥料撒施处理,而粗根、树干Ndff(g)在两处理间差异不显著。肥料袋控缓释处理氮素利用率达到23.00%,显著高于撒施施肥处理(17.08%)。
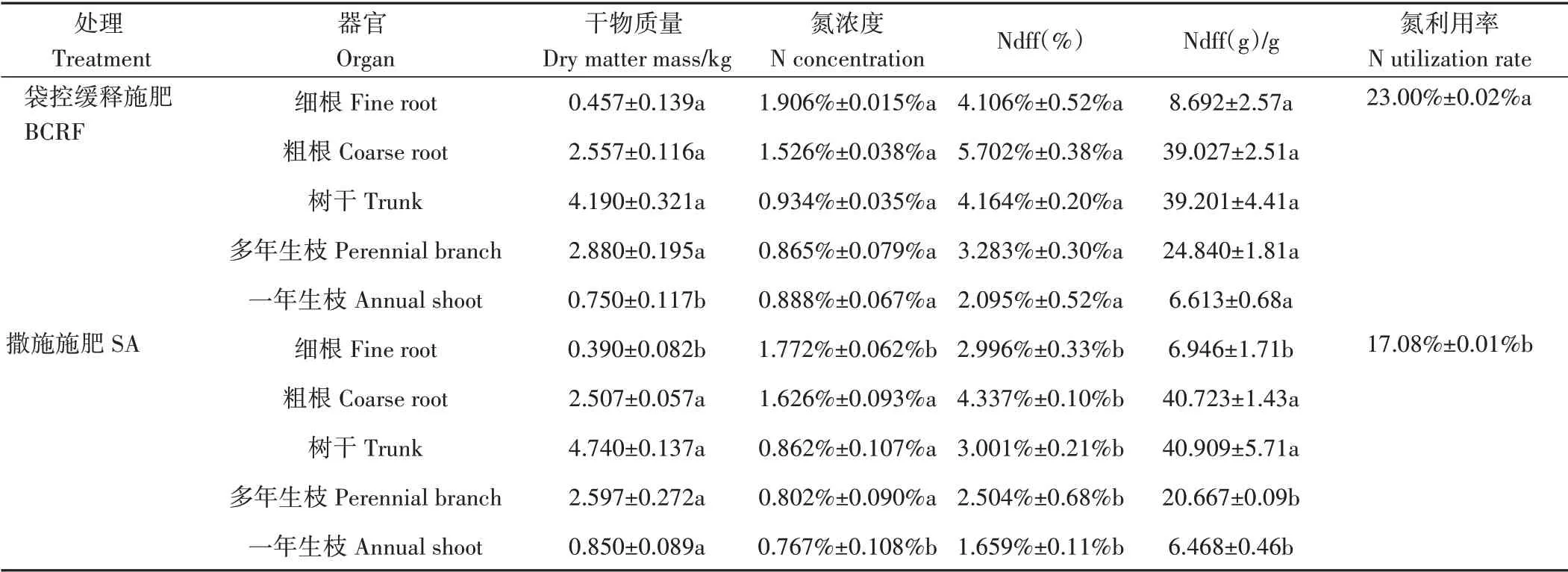
表5 肥料袋控缓释对苹果氮养分吸收的影响Table 5 Effect of bag-controlled release fertilizer on nitrogen utilization rate of apple
3 讨论
苹果生长过程中氮素需求量较大[19],而根系能直接利用的NH4+-N 和NO3--N 在土壤中含量低,需要通过施肥进行补充。传统施肥中果农片面追求高产,肥料用量大,造成果实风味变差、不耐贮运等问题[20],并导致大量肥料随灌溉水进入土壤深层[21]或挥发进入大气而造成环境污染[22]。为解决这些问题,不同类型的缓释肥得到推广应用[3,6]。前人研究表明,传统肥料撒施可以迅速提高土壤中NH4+-N 和NO3--N 含量,但受土壤淋溶、硝化、反硝化等过程影响,土壤中NH4+-N 和NO3--N 含量下降得也很快[4]。本研究土壤Nmin 取样结果证明,撒施施肥处理肥料用量大,氮素变化较大,肥料袋控缓释处理土壤中NH4+-N 和NO3--N 含量波动较小,这与袋控缓释肥在桃树[8]上应用的试验结果一致。
果树根系比农作物分布稀疏,不利于养分高效吸收、利用[5]。新生根吸收能力强,尤其是白色新根,随着根系次生结构的发育逐渐变为褐色。褐色的新根吸收氮的能力和根系呼吸速率均低于白色细根[9]。因此,从提高肥料利用率考虑,应提高新根数量,延长新根褐变时间和寿命。党祝庆等[23]关于桃幼树的研究表明,有机肥、化肥配施较单施化肥有利于增加新根数量和根系生物量,并提高氮素利用率。Baldi等[12]采用微根系原位观测技术研究了有机肥对桃树根系发生、生长的影响,认为施有机肥使土壤NO3--N 含量更加稳定,较化肥撒施提高了新根发生数量和新根生长速率。张亚飞等[6]研究肥料袋控缓释对桃树根系生长影响,认为肥料袋控缓释较肥料沟施施肥土壤养分含量稳定,细根比例高,延长了根系寿命。本试验结果表明,肥料袋控缓释施肥处理新根发生数量最多,这与桃树[24]上采用挖掘法得到的结果一致。增施有机肥条件下,土壤养分浓度相对稳定[12],本试验中肥料袋控缓释施肥处理比撒施施肥处理土壤养分稳定,说明新根增多、新根变褐的时间和寿命延长与肥料袋控缓释施肥土壤养分稳定有关。本研究发现,苹果年生长周期内春季和秋季是新根产生的一个高峰,但各年份之间在时间上有差异,这与Centinari等[25]在葡萄上、An等[26]在苹果上观察到的结果一致。另外,新根产生还受温度、水分、土层等其他因素影响[10、15],各年份间土壤温度,水分等因素差异大。本研究发现,新根产生在年份间变化较大,2018年新根产生较多,2019年和2020年新根产生较少。为避免微根管安装的影响[27],本试验将观察时间比微根管埋置时间推后3 个月。由此推测年份间变化较大的原因可能是随着时间的延长,同一部位产生新根的能力逐渐变弱,新根发生受到影响。
根系现存量指观测期内新根产生量与新根死亡量的差值,新根数量越多,寿命越长,根系现存量越高。本试验中新根年死亡量与新根现存量的比值表示新根年周转率,肥料袋控缓释施肥处理根系现存量显著高于其他处理,新根年周转率显著低于其他处理。相比袋控缓释施肥处理,肥料撒施处理根系因土壤养分浓度不适宜,会造成较多新根死亡[28],进而造成新根现存量降低,新根年周转率显著提高。罗飞雄等[29]研究苹果不同砧木对新根周转的影响,结果表明矮化自根砧新根死亡高峰提前,新根寿命短导致矮化自根砧新根的年周转率高于乔化砧。本试验肥料撒施处理和不施肥处理新根寿命显著低于肥料袋控缓释施肥处理(P<0.05),因此新根年周转率高于肥料袋控缓释施肥处理。
根系活力表征根系吸收能力,王璐等[30]研究多种有机物料混施对苹果幼苗生长、氮素利用及土壤特性的影响,发现多种有机物料混施增加了土壤NH4+-N 和NO3--N含量,提高了苹果根系活力,提升了土壤氮库调节能力。与本研究结果一致,即肥料袋控缓释处理土壤NH4+-N 和NO3--N 含量高,根系活力能够在8月份维持较高水平。
本研究15N示踪试验结果表明,肥料袋控缓释施肥较撒施施肥处理显著提高了各器官Ndf(f%),提高了苹果氮素养分吸收,这与沙建川等[1,4]的研究结果一致。本研究中多年生器官干物质量、氮浓度处理间差异不显著,新生器官干物质量、氮浓度处理间差异显著,主要是因为所用试材为5年生苹果植株,多年生器官在试验期间干物质积累缓慢[31],而一年生器官在试验期间从肥料中吸收的养分较多[32]。本试验结果表明肥料袋控缓释施肥通过改变根系发生、生长影响氮素养分吸收。
4 结论
肥料袋控缓释处理生长季内土壤Nmin 含量波动较小。肥料袋控缓释处理显著提高了苹果新根数量,延长了新根褐变时间以及新根寿命,降低了苹果根系新根年周转率,且在施肥当年效果最为明显,提高了生长季根系活力。肥料袋控缓释处理通过影响土壤养分供应和改变根系生长、发育显著提高了苹果氮素利用率。

