宽体金线蛭不同工艺提取物的抗凝溶栓活性比较研究
何盛盛 王水涛 陈姿亦 徐周熠 朱希忱 徐锦鹏 高有领
(浙江万里学院生物与环境学院,浙江 宁波 315100)
宽体金线蛭(Whitmania pigra)是我国水蛭药材的主要原料,具有抗凝和溶栓的药理作用,临床上常用于治疗心血管疾病[1]。在传统中药中,宽体金线蛭以整体入药,但入药方式存在药力不佳、药效不稳定等局限性,而通过提取可以把药效更好地发挥出来,目前已证实其提取物在抗凝血[1-2]、抗血栓[3]、抗炎[4-5]、抗纤维化[6]和抗肿瘤[7]等方面具有良好的药理作用。
人的凝血过程通常分为内源性凝血途径、外源性凝血途径和共同凝血途径(图1)[8]。凝血因子X 在内源性途径或外源性途径作用下,被激活成为Xa,之后Xa 在Ca2+和因子V 等作用下使凝血酶原转变为凝血酶。凝血酶使可溶纤维蛋白原变成不溶纤维蛋白,再经过聚合、重叠及结合血细胞等凝固成血凝块[8],并在一定条件下,在血管内形成栓子,部分或完全堵塞血管,从而引发栓塞性疾病。近年来,国内外临床使用的治疗血栓栓塞性疾病的药物主要包括抗凝血药物、抗血小板药物和纤维蛋白溶解药物。宽体金线蛭体内含有具有抗凝血作用的物质,已有研究证实其作用途径包括内源性凝血途径、外源性凝血途径和共同凝血途径[9],即通过干扰凝血因子的激活或降低凝血酶活性,抑制血小板聚集和溶解纤维蛋白原等途径实现抗凝溶栓。宽体金线蛭抗凝溶栓的活性物质主要分为两类,一类是具有抗凝血功能的多肽和寡肽[10-15],另外一类是具有纤溶活性的蛋白[16-17]。宽体金线蛭活性成分复杂多样,不同工艺提取的抗凝溶栓活性物质存在差异,且活性物质多为水溶性物质,因此抗凝溶栓活性物质受提取方法的影响。

图1 凝血-抗凝-纤溶系统[8]Fig.1 Coagulation-anticoagulation-fibrinolysis system[8]
宽体金线蛭的活性成分提取方法有多种,包括水提取法[18]、有机溶剂提取法[18]、酶解提取法[19]、浸渍法[20]、渗漉法[21]和湿法超微粉碎法[22]等。其中有机溶剂提取有毒且提取率低;水提取不利于大规模的生产,提取过程中土腥味较重[23]。而酶解提取法主要模仿人体消化生理过程,即大分子物质在胃肠道酸性、碱性环境和消化酶共同作用下,酶解成小分子肽、低聚糖和其他小分子物质[24],得到的提取物中尽可能多地保留了原材料的有效成分[25]。尽管有研究证实了宽体金线蛭水提醇沉法优于醇提水沉法和丙酮醇沉法[26],但另有研究报道仿生提取物比水提取物具有更好的体外溶栓活性[27],并进一步分析了仿生酶解液的核苷特征图谱和肽特征图谱[28]。虽然目前针对宽体金线蛭的提取工艺已有相关研究,但这些研究内容仅限于少数几种提取工艺,且检测指标较为单一,并不能全面比较和评价不同工艺提取物的抗凝溶栓作用。因此,本试验通过分析不同工艺提取物的抗凝活性、纤溶活性与体外溶栓活性等指标差异,对各提取工艺进行较为全面的评价,并筛选合适的提取工艺,旨在为宽体金线蛭抗凝溶栓药物研究提供参考。
1 材料与方法
1.1 材料和试剂
采用市售的蚂蟥,经浙江中医药大学斯越秀副教授鉴定为宽体金线蛭(Whitmania pigra)的干燥体,粉碎后过50 目筛。试验采用的主要试剂包括胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250)、α-淀粉酶(1∶3 700)、脂肪酶(1∶20 000)、碱性蛋白酶(1∶200 000)、牛纤维蛋白原和凝血酶(1∶1 000)、彩虹245 plus广谱蛋白Marker,北京索莱宝科技有限公司。活化部分凝血活酶时间(activated partial thromboplastin time,APTT)试剂盒、凝血酶原时间(prothrombin time,PT)试剂盒和凝血酶时间(thrombin time,TT)试剂盒均购于上海太阳生物技术有限公司。配制人工胃液时,取盐酸9 mL,加蒸馏水稀释至1 000 mL,配制人工肠液时,取0.2 mol·L-1磷酸二氢钾溶液250 mL,加入0.2 mol·L-1氢氧化钠溶液118 mL,之后用水稀释至1 000 mL。其余试剂均为分析纯。
1.2 主要仪器和设备
Alpha 1-4 LSCplus 冷冻干燥机,德国CHRIST 公司;WH220-HT 恒温加热磁力搅拌器,德国WIGGENS公司;Centrifuge 5804R 高速离心机,美国EPPENDORF公司;SHZ-DⅢ抽滤机,台州博奥真空设备有限公司;S210 pH 计,瑞士METTLER TOLEDO 公司;WIXminiPRO4 垂直电泳、Gel Dcode XR+凝胶成像系统,美国BIO-RAD 公司;DHG-9240A 烘箱,上海精宏实验设备有限公司。
1.3 宽体金线蛭不同工艺提取物的制备
宽体金线蛭提取物的制备参考李濯冰等[23]和单宇等[29]的方法并略做改进。
1.3.1 水提取法 取样品粗粉1.0 g,按1∶20(W∶V)加入去离子水,于室温磁力搅拌5 h,以8 000 r·min-1离心20 min,取上清液,经过抽滤、冻干得到水提物,保存备用。
1.3.2 酸提取法 取样品粗粉1.0 g,按1∶20(W∶V)加入人工胃液,于室温磁力搅拌5 h,以8 000 r·min-1离心20 min,取上清液,经过抽滤、冻干得到酸提物,保存备用。
1.3.3 胃蛋白酶酶解工艺 取样品粗粉1.0 g,按1∶20(W∶V)加入人工胃液,于40 ℃水浴处理30 min,然后加入6.67%的胃蛋白酶,磁力搅拌作用5 h后,将酶解液置于85 ℃水浴处理15 min,冷却至室温后,以8 000 r·min-1离心20 min,取上清液,经过抽滤、冻干即得胃蛋白酶酶解物,保存备用。
1.3.4 胰蛋白酶酶解工艺 取样品粗粉1.0 g,按1∶20(W∶V)加入人工肠液,于50 ℃水浴处理30 min 后加入酶底比为4%的胰蛋白酶,磁力搅拌作用5 h 后,将酶解液置于85 ℃恒温水浴15 min,冷却至室温后,以8 000 r·min-1离心20 min。取上清液,经过抽滤、冻干即得胰蛋白酶酶解物,保存备用。
1.3.5 仿生酶解工艺 取样品粗粉1.0 g,按1∶20(W∶V)加入人工胃液,于37 ℃水浴处理30 min。加入酶底比4.17%的胃蛋白酶并搅拌均匀,置于37℃恒温磁力搅拌器中搅拌3 h;用浓度为1 mol·L-1的NaOH 溶液调节pH 值至6.80,再加入酶底比7.5%的胰蛋白酶,搅拌均匀,37 ℃条件下磁力搅拌2 h;取出样品85 ℃水浴灭活15 min,冷却至室温。以8 000 r·min-1离心20 min,分取上清液,经过抽滤、冻干即得仿生酶解物,保存备用。
1.3.6 粗酶酶解工艺 取样品粗粉1.0 g 加至20 mL去离子水中,溶液预热至50 ℃,作用30 min,加入pH值为8.5 的Tris-HCl 缓冲液,然后用1 mol·L-1NaOH调节pH 值至8.5,并加入粗酶(碱性蛋白酶、脂肪酶、α-淀粉酶酶活力比为1∶1∶1,总酶活为20 000 U),在50 ℃下继续酶解5 h。将酶解液置于85 ℃恒温水浴作用15 min,冷却至室温。以8 000 r·min-1离心20 min,分取上清液,经过抽滤、冻干即得粗酶酶解物,保存备用。
1.3.7 脱脂工艺 取适量的宽体金线蛭粉,按1∶5(W∶V)加入石油醚进行脱脂除杂,搅拌均匀后,封上封口膜,放于4 ℃静置1 h。倾倒上清液,重复上述步骤。脱脂除杂2 h后,倾倒上清液,放于通风橱约30 min,挥干其余残渣,期间每10 min 搅拌一次,使其充分挥发。后续按上述工艺提取,为脱脂提取物。其中脱脂水提和脱脂酸提的提取温度为37 ℃,脱脂加热水提和脱脂加热酸提的提取温度为50 ℃。
1.4 蛋白含量的测定
采用双缩脲比色法测定总蛋白含量。取1.5 g 硫酸铜和6.0 g 酒石酸钾钠溶于500 mL 蒸馏水中,再加入300 mL 10% NaOH 溶液,加水定容至1 000 mL。之后取一系列试管,分别加入牛血清白蛋白标准溶液(5 mg·mL-1)0、0.4、0.6、0.8、1.2、1.6 mL,用蒸馏水补足至2 mL,分别加入4 mL 双缩脲试剂,室温静置30 min,以未加蛋白溶液的试管作为空白对照组,置于540 nm 波长下比色,测得吸光度值为0、0.124、0.182、0.240、0.360、0.458。以吸光度(y)为纵坐标,牛血清白蛋白含量(x)为横坐标,绘制标准曲线,得线性方程y=0.058 7x(R2=0.997 8)。精确量取各组提取液500µL,稀释至1 mL,加水补充至2 mL,加入双缩脲试剂4 mL,摇匀,室温放置30 min于540 nm波长处比色,以空白管(2 mL 蒸馏水+4 mL 双缩脲试剂)调零点,重复3 次测定各组吸光度,进而计算不同提取物中总蛋白的含量。
1.5 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)
取宽体金线蛭提取物0.05 g 溶于生理盐水1 mL中配置成0.05 g·mL-1供试液。取供试液80µL,与5×蛋白上样缓冲液20µL 配置成100µL 上样液,于95 ℃水浴锅中加热15 min,备用。配制凝胶厚度为1.00 mm,12%分离胶和5%浓缩胶,取上述各组样品和蛋白Marker 上样。80 V 电泳至分离胶约15 min 后,改为100 V 电泳至凝胶底部结束。电泳后,切除凝胶多余部分,利用考马斯亮蓝染液染色1 h,用2 次脱色液洗脱凝胶各2 h,脱色至条带清晰,凝胶成像系统进行扫描,保存图像。
1.6 抗凝血酶活性(antithrombin activity,AT)测定
按照《中华人民共和国药典》[30]中的凝血酶滴定法进行测定,取不同工艺提取物0.05 g 溶于1 mL 生理盐水中配置成0.05 g·mL-1供试液,其中胃蛋白酶酶解物、脱脂胃蛋白酶酶解物均为0.01 g·mL-1供试液,以0.9%生理盐水为对照组,重复测定3 次。取供试液100 µL,加入含0.5%牛纤维蛋白原的Tris-HCl 溶液200 µL 于试管中,摇匀,置水浴(37 ℃)中缓慢滴加10 U·mL-1凝血酶溶液,每分钟加1 次,每次加5µL,滴加后将其不断搅拌,直至试管内溶液凝固或拉丝,记录消耗凝血酶溶液的体积,平行测定3 次,并按下式计算凝血酶活性:

式中,U 为每1 g含凝血酶活性单位,U·g-1;C1为凝血酶溶液的浓度,U·mL-1;V1为消耗凝血酶溶液的体积,µL;C2为供试品溶液的浓度,g·mL-1;V2为供试液加入量,µL。
1.7 不同凝血途径的抗凝活性测定
1.7.1 血浆的制备 选用健康的兔,颈动脉取血于无菌离心管中,并与3.8%枸橼酸钠抗凝液(1∶9)混匀。3 500 r·min-1离心15 min,取上清液,分离出新鲜的贫血小板血浆(platelet-poor plasma,PPP)于无菌离心管。
1.7.2 活化部分凝血活酶时间测定(APTT) 活化部分凝血活酶时间(APTT)反映了凝血内源性途径,采用试剂盒进行测定。取50 µL PPP 于无菌离心管中,加入50 µL 供试液,再加入50 µL APTT 试剂,37 ℃孵育5 min,再加入50 µL 0.025 mol·L-1CaCl2溶液,并用移液枪不停搅拌,直到拉丝或者凝固,记录时间。以生理盐水为空白对照。
1.7.3 凝血酶原时间测定(PT) 凝血酶原时间(PT)反映了凝血外源性途径,采用试剂盒进行测定。取50µL PPP 于无菌离心管中,加入50 µL 供试液,37 ℃孵育3 min,再加入100µL PT试剂,并用移液枪不停搅拌,直到拉丝或者凝固,记录时间。以生理盐水为空白对照。
1.7.4 凝血酶时间测定(TT) 凝血酶时间(TT)反映了凝血共同途径,采用试剂盒进行测定。取50µL PPP于无菌离心管中,加入50µL 供试液,37 ℃孵育3 min,再加入50 µL TT 试剂,并用移液枪不停搅拌,直到拉丝或者凝固,记录时间。以生理盐水为空白对照。
1.8 纤溶活性测定
基于谭赫等[27]的方法进行改进,并制作纤维蛋白原平板和纤维蛋白平板。
1.8.1 纤维蛋白原平板 用pH 值为7.4 的磷酸缓冲盐溶液(phosphate buffer saline,PBS)配制2%的琼脂溶液,加热使其完全融化,待冷却至75 ℃左右,取20 mL琼脂溶液与10 mL 用pH 值7.4 的PBS 缓冲液配制的0.1%的纤维蛋白原溶液混合,搅拌均匀后立即倒入灭菌后的培养皿(直径9 cm)中,轻轻摇匀,冷却静置约30 min 至琼脂完全凝固后,打出直径为8 mm 的孔,打孔后将孔中液体吸出,备用[27]。
1.8.2 纤维蛋白平板 用pH 值为7.4 的PBS 缓冲液配制1%的琼脂溶液,加热使其完全融化,待冷却至75 ℃左右,取20 mL 琼脂溶液与8 mL 用pH 值7.4 的PBS缓冲液配制的0.5%的纤维蛋白原溶液混合,再加入1 mL 10 U·mL-1的凝血酶溶液混匀,搅拌均匀后立即倒入灭菌后的培养皿(直径9 cm)中,轻轻摇匀,冷却静置约30 min至琼脂完全凝固后,打出直径为8 mm的孔,打孔后将孔中液体吸出,备用[27]。
1.8.3 纤溶活性 各组样品供试液,均以0.05 g·mL-1样品供试液每个孔加样100 µL 进行纤维蛋白原平板试验和纤维蛋白平板试验,生理盐水为对照,重复3 次。将平板置于37 ℃培养箱内培养20 h,结束后取出平板。纤溶活性溶解圈面积计算方法如下:

1.9 动物体外溶栓活性测定
参考谭赫等[27]的方法,从动物的颈动脉取血于50 mL 灭菌试管,置于4 ℃环境自然凝血5 h,体外制成血栓(血凝块),将其均分,每块为0.2 g,用生理盐水漂洗,除去血凝块表面粘附的血细胞和杂质,烘干血凝块并称重(W1)。将血凝块分别放入各个3 mL 供试液样品中,生理盐水为对照,置于37 ℃恒温孵育36 h,之后取出血凝块,用生理盐水反复漂洗,烘干称重(W2),各个组重复3 次。其中,中华鳖血试验供试液浓度为0.01 g·mL-1,新西兰兔血试验供试液浓度为0.02 g·mL-1。血凝块溶解率计算方法如下:
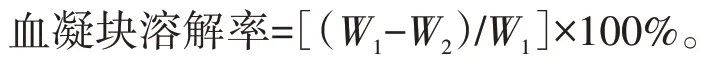
1.10 脱脂胃蛋白酶酶解提取物不同组分的抗凝纤溶活性测定
取脱脂胃蛋白酶酶解液,用10 kDa 和3 kDa 的超滤离心管进行离心过滤,得到10 kDa 和3 kDa 膜的过滤物和截留物;再对10 kDa 的过滤物用3 kDa 膜进行过滤,得到相应过滤物和截留物。冷冻干燥后,称取适量的组分配成相应浓度的溶液,进行抗凝活性和纤溶活性测定。
1.11 提取物对纤维蛋白原的作用
取提取物(0.05 g·mL-1)0.2 mL,对照组0.9%生理盐水,分别加入0.2 mL 0.5%纤维蛋白原溶液(纤维蛋白原溶于pH 值7.4 的Tris-HCl 缓冲液),置于37 ℃反应1 h,4 ℃、15 000 r·min-1离心10 min,取适量上层溶液制成待测样品。对样品进行SDS-PAGE电泳检测。
1.12 统计分析
采用SPSS 22.0 软件对试验结果进行单因素方差分析(one-way ANOVA),用Duncan 检验法进行多重比较,统计结果以平均值±标准差表示。
2 结果与分析
2.1 蛋白含量
由表1可知,仿生酶解提取液中蛋白含量显著高于其他工艺提取液,水提提取液和脱脂水提提取液的蛋白含量显著低于其他提取液。

表1 宽体金线蛭提取物的蛋白含量Table 1 Protein content of the extract from W.pigra/(mg·mL-1)
2.2 聚丙烯酰胺凝胶电泳(SDS-PAGE)
由图2可知,水提提取物和酸提提取物均存在大分子和小分子物质。由图3可知,粗酶酶解提取物和胰蛋白酶酶解提取物仍有少量的大分子物质以及大部分小分子物质。而胃蛋白酶酶解和仿生酶解已将大分子物质酶解为小分子物质,脱脂预处理并未影响提取物的蛋白分布。

图2 水提组和酸提组的提取物SDS-PAGE结果Fig.2 SDS-PAGE result of water extracts and acid extracts
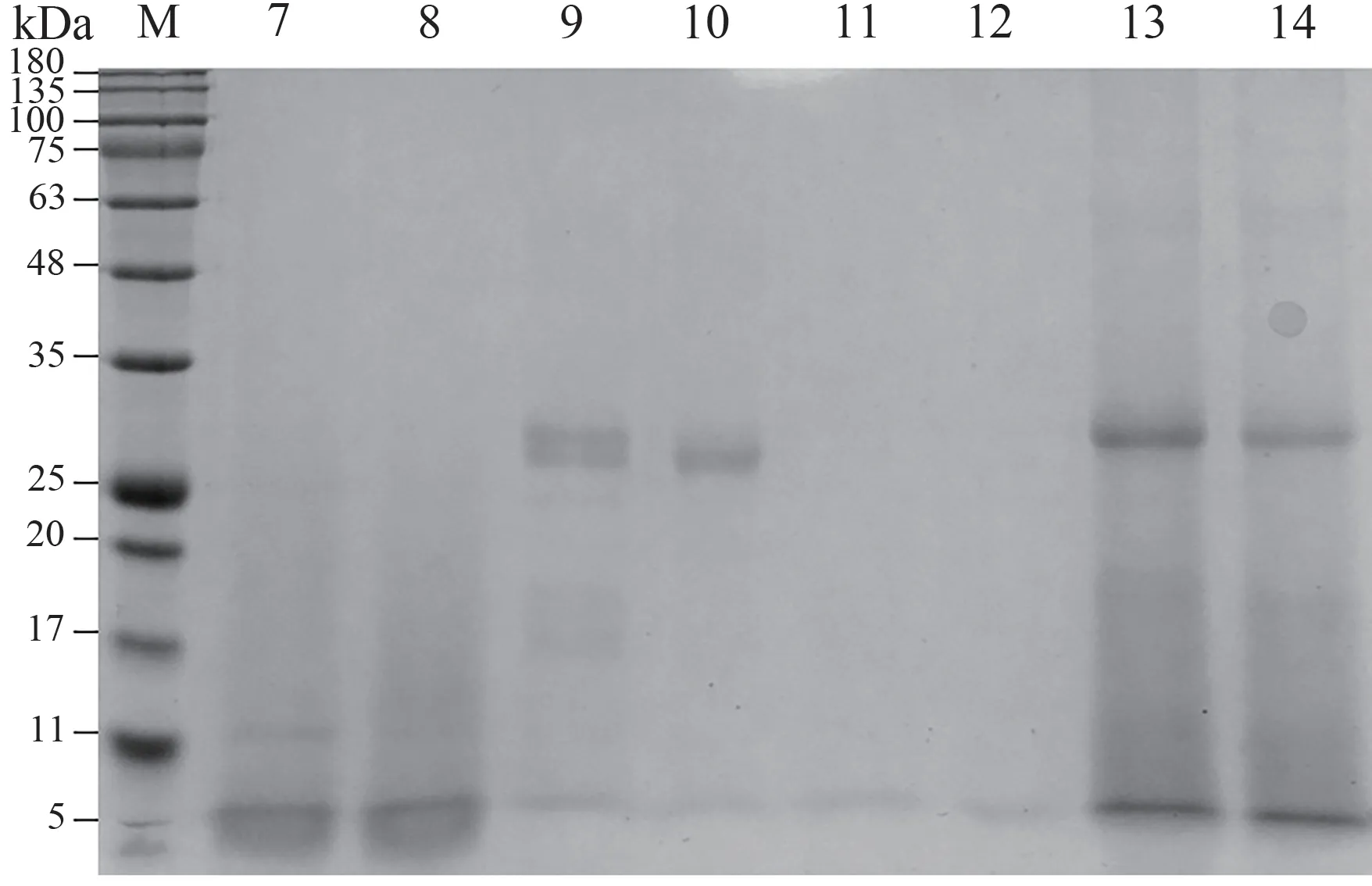
图3 酶解提取物的SDS-PAGE结果Fig.3 SDS-PAGE result of enzymatic hydrolysis extract
2.3 抗凝血酶活性(AT)
由表2可知,脱脂胃蛋白酶酶解提取物的AT 显著高于其他工艺提取物,胃蛋白酶、胰蛋白酶和仿生酶解提取物的抗凝血酶活性相近。胃蛋白酶酶解提取物与脱脂胃蛋白酶酶解提取物的APTT和TT显著高于其他工艺提取物。脱脂加热酸提和胃蛋白酶酶解提取物的PT 显著高于其他工艺提取物。此外,由于酸提提取物pH值过低,无法进行AT测定。
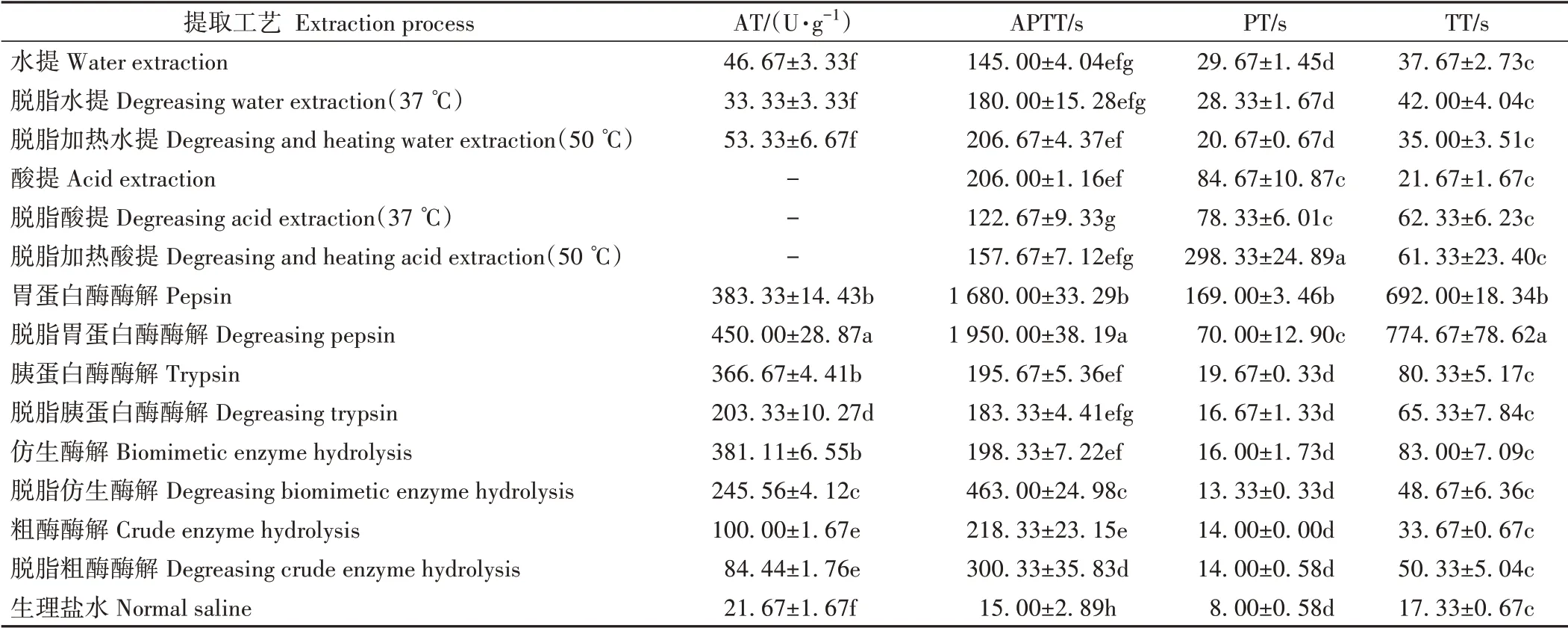
表2 宽体金线蛭提取物的抗凝活性Table 2 The anticoagulant activity of the extracts of W. pigra
2.4 纤溶活性
2.4.1 宽体金线蛭提取物对纤维蛋白原的纤溶活性 由表3可知,在相同剂量下(0.05 g·mL-1),只有酸提组和胃蛋白酶酶解组有纤溶活性,且酸提组的纤溶活性显著高于胃蛋白酶酶解组。

表3 宽体金线蛭提取物的纤溶活性(纤维蛋白原)Table 3 Fibrinolytic activity(fibrinogen)of the extracts of W. pigra/mm2
2.4.2 相同生药材在不同工艺下宽体金线蛭提取物的纤溶活性 采用相同生药材量(0.1 g)的前提下,根据提取质量计算提取物配置相应的供试液,结果表明,胃蛋白酶酶解组提取物的纤溶活性显著高于酸提组提取物(表4)。
2.4.3 宽体金线蛭提取物对纤维蛋白的纤溶活性 由表5可知,在相同剂量下,脱脂加热水提物和脱脂仿生酶解物的纤溶活性显著高于其他提取工艺提取物,脱脂胃蛋白酶酶解物次之。

表5 宽体金线蛭提取物的纤溶活性(纤维蛋白)Table 5 Fibrinolytic activity(fibrin)of the extracts of W. pigra/mm2
2.5 体外溶栓试验
由表6可知,采用中华鳖血构建体外血栓模型,在相同剂量下,脱脂胃蛋白酶酶解、水提、脱脂水提、脱脂加热水提、仿生酶解、脱脂仿生酶解和脱脂粗酶酶解提取物的血凝块溶解率显著高于酸提、脱脂酸提和脱脂加热酸提提取物,其中,脱脂胃蛋白酶酶解提取物的血凝块溶解率最高,脱脂酸提提取物最低。采用新西兰兔血构建体外血栓模型,在相同剂量下,脱脂加热水提、脱脂水提提取物的血凝块溶解率显著高于酸提、脱脂酸提、脱脂加热酸提、胃蛋白酶酶解、脱脂胃蛋白酶酶解、脱脂仿生酶解和粗酶酶解提取物。其中脱脂加热水提提取物的血凝块溶解率最高,脱脂水提提取物次之。

表6 宽体金线蛭提取物的体外溶栓活性Table 6 In vitro thrombolytic activity of the extracts of W. pigra
2.6 脱脂胃蛋白酶酶解物不同组分的抗凝活性和纤溶活性
2.6.1 脱脂胃蛋白酶酶解物不同组分的抗凝活性 由表7可知,分子量小于3 kDa 的组分AT 显著高于其他组分,大于10 kDa、大于3 kDa 的组分显著延长了兔的ATPP,不同组分对兔的PT和TT无显著影响。

表7 脱脂胃蛋白酶酶解物不同分子量组分抗凝活性比较Table 7 Comparison of anticoagulant activity of different molecular weight components in degreasing pepsin hydrolysate
2.6.2 脱脂胃蛋白酶酶解物不同组分的纤溶活性 由表8可知,通过测定脱脂胃蛋白酶酶解提取物不同组分的纤溶活性(0.1 g·mL-1)发现,分子量小于3 kDa的成分纤溶活性显著高于分子量大于3 kDa 和10 kDa的成分,且显著高于脱脂胃蛋白酶酶解物本身。
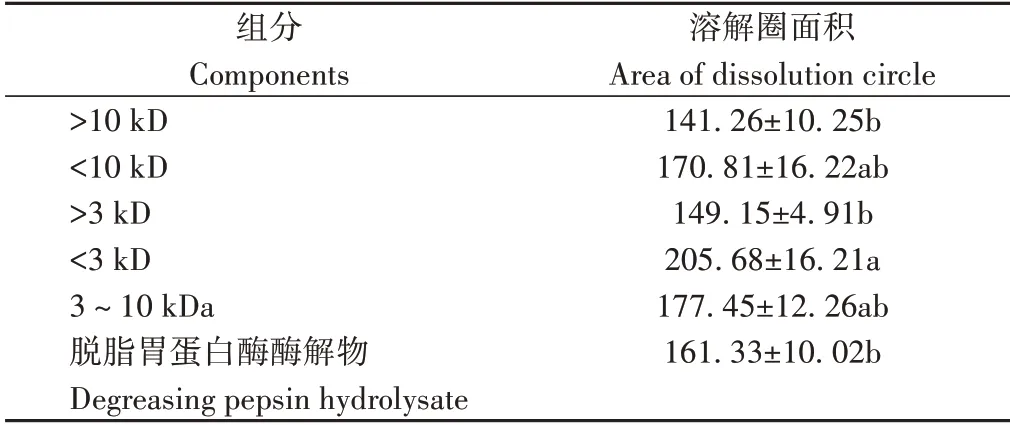
表8 脱脂胃蛋白酶酶解物不同分子量组分纤溶活性比较(纤维蛋白)Table 8 Comparison of fibrinolytic activity of different molecular weight components in degreasing pepsin hydrolysate(fibrin)/mm2
2.7 不同提取物对纤维蛋白原的作用
由图4~7可知,水提提取物、脱脂水提提取物和脱脂加热水提提取物均对纤维蛋白原的α肽链有溶解作用,但对纤维蛋白原β、γ 肽链无溶解作用。酸提提取物、脱脂酸提提取物和脱脂加热酸提提取物对纤维蛋白原α、β、γ 肽链均无溶解作用。胃蛋白酶酶解物、脱脂胃蛋白酶酶解物、胰蛋白酶酶解物和脱脂胰蛋白酶酶解物对纤维蛋白原α、β、γ 肽链均无溶解作用。仿生酶解物和脱脂仿生酶解物对纤维蛋白原的α、β肽链有溶解作用,但对纤维蛋白原γ肽链无溶解作用,粗酶酶解物对纤维蛋白原的α 肽链有溶解作用,但对纤维蛋白原β、γ肽链无溶解作用。
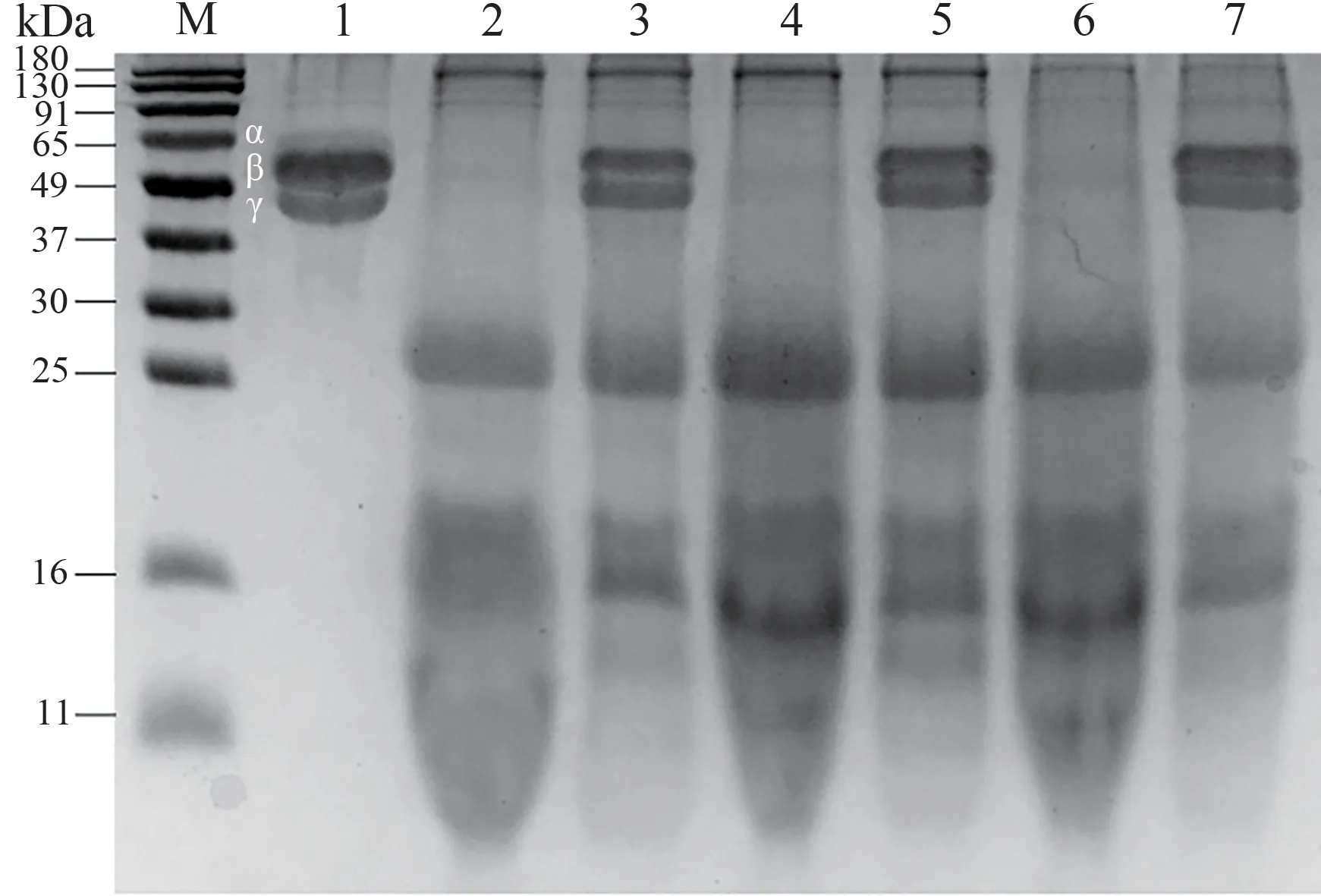
图4 水提提取物对纤维蛋白原的作用Fig.4 Effect of water extract on fibrinogen
3 讨论
本研究发现,不同提取工艺的宽体金线蛭提取物均具有抗凝活性,且对凝血的各个途径均有所影响。其中脱脂胃蛋白酶酶解、胃蛋白酶酶解、胰蛋白酶酶解和仿生酶解提取物的抗凝活性高于其他工艺提取物。该结果与李濯冰等[23]的研究结果类似,即柳叶蚂蟥的胃蛋白酶酶解提取物具有较强的抗凝血活性,可明显延长大鼠的凝血内源性途径。本试验中胃蛋白酶酶解提取物和脱脂胃蛋白酶酶解提取物的APTT和TT指标显著高于其他提取物,APTT 反映了凝血内源性途径,TT 反映了凝血共同途径,说明这两种提取物通过内源性途径干扰凝血因子的激活,或者经共同途径抑制凝血酶的活性。另外,纤维蛋白原肽链N 末端的纤维肽A 和B 均为酸性肽,带较多负电荷,在未凝血时由于同性电荷的排斥作用阻碍纤维蛋白原之间的聚合[8]。而胃蛋白酶酶解提取物和脱脂胃蛋白酶酶解提取物呈酸性,可能增强了纤维蛋白原之间同性电荷的排斥作用,从而促进了抗凝血作用。除此以外,酸性过强也会导致凝血酶失活,并使纤维蛋白原变性,析出白色沉淀,之后再加入凝血酶也不具有凝固作用[9]。SDS-PAGE结果表明,胃蛋白酶解和仿生酶解之后的提取物中含有更多的小分子多肽,该提取物的抗凝血酶活性显著高于其他提取物,表明小分子多肽对于抑制凝血酶活性具有重要作用。

图5 酸提提取物对纤维蛋白原的作用Fig.5 Effect of acid extract on fibrinogen
从纤溶活性结果可知,除胰蛋白酶酶解提取物外,不同工艺的提取物均具有纤溶活性。酸提提取物和胃蛋白酶酶解提取物可能与纤溶酶作用类似[27],也可能是提取物较强的酸性溶解了纤维蛋白原和纤维蛋白。水提组、仿生酶解组和粗酶酶解的提取物对纤维蛋白原的α 肽链有直接溶解作用,但对纤维蛋白原平板无纤溶作用,这一现象与谭赫等[27]的研究结果相一致。
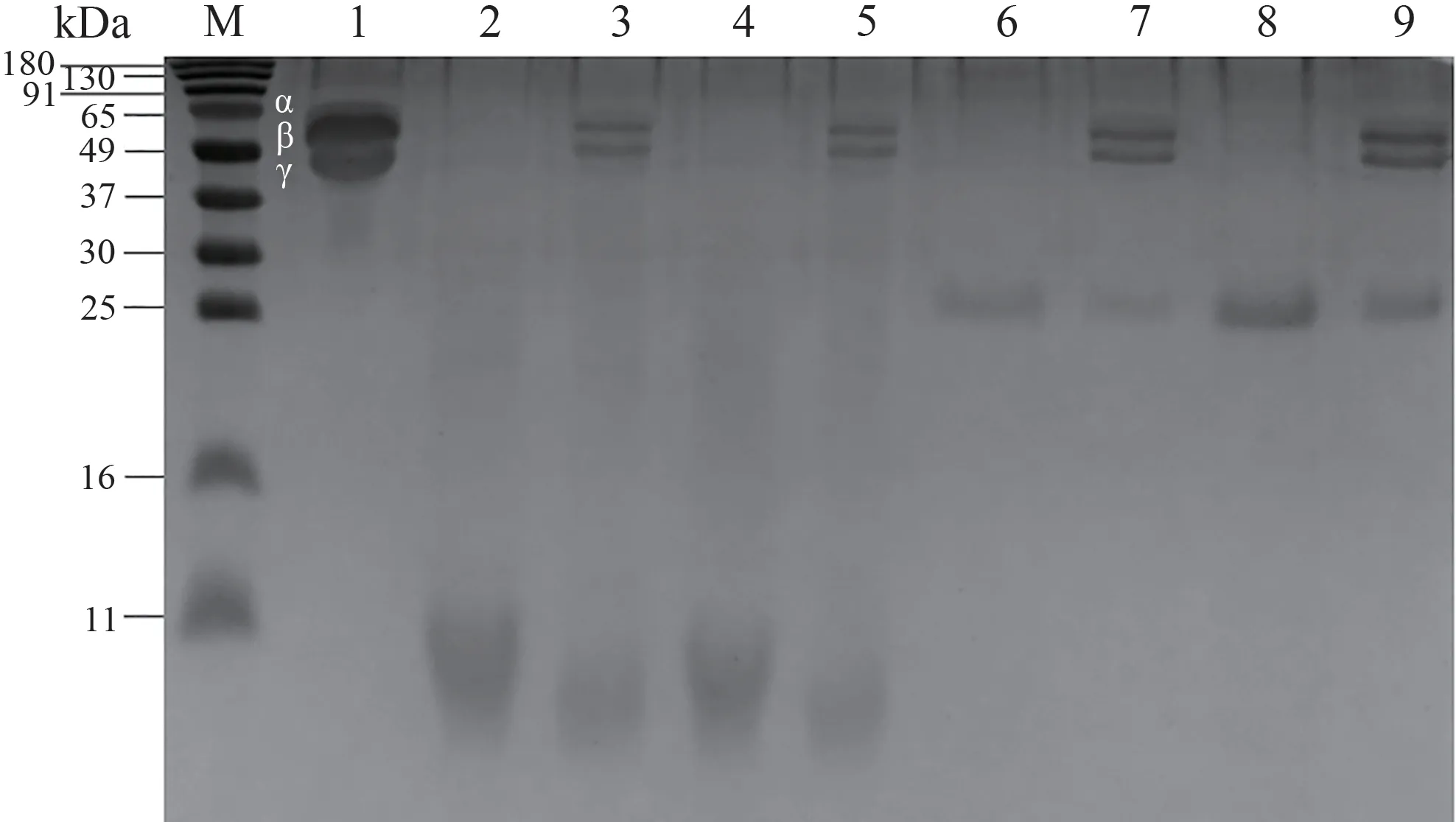
图6 胃蛋白酶酶解物、胰蛋白酶酶解物对纤维蛋白原的作用Fig.6 Effect of pepsin hydrolysate and trypsin hydrolysate on fibrinogen

图7 仿生酶解酶解物、粗酶酶解酶解物对纤维蛋白原的作用Fig.7 Effect of biomimetic enzymatic hydrolysate and crude enzymatic hydrolysate on fibrinogen
相对其他提取物,水提、脱脂水提、脱脂加热水提、仿生酶解和脱脂仿生酶解提取物均表现出较强的体外溶栓活性,这与提取物对纤维蛋白的纤溶活性结果相一致。原因可能是脱脂提高了蛋白活性物质的水解作用,在水解或酶解作用下释放更多活性物质。胰蛋白酶酶解组的溶栓活性可能通过抗凝血活性实现,而酸提组和胃蛋白酶酶解组的提取物可能通过抗凝血活性和类似纤溶酶的纤溶活性作用来溶解血栓。
动物类药材发挥作用的主要成分为小分子肽类[31]。本试验发现脱脂胃蛋白酶酶解提取物的不同分子量成分均有抗凝纤溶活性,表明具有抗凝纤溶的成分并非是单一的物质。通过分析指标抗凝活性(AT),发现分子量小于3 kDa的组分AT值最大,纤溶活性结果也与AT保持一致。这与丁月珠等[32]关于胰蛋白酶酶解物的研究结果并不一致,该结果表明大于10 kDa的组分具有较好的抗凝活性,且主要对共同凝血途径起作用。不相一致的原因较复杂,可能受到酶的种类和酶的用量影响。要明确分子量小于3 kDa 的组分的抗凝溶栓机制,则需进一步分离纯化。此外,本试验中大于10 kDa 的组分APTT 值最大,预示着该组分主要对内源性凝血途径起作用。
本试验中水提提取物、脱脂水提提取物和脱脂加热水提提取物对纤维蛋白原的α 肽链具有溶解作用,但对β 和γ 链作用相对较弱。这与朱正光等[33]的研究结果相一致,该研究表明宽体金线蛭的水煎液可以水解纤维蛋白原,且主要以α肽链为主。
4 结论
本试验结果表明,宽体金线蛭的不同工艺提取物均具有抗凝溶栓的药理作用,酶解提取物优于水提提取物和酸提提取物,脱脂处理有利于活性物质的提取,其中胃蛋白酶酶解提取物效果最佳,并且脱脂胃蛋白酶酶解物小分子多肽成分具有最佳的抗凝血酶活性和纤溶活性。本试验结果为进一步开发利用宽体金线蛭的药理作用提供了理论依据。

