miR-141对股骨头坏死骨髓间质干细胞活性及VEGF/TGF-β2蛋白的影响
田楠楠, 冯蜜亚
(1.河北省衡水市人民医院, 河北 衡 水 0530002.河北医科大学第三医院, 河北 石家庄 050000)
股骨头坏死 ( osteonecrosis of femoral head,ON- FH) 为临床骨科常见疾病,是股骨头血供不足导致骨细胞死亡,股骨头微结构改变碍的疾病[1]。ON- FH具有致残性,多发于中青年,发病原因与创伤骨折、激素性及酒精性相关[2]。人骨髓间充质干细胞 ( human bone marrow mesenchymal stem cells, hMSCs) 是具有分化潜力的干细胞 可分化成多种细胞,例如成骨细胞及软骨细胞等[3]。相关研究证实,在激素性股骨头坏死中存在hMSCs活性异常,主要为股骨中出现hMSCs活性降低[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是具有促血管生成的作用,已经应用于血管化组织工程的研究中已经取得了较好效果,但是与股骨头坏死关联还需要进一步研究[5]。转化生长因子-β2(Transforming growth factor,TGF-β2)属于成骨细胞趋化因子,当出现TGF-β2缺失后会出现严重骨缺失。现有研究通过慢病毒将TGF-β2过表达转染至干细胞内能够有效改善骨缺损[6]。微小RNA(microRNA,miRNA)是长度约22nt的非编码RNA,可发挥基因调控、细胞生物学行为具有重要调节作用。微小RNA-141(miR-141)属于其中成员之一,在骨组织修复及成骨细胞活性中存在关联,并经文献证实在激素性股骨头坏死中表达升高[7]。本文通过探讨miR-141对股骨头坏死骨髓间质干细胞活性及VEGF/TGF-β2蛋白的影响,为股骨头坏死的临床治疗提供方向。
1 材料与方法
1.1标本采集及细胞提取:选取2020年4月至2021年4月期间进行全髋关节置换术的18例激素性股骨头坏死患者及10例股骨颈骨折患者,均自愿参与并签署知情同意书及经我院伦理委员会批准。股骨头坏死患者术前符合宾夕法尼亚大学分期IV~VI分期,所有患者均无感染病史,激素性股骨头坏死患者均采用糖皮质激素治疗超过4周,于无菌条件下进行全髋关节置换手术过程中,提前用肝素处理注射器,手术过程中均抽取骨髓约5mL,放入抗凝的离心观众制成细胞悬液。细胞培养:将细胞悬液加入等体积的淋巴细胞分离液共放入离心管中,3000r/min(离心半径10cm)下分离10min,将离心管底部白膜层的单个核细胞放置另一个离心管中,弃上清液,用含15%的胎牛血清的DMEM完全培养基重悬细胞,细胞浓度为1×106/mL接种于培养瓶中在饱和湿度,5%的CO2及37℃中培养。
1.2主要试剂与仪器:试剂:DMEM高糖培养基购自中国上海微科生物有限公司;胎牛血清、0.25%胰蛋白酶均购自中国上海素尔生物科技有限公司;噻唑蓝MTT试剂、二甲基亚砜(DMSO)试剂均购自北京索莱宝科技有限公司;干细胞表面抗原CD44、CD45、CD13、CD14抗原均购自北京汇智泰康医药技术有限公司;鼠抗人GAPDH单克隆抗体、鼠抗人VEGF单克隆抗体、兔抗人TGF-β2单克隆抗体均购自中国上海圻明生物科技有限公司;山羊抗兔IgG购自中国武汉纯度生物科技有限公司;仪器:电子天平购自中国上海众渊实业有限公司;TDZ4-WS低速台式离心机购自中国湖南湘瑞生物有限公司;倒置显微镜购自中国上海豫光仪器;凝胶成像系统及Western blot电泳系统均购自中国北京赛百奥科技有限公司;BriCyte E6流式细胞仪购自中国迈瑞医疗有限公司。
1.3原代细胞抗原检测及细胞培养:细胞传代取第3代MSCs,采用0.25%胰蛋白酶消化后采用倒置显微镜观察细胞完全悬浮后采用PBS冲洗,在加入相关抗体CD44、CD45、CD13、CD14,4℃下避光孵育30min,PBS冲洗后采用流式细胞仪进行检测。显微镜下观察原代细胞生长至80%~90%时进行传代,75%乙醇消毒,弃去旧的培养基,PBS洗涤三次,加入0.25%胰蛋白酶消化,生长至90%时终止消化反应,脱壁后,放入15mL的离心管中1000r/min,5min后,弃去上清液放入培养基中2~3d传代。
1.4MSCs细胞干预及分组:PBS缓冲液将MSCs细胞株洗净,重复3次,胰蛋白酶消化2min,离心15mL后,将数目为5×103细胞平铺到6孔板中,融合率达到70%,采用无血清培养基按照3μL稀释,在37℃下孵育20min,转染按照Lipofectamine 2000说明书操作,分别将miR-141siRNA、miR-141-siRNA-NC转染到细胞株中,37.5℃,5%CO2继续培养。12h后将无血清培养基更换为完全培养基,继续培养24h后,提取细胞RNA,采用qRT-PCR法验证转染效率。分组:将MSCs细胞分为A组(股骨颈骨折患者hMSCs细胞)、B组(激素性股骨头坏死患者hMSCs细胞)、C组(B组+hMSCs细胞+miR-141-siRNA-NC)、D组(B组++miR-141-siRNA)。
1.5MTT检测各组hMSCs细胞存活率:各组hMSCs细胞接种在96孔板中,消化后,每个浓度6个复孔,细胞浓度0.6×104个/mL,均加入5mg/mL的MTT溶液20μL,培养24h、48h及72h后,然后吸弃培养液,再在每个孔中加入50μL DMSO,摇匀后放入490nm波长下检测(OD值),取3次平均值。
1.6流式细胞仪检测各组hMSCs细胞凋亡:取2×105个/mL的hMSCs细胞悬液,PBS溶液予以洗涤,离心5min,运用100μL结合缓冲液,对细胞进行重悬,用5μL标记FITC的AnnexinⅤ与5μL PI染色混匀,避光条件下,孵育15min后注入400μL结合缓冲液混匀,予以洗涤,次数3次,流式细胞仪检测细胞凋亡率。
1.7免疫印迹检测hMSCs细胞VEGF、TGF-β2蛋白表达:hMSCs移入孔6板中,细胞浓度为2.5×104个/mL,PBS冲洗,加入150μL RIPA的裂解液,12000r/min离心15min后,放入样孔中,进行电泳实验。PVDF膜TBS浸泡10min,反复PBS冲洗,5min/次,加入VEGF(1∶500)及TGF-β2(1∶1000)1抗和内参GAPDH抗体(1∶1000),TBS冲洗3此后,加入辣根过氧化酶标记的山羊抗兔(1∶5000),杂交冲洗。后将膜浸入ECL工作液,随后进行检测,获取图象。
1.8QRC-PCR检测hMSCs细胞miR-141、VEGF、TGF-β2相对表达量:hMSCs细胞浓度为2.5×104个/mL,提取细胞中RNA进行反转录得到总cDNA,分离后采用Trizol法提取总RNA,无核酸酶溶解。将提取的RNA进行转录为cDNA,获得反体系,条件为:42℃作用60min,72℃作用5min,4℃终点。每个细胞设置6个复孔,以β-actin为内参,反应条件为95℃预作用3min,95℃作用5s,58℃退火,40个循环。见表1。

表1 引物序列
1.9双荧光素酶报告基因:从人类基因组DNA产生全长VEGF-3′UTR,TGF-β2-3′UTR并通过退火合成的信号寡核苷酸产生突变体,DNA片段克隆到ph-TK载体,VEGF-3′UTR WT/TGF-β2-3′UTR WT为野生型,VEGF-3′UTR MUT/TGF-β2-3′UTR MUT为突变型,均转染到细胞内,同时使用pGL-3.0(荧光素酶)作为内参照。检测细胞中VEGF、TGF-β2的荧光活性相对值。使用 Lipofectamine 2000 TM检测转染效率在孢菌素酶活性的基础上正常化。按照说明书,使用双荧光素酶报告系统试剂盒测量miR-141对VEGF、TGF-β2的表达活性的调控能力。
2 结 果
2.1流式细胞仪检测hMSCs细胞表面抗原:hMSCs细胞表表面抗原CD44(86.33±3.02)%,CD13(90.25±2.55)%呈现高表达,CD14(0.89±0.15)%、CD45(0.33±0.05)%呈现低表达。
2.2hMSCs细胞形态比较:A为股骨骨折患者分离培养24h的hMSCs细胞出现少量贴壁生长,细胞呈现纺锤状生长,融合速度较快,呈现旋涡状生长;B为激素性股骨头坏死患者离培养24h的hMSCs细胞数量较少,多数呈现呈梭形分布,见图1。

图1 股骨骨折和激素性股骨头坏死hMSCs细胞形态
2.3RT-PCR检测各组hMSCs中miR-141 mRNA表达:与A组相比,B组细胞miR-141 mRNA升高,差异具有统计学意义(P<0.05),B组和C组miR-141 mRNA比较差异无统计学意义(P>0.05),与C组相比,D组miR-141 mRNA降低,差异具有统计学意义(P<0.05),见图2。

图2 各组hMSCs中miR-141 mRNA表达注:与A组相比,aP<0.05;与B组相比,bP<0.05;与C组相比,cP<0.05
2.4MTT检测各组hMSCs细胞存活:与A组相比,B组hMSCs细胞活性降低,差异具有统计学意义(P<0.05),B组和C组24h、48h及72h hMSCs细胞活性差异无统计学意义(P>0.05),与C组相比,D组MSCs细胞24h、48h及72h 活性升高,差异具有统计学意义(P<0.05),见表2、图3。
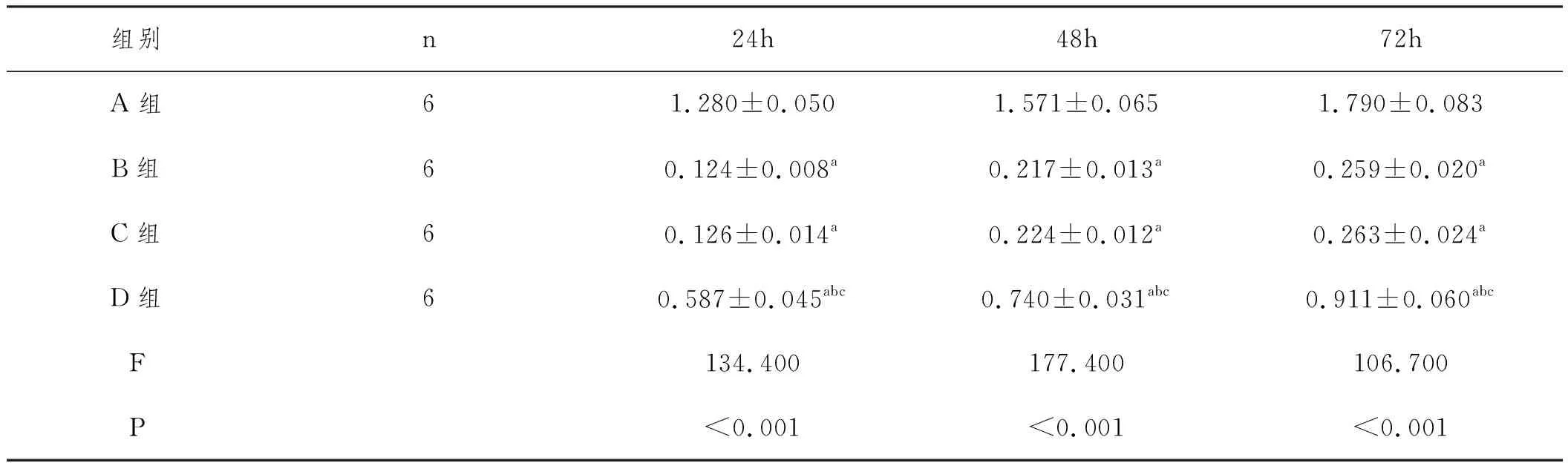
表2 各组hMSCs细胞存活OD值(490nm)
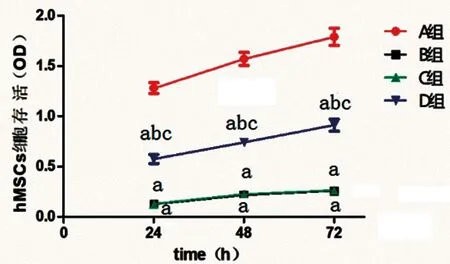
图3 各组hMSCs细胞存活OD值比较注:与A组相比,aP<0.05;与B组相比,bP<0.05;与C组相比,cP<0.05
2.5流式细胞仪检测各组hMSCs细胞凋亡率:A组、B组、C组及D组hMSCs细胞凋亡率分别为(4.23±0.33)、(20.73±1.20)、(19.43±1.16)及(14.76±0.80),各组间比较差异具有统计学意义(F=381.00,P<0.001);与A组相比,B组hMSCs细胞凋亡率升高,差异具有统计学意义(P<0.05),B组和C组hMSCs细胞凋亡率比较差异无统计学意义(P>0.05),与C组相比,D组hMSCs细胞凋亡率降低,差异具有统计学意义(P<0.05),见图4。
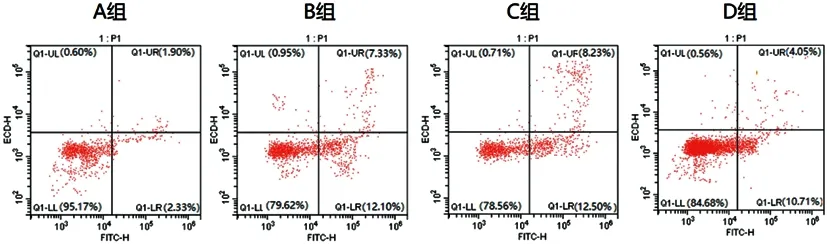
图4 各组hMSCs细胞凋亡率比较(n=6)
2.6各组hMSCs细胞VEGF、TGF-β2蛋白水平比较:与A组相比,B组VEGF、TGF-β2蛋白水平降低,差异具有统计学意义(P<0.05),B组和C组VEGF、TGF-β2蛋白水平差异无统计学意义(P>0.05),与C组相比,D组VEGF、TGF-β2蛋白升高,差异具有统计学意义(P<0.05),见表3、图5。
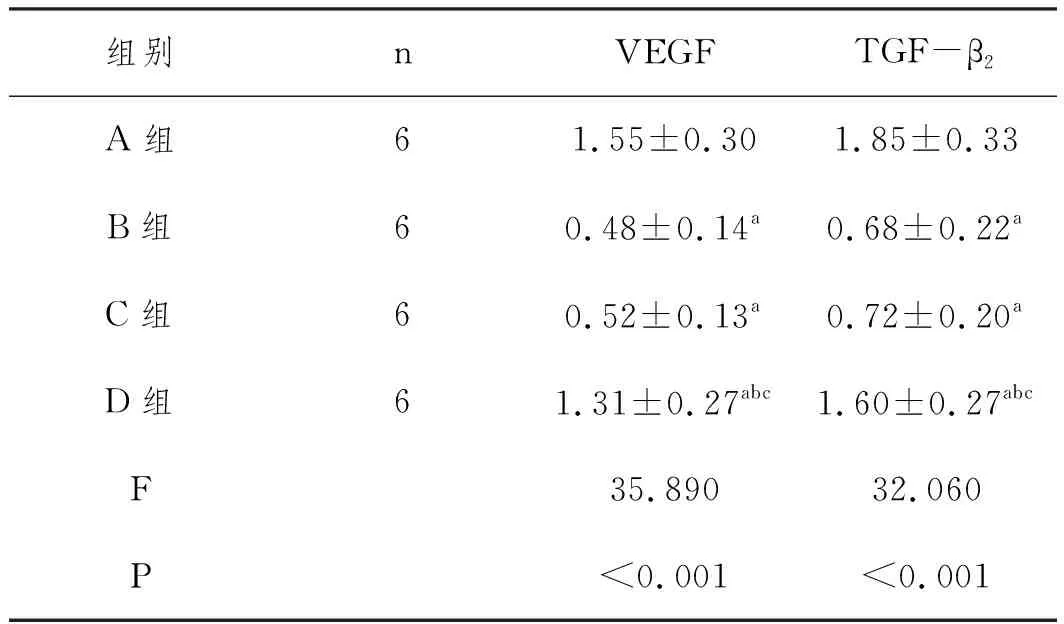
表3 各组hMSCs细胞VEGF TGF-β2蛋白水平比较

图5 各组细胞VEGF、TGF-β2蛋白水平比较
2.7各组hMSCs细胞VEGF、TGF-β2mRNA比较:与A组相比,B组hMSCs细胞VEGF、TGF-β2mRNA降低,差异具有统计学意义(P<0.05),B组和C组VEGF、TGF-β2mRNA比较差异无统计学意义(P>0.05),与C组相比,D组hMSCs细胞VEGF、TGF-β2mRNA升高,差异具有统计学意义(P<0.05),见表4。

表4 各组细胞VEGF TGF-β2 mRNA比较
2.8miR-141对VEGF、TGF-β2调控作用:为了明确miR-141相关VEGF、TGF-β2情况,使用生物信息学发现miR-141与VEGF、TGF-β2由相互结合的序列,证明之间存在调控关系。为了验证miR-141相关VEGF、TGF-β2的3′UTR结合,我们将miR-141转染到细胞中,通过抑制miR-141观察对VEGF、TGF-β2的荧光活性变化,证实:miR-141-siRNA能够上调VEGF、TGF-β2活性,miR-141-siRNA能与VEGF、TGF-β2的3′UTR特异性结合,见表5。

表5 miR-141对VEGF TGF-β2调控作用
3 讨 论
hMSCs细胞属于自我更新及分化较强的细胞,hMSCs可分化为成骨细胞及骨髓结缔组织等对于改善骨损伤及加强软骨修复具有重要作用[8]。hMSCs表明抗原CD44、CD13呈现阳性,CD14及CD45呈现阴性,利用流式细胞仪证实了股骨髋骨骨折及激素性股骨头坏死中提取的hMSCs满足实验需要。股骨头坏死的诱发原因之一为长期使用激素可导致机体过氧化物酶体增殖物活化受体γ(PPAPγ)升高可导致脂肪细胞在骨髓中沉淀增加成脂分化紊乱进一步抑制成骨细胞活性而降低骨修复[9]。因此,通过增加hMSCs活性抑制成脂分化及增加成骨细胞活性对于减少股骨头坏死具有重要意义。
近些年随着生物分子靶向技术的发展,经研究证实miRNAs与多种疾病发生发展存在关联。miRNAs广泛存在于各种生物体内,其家族成员之间存在高度同源序列,可通过对靶向基因进行完全和非完全的配对进而发挥抑制翻译、转录等作用[10]。早在2008年Kobayashi发现miRNAs与骨存在关系,并敲除了小鼠体内内切核酸酶Dicer后发现小鼠hMSCs细胞成骨分化能力消失,导致骨生成减少及骨密度降低,而Dicer属于miRNA合成必需的一类酶类,说明miRNA在骨发育有重要作用[11]。miR-141是miRNAs家族成员之一,在骨质疏松中miR-141-3p表达升高能够充当hMSCs活性的负性调节因子,沉默后可改善低骨量疾病[12]。目前,miR-141在股骨头坏死中的研究暂无,但张文明等[13]等研究证实了miR-141在骨形成中也发挥调节作用,并进行hMSCs细胞实验证实了抑制miR-141表达可增加成骨细胞增殖及分化,认为主要是通过调节Wnt靶基因而发挥作用。本文研究证实,转染miR-141-siRNA能够提高hMSCs细胞存活,降低凋亡。沉默miR-141对hMSCs细胞的调节作用,主要是对成骨基因进行调节而间接增加骨形成而降低对hMSCs细胞活性抑制作用。张志恒等[14]研究表明,miR-141的内源性降低后可减少对同源转录因子5(DLX5)的靶向抑制表达升高可激活上调因子Runt相关转录因子2(Runx2)而促进成骨形成。张楚天等[15]研究表示,抑制miR-141可增加BMSCs成骨分化作用主要在于激活调控Dlx5/Runx2信号进而发挥预防和治疗绝经后骨质疏松的目的。本文认为抑制miR-141后可减少对VEGF及TGF-β2的抑制而增加hMSCs细胞进而改善股骨头坏死。
VEGF被称为最有力的血管生长因子,能够增加血管内皮细胞分化而增加血管新生。从骨形成细胞水平,VEGF可增加hMSCs细胞聚集及分化而增加成骨细胞活性,可全身性及局部性调节骨形成。TGF-β2可影响血管生成而增加hMSCs细胞活性。在骨生长及修复过程中TGF-β2及VEGF可相互影响而增加骨组织血管新生,并可直接作用与hMSCs细胞可增加其活性,提高分化功能而改善骨组织缺血。本文研究发现,在hMSCs细胞中抑制miR-141可增加TGF-β2及VEGF表达。据此我们推测抑制miR-141在hMSCs细胞调节可能是通过激活TGF-β2及VEGF实现的。为了进一步验证这种预测,我们将含有TGF-β2及VEGF的3'-UTR序列的荧光素酶报告基因与miR-141siRBA共转染于hMSCs细胞中来证明其靶基因关系。验证miR-141对目的基因TGF-β2及VEGF的靶向作用。Choi S K[16]研究表示,miR-141的靶标主要为MAPK1、VEGF-A、EGFR、YAP1、STAT4,分别来自Star Base和Target Scan,通过靶向上述指标miR-141可促进血管疾病发生发展。但是在股骨头坏死hMSCs细胞的抑制miR-141对TGF-β2及VEGF作用机制还需要进一步研究证实。
本文存在一定局限性,miR-141对于TGF-β2及VEGF研究机制还需要进一步实验,实验结果存在单一性,今后应丰富实验内容,加强与其他单位合作,完善其作用机理,为股骨头坏死临床研究提供实践基础。综上沉默miR-141能够通过提高股骨头坏死骨髓间质干细胞活性,抑制凋亡发挥髓间质干细胞保护作用,研究机制可能与激活VEGF、TGF-β2活性相关。

