低剂量全肝灌注CT 评价肝细胞癌TACE 术后残余肿瘤活性
王超 马士亮 曹邱婷 韩昕君 段永利 梁小红 闫城 邢颖 张洪义 赵丽琴
肝细胞癌(hepatocellular carcinoma,HCC)的发病率与病死率在世界范围内分别位居肿瘤的第六位与第四位[1],而在我国的发病率及病死率分别位居第四位及第二位,严重威胁患者的生命安全[2]。HCC 的治疗方式中手术切除是一线治疗[3,4],但是只有10%~15%的HCC 患者适合手术[4]。对于中期HCC 患者,欧洲肝脏研究协会(European Association for theStudy of the Liver,EASL)和欧洲癌症研究治疗协会(European Organisation for Research and Treatment of Cancer,EORTC)临床实践指南推荐采用经动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)治疗[5]。TACE 的基本原理为在肿瘤局部注射化疗药物,并阻断其供血动脉,使肿瘤发生坏死;不足之处在于不能完全灭活肿瘤[6,7]。因此,HCC TACE 术后,及时准确判断残余肿瘤活性组织对患者下一步治疗策略的选择至关重要[8]。灌注CT 可评价HCC 的血流动力学状态,既往肝灌注CT 辐射剂量大,限制了其在临床的广泛应用,本研究拟探讨低剂量全肝灌注CT 评价HCC肿瘤活性组织的可行性。
资料与方法
本研究已获得伦理委员会批准。
1.一般资料
选择2017 年7 月~2022 年7 月间临床确诊为肝硬化及HCC 并行TACE 治疗的患者,所有患者均在治疗后4~6 周行低剂量全肝灌注CT 扫描。选取其中有残余肿瘤活性组织及明确坏死组织的病例,肿瘤活性组织的判断依据为TACE 术后增强CT 图像显示HCC 病变内的动脉期明确强化、门脉期/延迟期廓清的成分;坏死组织的判断标准为HCC 病灶内平扫、动脉期、静脉曲图像上没有明确强化的成分。对于CT 不能明确的病例,结合上腹部磁共振增强扫描进一步明确诊断。共纳入患者30 例,其中男23 例,女7 例;年龄范围40~79 岁,平均62 岁。22 例患者同时行上腹部磁共振增强扫描。
2.方法
TACE 治疗:经右侧股动脉引入5F 动脉导管,首先行动脉造影检查以评估肿瘤动脉血供及肝动脉解剖情况。使用2.7F 微导管超选择肿瘤所在段级或亚段级肝动脉。将阿霉素、奥沙利铂与超液化碘油以适当比例混合,制备成碘油乳剂。经微导管灌注适量碘油乳剂后,栓塞适量明胶海绵颗粒。以微导管头端血流完全淤滞为栓塞终点。栓塞完成5 min 后,再次进行动脉造影明确段级或亚段级肝动脉血流是否完全中止。
CT 检查:采用GE Revolution CT(GE Healthcare,Wisconsin,USA)扫描机,采用非离子型碘对比剂(碘海醇,350 mg I/ml)和双筒高压注射器。经肘静脉团注对比剂70 ml,注射流率5 ml/s,注射完毕后以相同流率注入30 ml 生理盐水。增强扫描动脉期、门静脉期、延迟期均采用GSI 扫描。动脉期前、后采用灌注模式进行CT 扫描,分别扫描11 次及8 次,扫描参数见(表1)。扫描结束后,将增强扫描前四期,包括两期灌注及动脉期、门静脉期CT图像的上下范围匹配一致,并将层厚、间隔均拆解为2.5 mm,传至AW 4.7 工作站(GE Healthcare),应用工作站内置软件进行运动伪影校正后行肝脏CT 灌注分析。
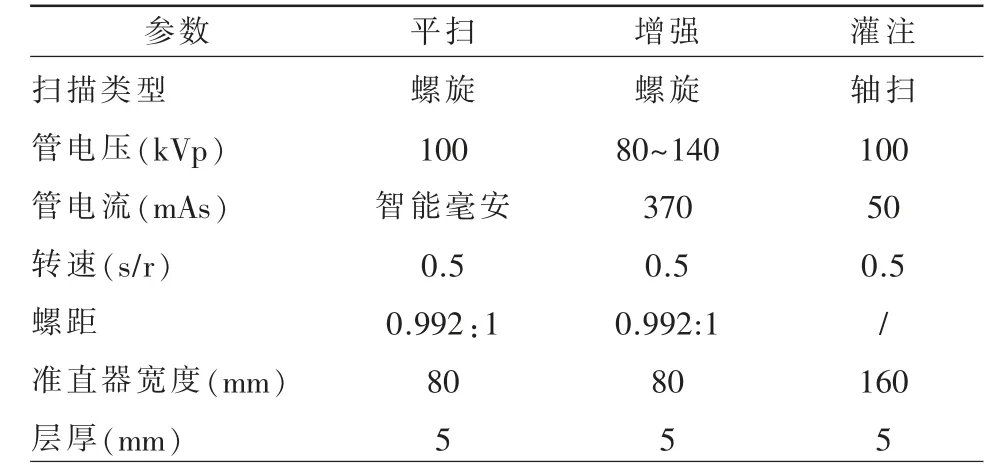
表1 CT 扫描参数
磁共振检查采用GE MRI 750 扫描机,主要序列包括T2WI、同反相位、DWI 及LAVA 三期增强扫描。
3.图像分析
以CT 及MRI 图像为参考,由两名放射科医生在AW 4.7 工作站上独立进行CT 灌注参数测量。使用肝脏肿瘤灌注软件,分别获得坏死组织(T1)、残余活性肿瘤组织(T2)、背景肝组织(T3)的CT 灌注参数,包括肝动脉灌注分数(hepatic arterial fraction,HAF,%)、毛细血管表面通透性(permeability surface,PS,ml/min/100 g)、血容量(blood volume,BV,ml/100 g)及达峰时间(time to peak,TTP,s)。
具体测量方法如下(图1、2):首先,在需要测量残留肿瘤活性区、坏死区的CT 图像上勾画兴趣区(region of interest,ROI),ROI 形态为圆形或椭圆形,面积约10~80 mm2,尽量位于测量区域中心,避开血管及碘油区。然后,使用复制粘贴功能,将此ROI 复制到所有灌注图上,以减小绘制ROI 时的误差。将两位评估者测量值的平均值作为该测量区域的最终值。对于T3 的ROI,选择放置在病灶所在的肝叶内,如果病灶过大,超过了整个肝右叶或肝左叶,则放置于另一个肝叶。
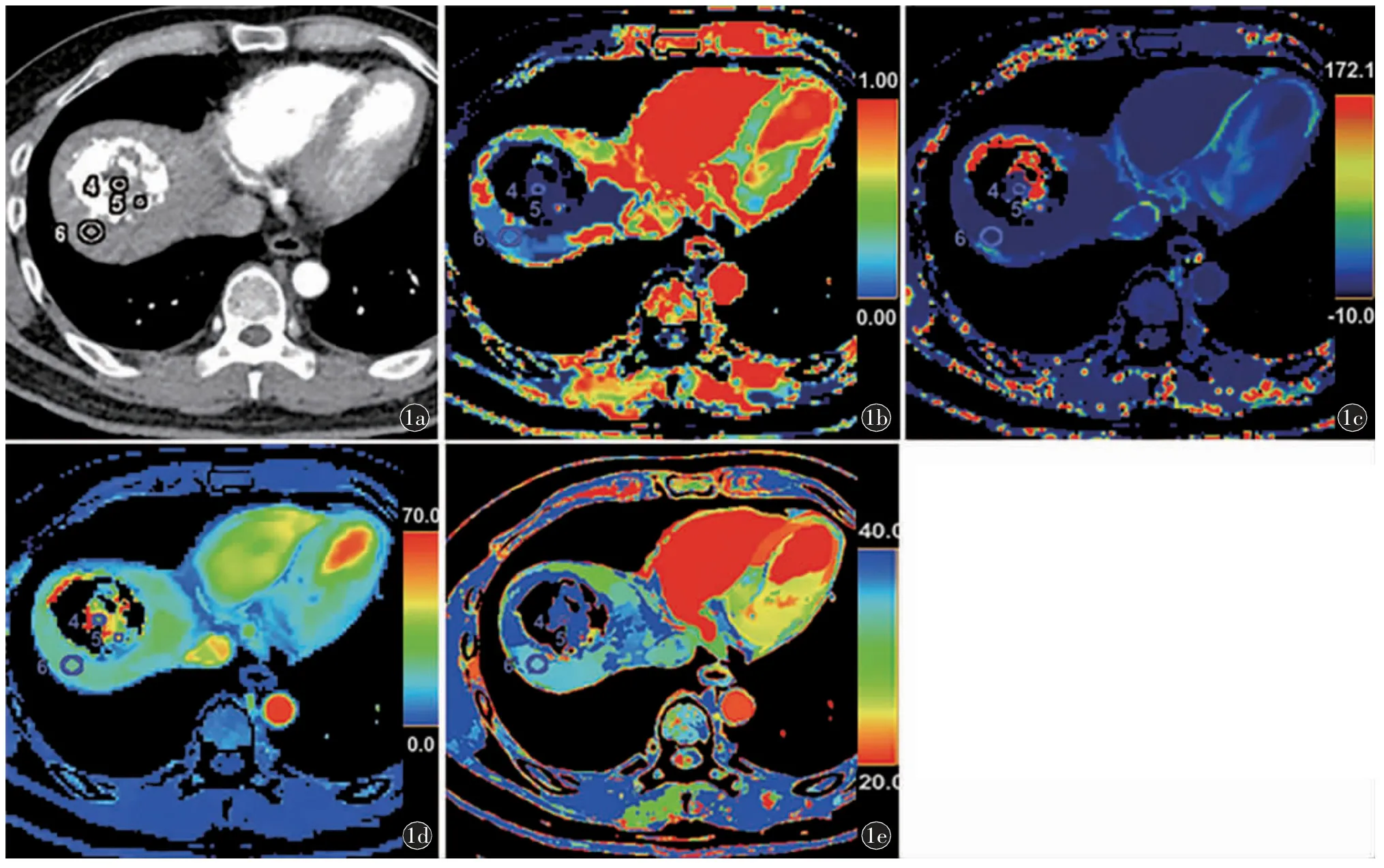
图1 男,40 岁,肝细胞癌TACE 治疗后5周。a)增强CT 动脉期轴位示肝右叶类圆形病灶,密度不均匀,其内可见碘油沉积及稍高密度强化区及低密度无强化区;b)HAF图;c)PS 图;d)BV 图;e)TTP 图。ROI 4:坏死组织,ROI 5:残余肿瘤活性组织,ROI 6:背景肝组织;ROI 5 在CT 动脉期图上呈稍高密度,HAF、PS、BV 均高于ROI 4 及ROI 6
4.统计分析
采用SPSS 23.0(IBM Corp.,Chicago,IL,USA)软件包进行统计学分析。分别对T2 与T1、T2 与T3 组间的各灌注参数采用单因素配对符号秩和检验进行对比分析,P<0.05 为有统计学差异。
结果

图2 男,61 岁,肝细胞癌TACE 治疗后6 周余。a)增强CT 动脉期轴位示肝S1 椭圆形病灶,密度不均匀,其内可见碘油沉积及稍高密度强化区及低密度无强化区;b)HAF 图;c)PS图;d)BV 图;e)TTP 图。ROI 4:坏死组织,ROI 5:残余活性肿瘤组织,ROI 6:背景肝组织;ROI 5 在CT 动脉期图上呈稍高密度,HAF、PS、BV 均高于ROI 4 及ROI 6
30 例患者共发现35 个有残余肿瘤活性成分的HCC 病灶,分别位于S3(10 例)、S4(6 例)、S5(12 例)、S6(4 例)、S8(3 例)。肿瘤直径约为(6.4±2.1)cm。
病灶不同组织的各灌注参数值及对比结果见(表2、3,图1、2)。结果显示T2 的HAF、PS、BV均高于T1(PHAF、PPS、PBV<0.001)与T3(PHAF、PPS<0.001、PBV=0.032),而T2 的TTP 虽然低于T1、T3,但是差异均无统计学意义(PTTP=0.757、0.078)。

表3 HCC TACE 治疗后不同组织的灌注参数比较
在本研究中,有效辐射剂量约(19.71±4.28)mSv。
讨论
已经有研究表明,TACE 可提高HCC 患者的生存率[9]。但是,栓塞剂与化疗药物浓度过低等原因会使肿瘤治疗不彻底[10]。因此,及时准确评估HCC TACE 术后疗效对患者进一步治疗策略的选择至关重要。
1.全肝低剂量灌注CT 定量评估的可行性
CT 灌注成像(CT perfusion,CTP)作为一种功能成像方式,可对病灶进行定量评估,在HCC 疗效的评估上也有应用。有研究显示,CTP 可对行射频消融术(radiofrequency ablation,RFA)和TACE治疗后的HCC 患者疗效进行评估[11]。也有研究者用CTP 来评价索拉非尼治疗HCC 的疗效及HCC的分化程度[12,13],均获得了较好评价效果。但是传统CTP 辐射剂量大,探测器范围窄,同时获得灌注及常规增强CT 图像需注射两次对比剂,在临床应用上受到了一定限制。
与传统CTP 相比,本研究所采用的GERevolution CT 采用宽体探测器覆盖范围为16 cm,可实现全肝灌注扫描,改善了既往灌注CT 只能对肝脏的一部分进行评价的不足;球管转速0.28 s,扫描速度快,可实现不同扫描模式的自由组合及极速转化,从而可完成上腹部能谱与灌注的一站式扫描;此外,采用了先进的适应性统计迭代重组技术(adaptive statistical iterative reconstruction -Veo,ASIR-V),在保证图像质量前提下,实现了低辐射剂量扫描[14]。此外,灌注CT 扫描方案可采用相对较低kVp 进行扫描。
由此,应用Revolution CT 扫描机可实现全肝、低剂量灌注CT 扫描,本研究中患者的有效辐射剂量约为(19.71±4.28)mSv,据文献报道双源128 排CTP 患者有效辐射剂量为(32~45)mSv[15],较本扫描方案的CT 辐射剂量高。采用本扫描方案通过一次扫描,除了获得灌注CT 参数外,可同时获得动脉期、门脉期能谱CT 参数。而应用同一CT 扫描机,单纯行动脉期、门脉期能谱CT 的辐射剂量约为(14.56±6.57)mSv。此外,本研究应用的能谱与灌注融合扫描模式,可在一次对比剂注射后,同时获得灌注参数及能谱扫描数据,而传统灌注CT检查,需单独注射一次对比剂进行扫描。因此采用一站式能谱、灌注CT 扫描方式可在低辐射剂量、低对比剂量的基础上同时获得两种数据。
2.评估HCC TACE 疗效的有效灌注参数
在本研究中最初测量的灌注参数除了HAF、PS、BV、TTP,还有BF 和MTT。因BF 与MTT 的数据变异较大,所以本研究只比较了TACE 术后残余活性肿瘤组织与其他组织的HAF、PS、BV、TTP 差异。文献报道BF 会受到心脏功能的影响,因此可靠性较BV 低[16],这也可能是笔者测量BF 值变异较大的原因。由于碘油沉积区域均无此灌注参数值的显示,本研究未对其进行测量。
3.残余活性肿瘤组织灌注参数的比较
本研究结果显示残余活性肿瘤组织的HAF较坏死组织与背景肝组织高(P<0.05)。Ippolito等[11]在HCC TACE 治疗后1 个月行CTP 检查,结果显示残余活性肿瘤组织的肝动脉灌注指数(hepatic perfusion index,HPI)高于坏死区域及背景肝组织;Chen 等[17]在用CTP 评估TACE 治疗HCC 的疗效时亦发现,治疗后非进展组肿瘤的HAF 降低,进展组肿瘤的HAF 升高。HAF 与HPI为不同设备的参数,反映的血流动力学意义相同。本研究结果与以往研究结果相符。究其原因通过HAF 的计算公式

可以发现其反映了靶组织区肝动脉灌注与总肝灌注的比值,HCC 的血供主要来自肝动脉,病灶所在肝叶、肝段的供血动脉管径增粗、血供增加,而出现虹吸现象[18],坏死组织已经无血供,肝硬化组织的动脉供血也较HCC 低,因此残余活性肿瘤组织的HAF 较坏死组织与背景肝组织高。
本研究结果显示残余活性肿瘤组织的PS 较坏死组织与背景肝组织高(P<0.05)。PS 代表毛细血管表面通透性,PS 值升高代表微血管通透性增加。目前用PS 评价HCC TACE 疗效的研究较少。Sahani 等[13]的研究表明,与正常肝组织相比,HCC的PS 较高。Frampas 等[19]在用CTP 研究索拉菲尼对HCC 的疗效时,将HCC 分为进展组与非进展组,研究结果显示前者的PS 高于后者。残余活性肿瘤组织的PS 较背景肝组织高的可能原因为肿瘤细胞浸润毛细血管,正常结构被破坏,导致其通透性增加。残余活性肿瘤组织的PS 较坏死组织高,与坏死组织已经无血供有关。
此外,本研究结果还显示残余活性肿瘤组织的BV 均高于坏死组织及背景肝组织(P<0.05),提示肿瘤活性组织有丰富的血供。Ippolito 等[20]研究显示,HCC 肿瘤组织的HAF、BV 比瘤周肝组织更高。残余活性肿瘤组织与坏死组织及背景肝组织的TTP 之间无明显差异,说明灌注压力亦无明显差异;以上研究结果与文献报道相符[11]。
本研究存在以下局限性:(1)同时获得了HCC TACE 术后的能谱与灌注参数,但未涉及两者的比较,将在今后进一步研究;(2)样本量较小,今后继续扩大样本量后进行相关研究。

