TACE 联合TOMO 治疗原发性肝癌下腔静脉、右心房癌栓的疗效及安全性
肖静 欧阳兵 吴毅 郑文涛 李庆东
原发性肝癌是全世界范围内最常见的恶性肿瘤之一,我国每年肝癌新发病例约39 万,发病率居肿瘤的第5 位,病死率居第2 位[1]。原发性肝癌合并血管侵犯常提示肝癌已发展至晚期且预后不良,尤其下腔静脉(inferior vena cava,IVC)、右心房(right atrium,RA)受侵犯的患者往往预后更差,如不治疗中位生存期常不足3 个月[2]。可能还会因IVC 恶性梗阻导致下肢及阴囊水肿,目前尚无标准的治疗方案[3]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是中晚期肝癌的常用治疗方法[4,5]。放射治疗(radiation therapy,RT)是治疗肝癌伴IVC、RA 癌栓的另一重要治疗手段,既往研究显示疗效确切,且不良反应可耐受[6]。而螺旋断层放射治疗系统(tomotherapy system,TOMO)是目前先进的肿瘤放射治疗设备,笔者考虑将二者联合运用,充分发挥二者不同的特性,比较TACE联合TOMO 与TACE 治疗原发性肝癌IVC 和/或RA 癌栓的有效性和安全性。
资料与方法
1.基线资料
该研究方案已获得重庆大学附属肿瘤医院的伦理委员会的批准(伦理编号:CZLS2021042-A)。前瞻性收集2020 年8 月31 日~2021 年8 月31日,按照《2019 年版中国卫生部原发性肝癌诊疗规范》或组织病理学诊断为原发性肝癌,分期为巴塞罗那C 期合并IVC 和/或RA 癌栓,癌栓分型[7]Ⅱ、Ⅲ型[该分型综合癌栓近心端在IVC 内所处的解剖位置和预后的关系将癌栓分为3 型:(1)肝静脉型(Ⅰ型),即癌栓局限于肝静脉内;(2)膈下型(Ⅱ型):癌栓位于肝后下腔静脉内,但在横膈平面以下;(3)膈上型(Ⅲ型):Ⅲa 型即癌栓已经越过膈肌平面的下腔静脉,Ⅲb 型即癌栓已进入右心房内]患者共84 例(表1)。肝功能Child-Pugh评分≤7 分;ECOG 评分≤2 分;基线实验室检查符合以下标准:白细胞≥1.5×109/L,血小板≥50×109/L,血红蛋白≥80 g/L,血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸转氨酶(asparatae amintransferease,AST)≤2×正常值上限(upper limit of normal,ULN),血清肌酐≤1.5×ULN,国际标准化比值(international normalized ratio,INR)<1.5,凝血酶原时间<ULN+4 s,白蛋白≥30 g/L,总胆红素≤34 mmol/L。排除标准:(1)门脉主干完全栓塞,且侧支血管形成少;(2)拟行肝移植者;(3)凝血功能异常[INR>1.5 或凝血酶原时间(prothrombin time,PT)>ULN+4 s],具有出血倾向或正在接受溶栓或抗凝治疗;(4)在入组前行放疗者;(5)患有Ⅱ级以上心肌缺血或心肌梗死、控制不良的心律失常(包括QTc 间期男性超过450 ms、女性超过470 ms);(6)肺功能严重异常者;(7)肿瘤体积超过肝体积70%;(8)怀孕或哺乳期妇女;(9)患者和/或家属不同意加入临床试验。
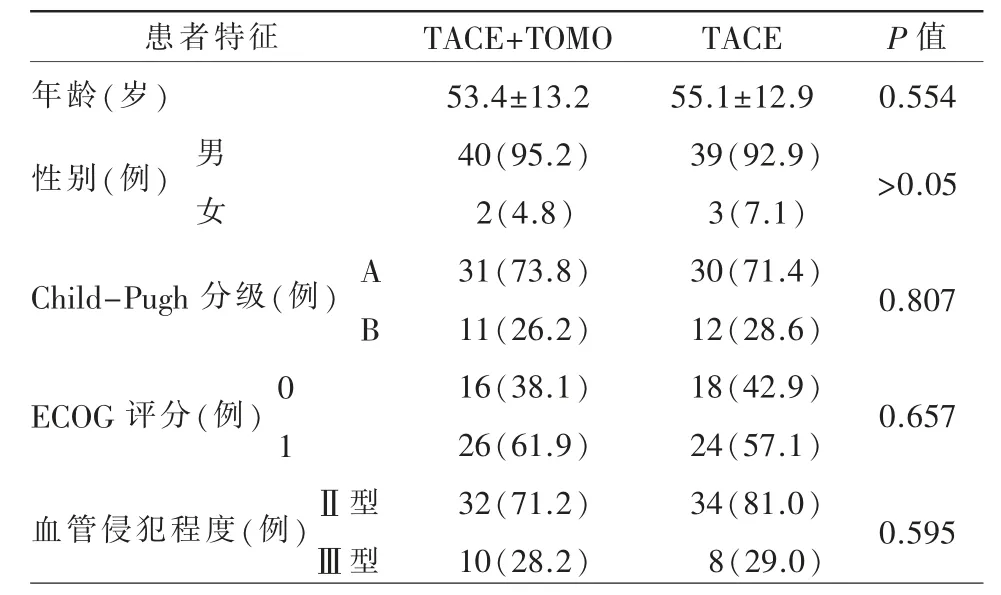
表1 患者的基线特征
所有患者通过多层螺旋增强CT 来诊断癌栓及评估癌栓范围,尤其需要鉴别血栓与癌栓,根据Sherman 等[8]提出的标准:(1)静脉扩张;(2)栓子强化;(3)栓子周围新生血管;(4)栓子附近肿瘤;(5)甲胎蛋白水平大于1000 ng/dL。当存在上述3项或3 项以上时诊断为癌栓。
将患者采用随机数字表法按1∶1 比例随机分为2 组,实验组行TACE 联合TOMO 放疗治疗(TACE 同时栓塞肝脏病灶及癌栓,放疗仅针对癌栓),对照组行TACE 治疗(TACE 同时栓塞肝脏病灶及癌栓)。
2.TACE 方法
局部麻醉后,采用Seldinger 法经皮穿刺股动脉置入5F 动脉鞘,然后将5F RH 或Yashiro 导管置于腹腔干、肝总动脉、右侧膈下动脉造影,图像采集应包括动脉期、实质期及静脉期,注意寻找IVC、RA 癌栓的供血动脉;应经脾动脉做间接性门静脉造影,了解门静脉血流状况。使用微导管超选择插管于肝内肿瘤及IVC、RA 癌栓的供血动脉支,注入含有化疗药物的碘油乳剂和栓塞剂,用量应根据肿瘤的大小、血供情况、肿瘤供血动脉的多少酌情掌握。使用的化疗药物:表阿霉素(≤60 mg);使用的栓塞材料:罂粟乙碘油(≤20 ml)、8Spheres微球,必要时使用明胶海绵颗粒或弹簧圈加固栓塞。
3.TOMO 治疗方法
TACE 术后3 d 以上行TOMO 治疗,所有患者在接受放疗前,均行腹部CT 或MRI 作为基线检查。应用TOMO 放疗系统进行治疗,调强放疗计划设计,患者采取仰卧位,发泡胶或真空垫固定,腹压板增加腹压减少呼吸影响。Philips 16 排大孔径螺旋CT 增强扫描进行模拟定位,平静呼吸下5 mm层厚连续扫描,扫描范围为膈上3~5 cm 至右肾下极,CT 图像传至计划系统进行靶区勾画,靶区肿瘤区(gross tumor volume,GTV)为CT 或MRI 显示 的IVC、RA 癌栓,癌栓外扩0.2~0.3 cm 形成临床靶区(clinical target volume,CTV),临床靶区到计划靶体积(planning target volume,PTV)的外放距离0.5 cm。在放疗模拟机下复位。所有病例共面照射野,依据靶区剂量分布图和剂量体积直方图进行放疗计划的优化及评估,各危及器官(包括正常肝组织、胃、十二指肠、肾、脊髓等)受照剂量在正常范围内。照射总物理剂量在40~72 Gy,单次照射剂量2~4 Gy,每周5 次,等效生物剂量(biologically effective dose,BED)48~94 Gy,中位等效生物剂量为78 Gy。
4.观察指标
根据修订的实体瘤疗效评价标准[9](modified Response Evaluation Criteria in Solid Tumors,mRESIST),把疗效定义为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)、进展(progressive disease,PD);每4~6 周在增强CT 或MRI 上评估对治疗的反应,评价1 个月、3 个月客观缓解率(objective response rate,ORR),疾病控制率(disease control rate,DCR),术后甲胎蛋白(α-fetoprotein,AFP)。疾病无进展生存时间(progression free survival,PFS):指肿瘤疾病患者从接受治疗开始到肿瘤进展或任何原因的死亡之间的这段时间。OS 率:从入组临床试验开始,到某一个指定时间节点为止(1 个月、3 个月、6 个月、9个月、12 个月),生存的受试者占组内总人数的比例。根据欧洲心血管与介入放射学会(Cardiovascular and Interventional Radiological Society of Europe,CIRSE)标准,主要并发症定义为需要额外的术后治疗,包括长期住院或引起严重发病或死亡的任何事件(CIRSE 3~6 级)[10]。受试者均在第一次治疗后4~6 周(或放疗结束后)复查肝脏CT 平扫加增强和/或MRI 平扫加增强,实验室检查;如初次复查为CR,则每隔2~3 个月复查;如初次复查不为CR,则隔4~6 周复查并及时行TACE 治疗。TOMO 放疗只做一个疗程,放疗结束后不再接受同一部位的放疗。随访的影像学资料由放射诊断科和介入科副主任医师以上人员各一名(非研究者)共同进行疗效评价,以减少偏倚。
5.统计学分析
所有病例数据均采用SPSS 27.0 软件进行处理。基本特征资料采用均数±标准差、中位数或四分位数间距等指标表示。均数比较采用t 检验或方差分析。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。使用Kaplan-Meier 方法计算PFS,并使用对数秩检验进行比较。
结果
1.患者特征
两组患者的基线资料均差异无统计学意义(表1)。
2.治疗后疗效
两组在治疗后的随访期间,术后1 个月TACE联合TOMO 组5 例患者(12.0%)获得CR,24 例患者(57.1%)获得PR,9 例患者(21.4%)获得SD,4例患者(9.5%)进展PD,ORR 为29 例(69.0%),DCR 为38 例(90.5%)。TACE 组3 例(7.1%)CR,13例(31.0%)PR,15 例(35.7%)SD,11 例(26.2%)PD,ORR 为16 例(38.1%),DCR 为31 例(73.8%)。
术后3 个月TACE+TOMO 组12 例(28.6%)CR,21 例(50.0%)PR,7 例(16.7%)PD,2 例(4.7%)PD,ORR 为33 例(78.6%),DCR 为40 例(95.2%)。TACE 组4 例(9.5%)CR,5 例(11.9%)PR,16 例(38.1%)SD,17 例(40.5%)PD,ORR 为9 例(21.4%),DCR 为25 例(59.5%)(表2)。术后1 个月、3 个月ORR 及DCR,TACE+TOMO 组均明显高于单纯TACE 组(表3,P 均<0.05)。
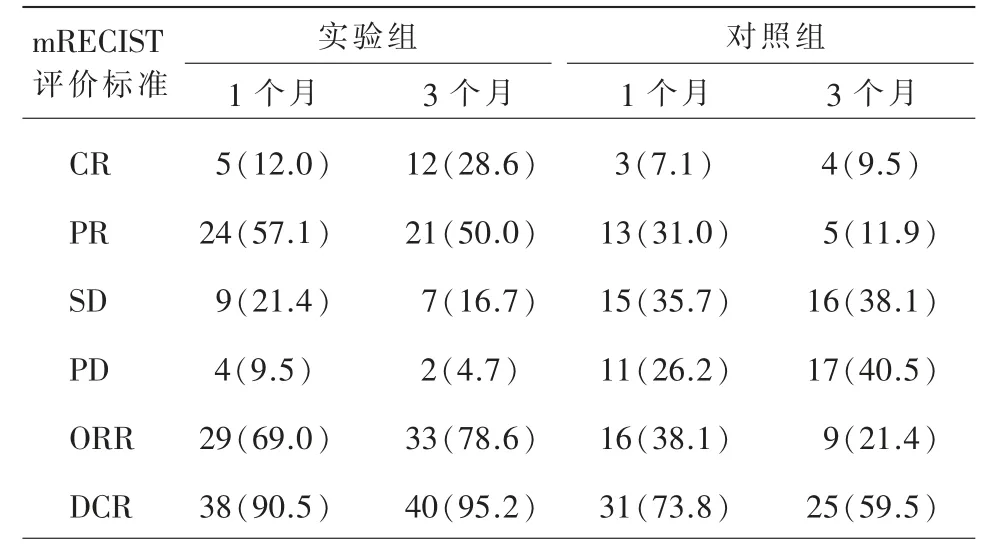
表2 两组患者近期疗效对比[例(%)]
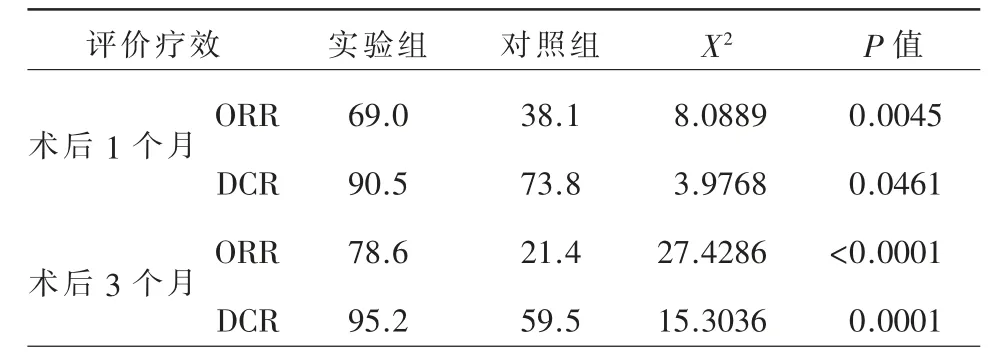
表3 两组疗效ORR、DCR 对比(%)
3.PFS 和OS 率分析
TACE 联合TOMO 组中位PFS 时间为9.9 个月(95%IC:5.087~14.713),TACE 组中位PFS 时间为5.0 个月(95%IC:1.917~8.083),两组对比差异有统计学意义(P=0.013)(图1)。TACE 联合TOMO组OS 率分别为1 个月100%,3 个月100%,6 个月100%,9个月90.5%,12 个月69.0%;TACE 组OS 率分别为1 个月100%,3 个月97.6%,6 个月88.1%,9 个月61.9%,12 个月23.8%,TACE 联合TOMO 组9个月、12 个月的OS 率明显高于TACE 组(表4,P<0.05)。
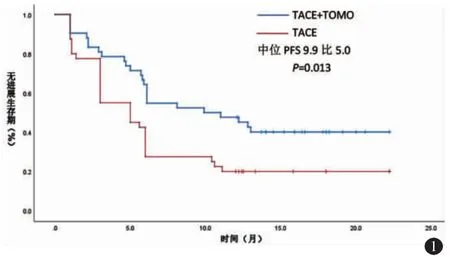
图1 Kaplan-Meier 分析TACE 联合TOMO 组和TACE 组的HCC侵袭IVC 或RA 患者的PFS
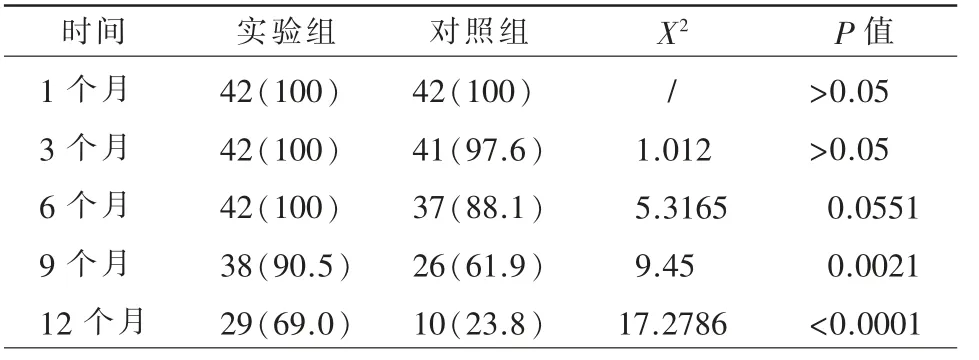
表4 两组OS 率[例(%)]
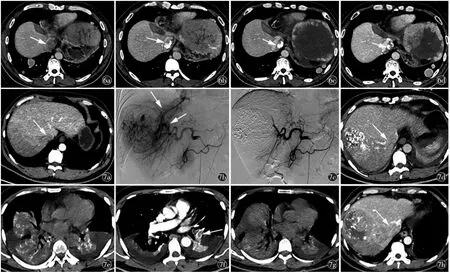
图6 男,32 岁,原发性肝癌侵犯IVC(Ⅱ型)。a)CT 增强示IVC 癌栓(箭);b)治疗后3 个月、c)治疗后6 个月、d)治疗后9 个月,随访期间显示癌栓持续性缩小(箭),随访第12 个月时候患者突发脑出血死亡图7 男,44 岁,原发性肝癌侵犯IVC(Ⅱ型)。a)CT 增强轴位示IVC 癌栓(箭);b)DSA 示肝动脉-肝静脉瘘(箭);c)栓塞肿瘤及瘘口后造影示肿瘤及瘘染色消失;d)术后患者血氧饱和度进行性降低,术后第一天气管插管后送往重症医学科治疗,复查胸腹部CT 提示癌栓内碘油沉积(箭);e)胸部平扫提示双肺下叶肺不张,其内碘油沉积;f)左下肺动脉栓塞(箭);g)治疗3 d 后复查,双下肺叶不张较前有所好转,其内高密度影较前减少;h)术后1 个月复查腹部CT 提示癌栓(箭)较前明显进展
4.主要并发症
TACE 联合TOMO 组中有7 例(16.7%)发生了严重并发症,主要包括持续发热3 例(7.1%)、肝功能衰竭1 例(2.4%)、肺栓塞(血栓)2 例(4.8%)、自发性细菌性腹膜炎1 例(2.4%)。TACE 组中6例(14.3%)发生严重并发症,包括持续发热2 例(4.8%)、肝功能衰竭1 例(2.4%)、肺栓塞(血栓)1例(2.4%)、急性肾功能衰竭1 例(2.4%)、急性胆囊炎1 例(2.4%)(两组并发症发生率P=0.7629)。所有患者对症处理后均好转,未发生死亡等严重并发症。典型病例见图2~7。

图2 女,42 岁,原发性肝癌侵犯IVC(Ⅱ型)。a)肝右叶巨块型肝癌;b)IVC 癌栓(箭);c)第一次TACE,可见癌栓染色(箭);d)栓塞后碘油沉积良好;e)1 个月后第二次TACE,肝肿瘤无明显染色,癌栓染色明显(箭),超选择栓塞癌栓;f)右侧膈下动脉造影栓塞;g)第二次TACE术后一个月复查CT 显示肝内病灶较前明显缩小(箭),但IVC 癌栓明显增大(箭),长入RA(Ⅲb 型);h)第三次TACE 显示肝内病灶无明显染色,IVC 及RA 癌栓染色明显(箭图3 男,53 岁,原发性肝癌侵犯IVC 及RA(Ⅲb 型)。a)冠状位CT 示IVC 及RA 癌栓(箭);b)栓塞前造影示微导管头端超选入右侧膈下动脉(箭);c)栓塞后示肝内及癌栓碘油沉积良好,术后3 d 行TOMO 放疗;d)TOMO 治疗后1 个月复查IVC、RA 癌栓较前明显缩小,无明显强化,仍可见沉积的碘油(箭)
讨论
原发性肝癌合并血管侵犯常提示肝癌已发展至晚期且预后不良。临床较为常见的是门静脉受侵犯和形成癌栓,而肝静脉(hepatic vein,HV)、IVC、RA 侵犯受报道很少。但是,病理解剖学证实,此类病例的真实发生率并不低。肝癌死者尸检发现,有44%发生HV、IVC 或RA 侵犯[11],而肝癌侵犯RA 占肝癌发生率的1%~4.8%[12,13]。此类患者往往预后较差,如不治疗中位生存期常不足3个月[2]。尤其IVC、RA 癌栓可能会引起IVC 恶性梗阻常伴随下肢及阴囊水肿,目前尚无标准的治疗方案[3]。该病病情危急,病死率极高,临床症状较重,需要积极治疗以延长生存期,减轻症状。
1.原发性肝癌伴IVC/RA 癌栓患者治疗方案
目前外科手术根治性切除已被证实可以延长该类患者生存期,多项回顾性研究表明[14-16],手术可提高生存率,中位OS 为9~18 个月,但术后病死率高达7.6%~9.9%。外科手术切除虽可延长该类患者生存期,但是存在较高死亡风险,且手术难度大,需要在富有经验和保障设备的少数医院进行,因此外科手术在原发性肝癌IVC 或RA 癌栓患者中受到很大限制。索拉非尼等靶向药物被推荐用于晚期原发性肝癌患者的一线治疗[17,18]。尽管有一定的疗效,但是对于伴有血管侵犯的原发性肝癌患者的中位生存时间仅为8.1 个月[19,20]。
TACE 是中晚期肝癌的常用疗法[4,21]。其理论基础主要基于正常肝组织通过门静脉供血占70%~75%,而肝癌的血供则是95%~99%来自肝动脉。TACE 一方面在肿瘤区域灌注化疗药物,局部药物浓度高,可有效杀伤肿瘤细胞;另一方面阻断肿瘤的血供,切断肿瘤营养供给,导致肿瘤缺血缺氧,促使肿瘤细胞坏死和凋亡。目前,对不能手术切除的肝癌和术后复发的肝癌,TACE 已被公认为首选疗法[5]。目前针对肝癌伴IVC、RA 癌栓的TACE相关研究表明[22],TACE 治疗可以改善部分患者的生活质量,控制病情、改善临床症状,但是仍有部分患者控制率不佳,少部分患者有术后短期癌栓增大的情况(图2),考虑与栓塞过后肿瘤缺氧状态可能促进血管生成因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)等的表达,刺激肿瘤生长有关;而且对于肿瘤控制不佳的患者多次TACE 对于合并癌栓患者的肝功能打击较大,易造成肝功能恶化,甚至肝衰竭的情况。所以以尽量少次数且有效的TACE 控制住此类患者的病情显得尤为重要。
放疗是治疗肝癌伴IVC、RA 癌栓的另一重要治疗手段,既往研究显示疗效确切,且不良反应可耐受。采用放疗原发肝癌伴IVC 癌栓,证明放疗可明显延长肝细胞癌伴IVC 癌栓患者的生存期[6]。但是对于肝癌肿瘤体积较大的患者,由于正常肝脏受照射范围较大,放疗无法对肿瘤本身进行治疗,所以放疗常常需要结合其他治疗来控制肝癌。TACE 联合放疗的组合最近已成为晚期原发性肝癌伴有血管侵犯的一种耐受良好且有希望的治疗选择[23-25]。最近的一项随机对照试验表明[23],TACE 联合放疗(n=45)与索拉非尼单药治疗(n=45)在非转移性肝癌伴血管侵犯患者中比较,显著提高了PFS(7 个月比2.6 个月,P<0.001)和OS(12.8个月比10 个月,P=0.04)。
2.TACE 联合TOMO 治疗原发性肝癌IVC/RA癌栓的疗效及安全性
TOMO 集调强适形放疗、影像引导调强适形放疗、剂量引导调强适形放疗于一体,独创以螺旋CT 旋转扫描方式的设计,结合CT 导航调校,突破了传统加速器的诸多限制,在CT 引导下360 度聚焦断层照射肿瘤,是目前肿瘤放射治疗尖端设备,对恶性肿瘤患者进行精准、高效、安全的治疗,能够将呼吸调控至最小化,呼吸引起的靶区移动减少至最低程度,对于因呼吸或体位变化而运动的肿瘤有独特的优势,因此对于原发性肝癌的IVC、RA 癌栓能够起到更有效、更精确、更安全的治疗,故TACE 联合TOMO 具有良好的理论基础,可能对于癌栓的治疗达到更加积极的效果(图3),随访期间大部分患者癌栓控制良好(图4~6)。本研究也表明,接受TACE 联合TOMO 组治疗局部晚期肝癌侵袭IVC 和/或RA 的ORR、DCR 明显高于TACE 组,TACE 联合TOMO 组的PFS 和OS 率显著高于仅接受TACE 治疗的患者(9 个月,P=0.0021;12 个月,P<0.0001)。两组并发症无明显差别,表明TACE 联合TOMO 治疗该类患者安全性可靠,两组患者均无术后死亡病例,但TACE 组有一例患者术后第一天出现严重的肺栓塞,气管插管后送往重症监护室继续治疗,好转后转回普通病房(图7),该例患者术中肝动脉-肝静脉瘘比较严重,笔者采用了大颗粒明胶海绵混合碘油乳化剂栓塞,但可能仍有部分碘油通过瘘口到达肺血管,造成了肺栓塞及肺不张,故针对此类瘘应慎用碘油及颗粒栓塞剂,可考虑采用弹簧圈联合大颗粒栓塞剂栓塞。
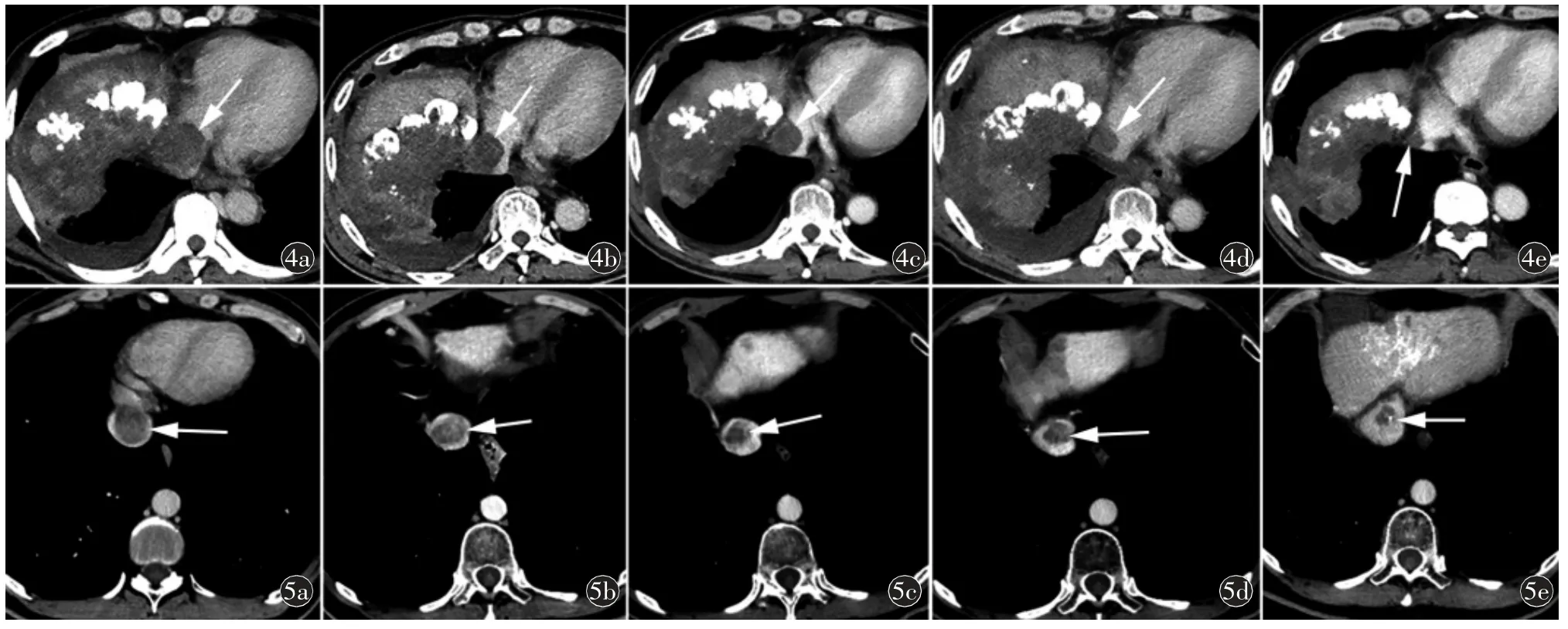
图4 男,67 岁,原发性肝癌侵犯IVC(Ⅲa 型)。a)CT 增强轴位示IVC 癌栓(箭);b)治疗后3 个月、c)治疗后6 个月、d)治疗后9 个月、e)治疗后12 个月,随访期间显示癌栓持续性缩小(箭图5 男,57 岁,原发性肝癌侵犯IVC(Ⅲa 型)。a)CT 增强轴位示IVC 癌栓(箭);b)治疗后3 个月、c)治疗后6 个月、d)治疗后9 个月、e)治疗后12 个月,随访期间显示癌栓持续性缩小(箭)
3.局限性
首先本研究仅为单中心研究,未来还需要进一步合作开展多中心的前瞻性随机对照研究;再者,本研究随访时间不足,远期效益及相关并发症仍需要进一步探讨。
总之,TACE 联合TOMO 在治疗原发性肝癌伴IVC 和/或RA 癌栓的患者与单独TACE 组相比,具有更好的短期和长期疗效,安全性可靠。

