我国食源性诺如病毒GII.2[P2]型毒株基因组结构与衣壳蛋白功能研究
梁燕惠,高珺珊,薛亮*,王林平,孟洛冰,蔡伟程,李贻静,张菊梅,王涓,陈谋通,叶青华,吴诗,刘细霞,吴清平*
(1.湖北师范大学,生命科学学院食用野生植物保育与利用湖北省重点实验室,湖北黄石 435002)(2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,农业农村部农业微生物组学与精准应用重点实验室,广东广州 510070)
食源性诺如病毒(Norovirus,NoV)是导致世界范围内流行性和散发性急性胃肠炎的主要病原[1]。NoV传播途径广,主要通过粪-口途径传播,此外,进食被NoV 污染的食物是其重要传播途径之一[2]。通过食用在源头上被该病原污染的食物,如海鲜、浆果和沙拉等,或者在加工过程中被该病原污染的食品都可导致NoV 感染[3]。据估计,每年约有21.2 万人因感染NoV发病以致死亡,相关经济损失600 多亿美元[4]。
NoV 属于杯状病毒科,诺如病毒属,是一种极易变异且遗传多样性丰富的RNA 病毒[5]。根据主要衣壳蛋白的序列可将其分为10 个基因群,其中基因群GI、GII、GIV、GVIII 和GIX 均可感染人[6]。据统计,超过75%的人类急性胃肠炎病例由GII 基因群感染所致[7]。其中GII.4 在过去20 年内流行,并通过突变和重组不断演化,进而在NoV 流行中占据绝对优势地位[8]。但近年来,GII.17 等原非流行株开始突然暴发并不断引起食源性疫情[9-12],尤其GII.2 更是成为包括我国在内一些国家的主要流行基因型[13-15],给全球食品安全带来了新威胁。
我国是NoV 流行的主要地区之一[16],作者课题组研究表明,长期以来NoV 是我国华南地区重要的急性腹泻病原[17,18],同时在市售贝类、城市水体中均存在普遍的NoV 污染[19]。为深入了解NoV 流行进化机制以对其进行有效防控,本研究拟以团队前期获得的GII.2[P2]型GZ2015-L335 毒株为对象,对其基因组结构及衣壳蛋白功能进行分析和研究,以期为食品中NoV 快速检测方法建立及疫苗研发提供基础。
1 材料和方法
1.1 毒株和细胞
GII.2[P2]型GZ2015-L335 毒株来自作者团队前期广州地区急性腹泻临床样本并已分型鉴定;Sf9 昆虫细胞购自国家细胞资源平台;大肠杆菌DH10Bac和DH5α感受态细胞分别购自北京庄盟国际生物基因科技有限公司和宝日医生物技术(北京)有限公司。
1.2 质粒及试剂
GZ2015-L335-ORF2 质粒、载体pFastBac1、唾液样本收集自广东省科学院微生物研究所51 名健康志愿者并于前期完成表型鉴定;抗GII.2[P]衣壳P 颗粒血清为实验室前期制备[20];Prime STAR® Max DNA Polymerase、限制性内切酶BamH I 和SphI,宝日医生物技术(北京)有限公司;Western blot 快速封闭液、杆状病毒载体质粒提取试剂盒和BeyoECL Plus(超敏ECL 化学发光试剂盒),北京碧云天生物公司;10×PBST WB 漂洗液、异丙基-β-D-硫代半乳糖苷(Isopropyl-Beta-DThiogalactopyranoside,IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)、四环素、庆大霉素、卡那霉素、氨苄青霉素,上海生工生物工程股份有限公司;辣根过氧化物酶(Horse Radish Peroxidase,HRP)标记的Goat Anti Mouse IgG (H+L)、无血清培养基和昆虫细胞转染试剂,北京义翘神州科技股份有限公司;猪胃粘蛋白III 型,美国Sigma 公司;DL 5,000 DNA Marker 和Blue Plus®IV Protein Marker(10~180 kDa),北京全式金生物技术有限公司。
1.3 主要仪器设备
Bio-Rad Power Pac 基础电泳仪,美国伯乐公司;Tanon 凝胶成像系统,上海天能科技有限公司;DHP-9272型电热恒温培养箱,上海浦东荣丰科学仪器有限公司;GI-54TW 高压灭菌锅,美国ZEALWAY;电子天平,常熟市双杰测试仪器厂;JY92-IIDN 超声波细胞粉碎机,宁波新芝生物科技有限公司;BE-9008 微孔板恒温振荡器,海门市其林贝尔仪器制造有限公司;EPOCH2 酶标仪,美国Biotech 公司;HBS-4009 自动洗板机,南京德铁实验设备有限公司;BECKMAN Avanti J-301 高速冷冻离心机,美国Beckman Coulter 有限公司;Hitachi H-7650透射电子显微镜,日本HITACHI。
1.4 方法
1.4.1 基因序列分析
将毒株GZ2015-L335 核苷酸序列提交至GenBank数据库,并进行BLAST 在线比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),根据参考毒株对GZ2015-L335 基因组结构进行分析。同时,采用在线基因分型工具(http://www.rivm.nl/mpf/norovirus/typingtool)进行毒株基因分型。
1.4.2 重组pFastBac-GZ2015-L335 转座质粒的构建
根据GZ2015-L335 毒株的ORF2 区域设计特异性扩增引物,上下游引物分别加上酶切位点BamH I 和Sph(I下划线部分)。F:5'-CGGGATCC ATGAAGATGG CGTCGAATGA-3';R:5'-CATGCATGCTTATTGAACC CTTCTACGCC-3',由北京六合华大公司合成。以病毒基因组为模板扩增ORF2 序列,PCR 反应体系(50 μL):PrimeSTAR Max Premix(2×)25 μL,模板1 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 22 μL。PCR反应条件:95 ℃ 5 min;98 ℃ 30 s,55 ℃ 30 s,72 ℃,1 min,共3 个循环,72 ℃ 5 min。使用BamH I 和SphI分别对扩增产物及pFastBac 载体进行双酶切,连接酶切产物后将其转化至大肠杆菌DH5α感受态细胞,涂布于氨苄青霉素抗性琼脂平板后进行菌落PCR 筛选,将阳性克隆送至北京六合华大公司测序。
1.4.3 重组Bacmid-GZ2015-L335 质粒的构建
将测序正确的重组pFastBac-GZ2015-L335 质粒提取后转化大肠杆菌DH10Bac 感受态细胞,涂布于含X-gal (100 μg/mL)、IPTG (40 μg/mL)、卡那霉素(50 μg/mL)、四环素(10 μg/mL)和庆大霉素(7 μg/mL)的抗性平板上,37 ℃培养48 h 后,挑白色单菌落于LB抗性平板上划线,37 ℃过夜培养后,挑单菌落进行菌落PCR 验证,设定野生型杆状病毒为对照组。
1.4.4 重组杆状病毒构建和蛋白表达
从 PCR 验证正确的阳性菌株中提取重组Bacmid-GZ2015-L335 质粒,按照昆虫细胞转染试剂操作说明,将重组Bacmid-GZ2015-L335 质粒转染至Sf9昆虫细胞中,获得P1 代杆状病毒。将P1 代杆状病毒接种至Sf9 细胞中,获得P2 代杆状病毒。对病毒进行滴度测定后,当感染复数(Multiplicity of Infection)值为0.05~0.1 时,接种至Sf9 细胞并于27 ℃、150 r/min条件下表达48 h 后进行SDS-PAGE 分析。
1.4.5 超离纯化
收集细胞培养物7 000 r/min、4 ℃离心10 min,收集沉淀并用PBS 重悬,经超声破碎后,离心收集上清。上清用7%(m/V)PEG6000 和2%(m/V)的NaCl 沉降过夜,次日10 000 r/min、4 ℃离心30 min,收集沉淀,然后加入等体积浓度为1.4 g/mL 的CsCl 溶液并重悬于13.2 mL 的超离管中,288 000 r/min、8 ℃离心24 h,收集可见带,PBS 重悬后,141 000 r/min、8 ℃离心3 h 以去除CsCl 并收集沉淀。PBS 重悬沉淀即获得GZ2015-L335 VLP。
1.4.6 透射电镜观察
通过紫外分光光度计测定毒株GZ2015-L335 VLP蛋白浓度,经磷钨酸负性染色后,于40 000×透射电子显微镜下观察病毒样颗粒的形态及大小。
1.4.7 Western blot 鉴定
纯化的GZ2015-L335 VLP 经SDS-PAGE 电泳分离后,将其电转至聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜上,经Western blot 快速封闭液封闭15 min后,加入1:3 000 稀释的抗GII.2[P]衣壳P 颗粒血清4 ℃过夜孵育,次日用漂洗液漂洗3 次,每次10 min,加入1:3 000 稀释的HRP 标记的羊抗鼠IgG,37 ℃孵育1 h。用洗涤液漂洗3 次,条件同上,最后采用ECL 化学发光法对PVDF 膜进行显影。
1.4.8 ELISA 鉴定
将GZ2015-L335 VLP 浓度稀释为1 μg/mL,4 ℃包被过夜。次日用PBST 洗板3 次。5%脱脂奶37 ℃封闭2 h。PBST 洗板3 次,加入1:10 000 稀释的抗GII.2[P]衣壳P 颗粒血清,37 ℃孵育1 h。PBST 洗板4 次,将HRP 标记的羊抗鼠IgG 按1:3 000 稀释并加至板中,37 ℃孵育0.5 h。PBST 洗5 次。加入TMB 37 ℃避光孵育10 min。反应结束后,加入终止液。酶标仪上测定OD450值。OD450值>0.2 且至少为阴性对照的2 倍为判为阳性,同时设置PBS 为阴性对照。
1.4.9 受体结合功能验证
利用 NoV 结合组织血型抗原(Histo-Blood Groupsantigens,HBGAs)实验评估重组GZ2015-L335 VLP 与不同血型人唾液(A、B、O 和非分泌型)以及猪胃粘蛋白III 型(Pig Gastric Mucin Type III,PGM)的结合情况。将不同血型的唾液样本以1:1 000 稀释后,4 ℃包被过夜,5%(m/V)脱脂奶粉37 ℃封闭2 h,随后加入浓度为1 μg/mL 的GZ2015-L335 VLP,37 ℃孵育1 h,加入1:10 000 稀释的抗GII.2[P]衣壳P 颗粒血清,37 ℃孵育1 h。PBST 洗板4 次,将HRP 标记的羊抗鼠IgG 按1:3 000 稀释并加至板中,37 ℃孵育0.5 h。PBST 洗板5 次后,加入TMB 37 ℃避光孵育10 min。反应结束后,加入终止液。酶标仪上测定OD450值。设置PBS 为阴性对照,以PGM 包板作为阳性对照。
2 结果与讨论
2.1 毒株GZ2015-L335 基因序列分析
毒株 GZ2015-L335 基因组全长为 7 496 bp(GenBank 登录号为MK729086),包括3 个开放阅读框(Open Reading Frames,ORFs),分别位于5~5 104 bp,5 085~6 713 bp 和6 713~7 492 bp 处。其中,ORF1 与ORF2 存在重叠区域含有20 bp,而ORF2 与ORF3 重叠一个碱基A(图1)。在线分型工具分析结果表明毒株GZ2015-L335 属于GII.2[P2]基因型。

图1 毒株GZ2015-L335 基因组结构组成Fig.1 Genome composition of the norovirus strain GZ2015-L335
2.2 重组pFastBac-GZ2015-L335转座质粒和重组Bacmid-GZ2015-L335 质粒的构建及鉴定
将目的片段与表达载体连接后,转化至大肠杆菌DH5α感受态细胞中,利用抗性板筛选后进行测序分析。结果表明插入片段大小与序列均正确,重组转座质粒 pFastBac-GZ2015-L335 成功构建。接着将pFastBac-GZ2015-L335 重组质粒转化至大肠杆菌DH10Bac 感受态细胞,经抗性平板筛选后,进行PCR鉴定,结果如图2。可见扩增产物在约4 000 bp 处有单一明显条带,其大小与预期相符,表明重组Bacmid-GZ2015-L335 质粒已成功构建。

图2 重组质粒Bacmid-GZ2015-L335 的菌落PCR 鉴定Fig.2 Colony PCR identification of the recombinant plasmid Bacmid-GZ2015-L335
2.3 毒株GZ2015-L335 VLP 的表达及纯化
将重组Bacmid-L335 质粒转染至Sf9 昆虫细胞中,获得P1 代杆状病毒,将该病毒接种至Sf9 细胞中,获得P2 代杆状病毒。收集P2 代感染后的细胞,对重组蛋白提取纯化后,进行SDS-PAGE 电泳分析,由图3可见在约58 ku 处有较为清晰的条带,其大小与目的蛋白一致,在略低于目的蛋白下方出现蛋白条带,可能为GZ2015-L335 VLP 的N 端缺失部分氨基酸所致[21]。

图3 毒株GZ2015-L335 VLP 的SDS-PAGE 鉴定Fig.3 SDS-PAGE identification of the norovirus strain GZ2015-L335 VLP
2.4 毒株GZ2015-L335 VLP 的透射电镜观察
NoV 病毒样颗粒作为天然病毒的替代品,具有与天然病毒相似的形态结构和免疫原性,能够诱导宿主产生较高水平的免疫应答,被广泛应用于NoV 疫苗研发和抗体制备[22]。本研究中,通过透射电镜观察发现,纯化后的GZ2015-L335 VLP 可以形成直径约为30 nm的颗粒,与天然病毒粒子大小相近,表明其可自组装成病毒样颗粒[23]。
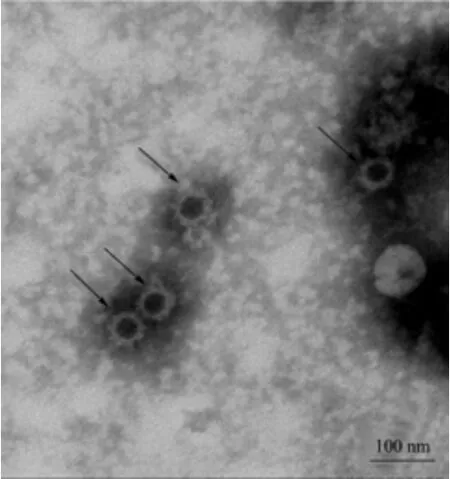
图4 毒株GZ2015-L335 VLP 的透射电镜观察(40 000×)Fig.4 Observation of the GZ2015-L335 VLP by transmission electron microscopy
2.5 毒株GZ2015-L335 VLP的Western blot鉴定
利用Western blot 对纯化后的GZ2015-L335 VLP进行鉴定。结果如图5,膜上在58 ku 处有特异性条带,而野生型杆状病毒感染组和正常的Sf9 细胞对照组都没有出现特异性条带,表明纯化得到的GZ2015-L335VLP 具有较好的反应原性和特异性。而在目标蛋白下方出现多条条带的原因可能是在制样过程中蛋白质发生了降解所致。

图5 毒株GZ2015-L335 VLP 的Western blot 鉴定Fig.5 Western blot identification of the norovirus strain GZ2015-L335 VLP
2.6 毒株GZ2015-L335 VLP 的ELISA 鉴定
采用间接ELISA 法,以抗GII.2[P]衣壳P 颗粒血清为一抗,HRP 标记的羊抗鼠IgG 为二抗对纯化后的VLP进行鉴定。ELISA 结果见图6,表明GZ2015-L335VLP与抗血清具有较高结合活性。

图6 毒株GZ2015-L335 VLP 的ELISA 鉴定Fig.6 ELISA identification of the norovirus strain GZ2015-L335 VLP
2.7 毒株GZ2015-L335 VLP 的受体结合功能验证
大量研究表明HBGAs 为NoV 的天然受体或协同因子[24,25],能促进病毒感染宿主细胞[26]。目前发现大多数NoV 基因型的受体结合模式相似,即与A/B/O 分泌型受体结合,而与非分泌型受体不结合[27,28]。本研究将39 份分泌型(A、B、O 和AB)和12 份非分泌型(N)唾液样品用于分析GZ2015-L335 VLP 与HBGAs的结合情况。受体结合功能实验结果表明,重组GZ2015-L335VLP 与A/B/O 等分泌型及非分泌性唾液受体均呈现广泛的结合作用,表现出广泛的受体结合谱(图7)。Michael 等[29]通过对比新现株GII.2[P16]和祖先株GII.2[P2](即雪山病毒)的进化过程,发现两者衣壳蛋白序列相似性>96%,两种毒株的受体结合谱也相似,并且体外受体结合阻断实验也显示衣壳蛋白的轻微变异未对抗体中和作用造成影响。因此,NoV可通过多种机制在人群中持续流行,除衣壳蛋白变异造成受体结合能力及免疫原性变化外,基因重组也已成为重要驱动力[30]。

图7 毒株GZ2015-L335 VLP 的受体结合功能验证Fig.7 Receptor binding function of the norovirus strain GZ2015-L335 VLP
3 结论
近年来,食源性GII.2 型NoV 逐渐成为中国及其他国家NoV 暴发流行的主要基因型之一[31-35]。系统掌握GII.2 型NoV 进化机制是防控该基因型病毒流行的重要基础,因此本研究以2015 年在广州地区检出的GII.2[P2]型GZ2015-L335 毒株为对象,对其基因组结构进行系统分析。此外,利用昆虫细胞杆状病毒表达系统成功制备GII.2[P2]型VLP,并对其免疫原性和受体结合功能进行了系统研究。SDS-PAGE 结果表明,重组GII.2[P2]型VP1 蛋白大小与预期相符。透射电镜结果表明,该VP1 蛋白可自组装成VLP,其形态大小与天然病毒粒子相似。Western blot和ELISA 结果显示,该VLP 与抗GII.2[P]衣壳P 颗粒血清具有较高结合活性,表明其具有良好的反应原性和特异性。此外,受体结合实验结果显示,该VLP 与A/B/O 等分泌型及非分泌性唾液受体均呈现广泛的结合作用,表现为人群普遍易感。综上所述,本实验结果将为食品中NoV 的高效抗体研制及新型检测技术研发提供支撑,同时也为进一步揭示病毒的流行机制和监测该毒株的变异特点提供理论数据。

