热处理对酸马奶中蛋白质稳定性的影响
孟岳成,黃阮卿,陈杰,李延华,汪振涛,仝静雯
(浙江工商大学食品与生物工程学院 杭州 310018)
酸马奶(Koumiss)主要是由乳酸菌、乳糖发酵酵母、非乳糖发酵酵母三大类微生物协同发酵新鲜马乳而来,其风味独特,常食用酸马奶可以降血脂,调节肠道菌群,改善肺结核、贫血、中风等疾病[1-3]。酸马奶的生产加工方式较传统,冷藏过程中后酸化和后苦味现象严重,货架期明显短于普通酸奶,运输与销售成本较高,难以推广。
热处理通常用于控制有害微生物的生长繁殖以延长产品货架期。然而,研究表明,在加热过程中,对热敏感的乳清蛋白含量明显降低,这些蛋白会与酪蛋白或者乳脂小球变性并聚集在一起[4-5]。温度高且时间长的热处理会导致产品褐变、蛋白质大量沉淀等不稳定现象的发生,不同来源的乳因主要营养成分含量及比例的不同而对热敏感性有所差异。目前,对乳制品中蛋白质的热稳定性研究较多,如Kelleher 等[6]研究发现高于70 ℃的热处理会导致反应性官能团暴露,易与酪蛋白胶束表面的其它蛋白反应,形成乳清蛋白聚集体等复合物。而在乳制品中加入酪蛋白,可以形成酪蛋白-乳清蛋白聚集体,从而提高乳制品的热稳定性。Luo 等[7]研究发现,酪蛋白和乳清蛋白的稳定性几乎决定驴乳的热稳定性。驴乳中酪蛋白胶束较乳清蛋白对热敏感。Zhao 等[8]研究发现,山羊奶的热处理温度高于85 ℃时,乳清蛋白易发生形态损伤且规则结构数量随热处理时间的延长而逐渐减少,大量乳清蛋白变性。然而,热处理对常温酸乳制品中蛋白质稳定性的影响研究报道较少,且关于酸马奶还未见报道。
马乳中含有的化学成分及生物活性物质与母乳极其相似,且其高浓度的乳清蛋白含量使马乳比牛乳更适宜作为营养来源[9]。传统发酵酸马奶在热处理过程中体系的蛋白质会发生变化,影响其聚集方式和程度,进而影响体系的稳定性。本研究选择低温长时巴氏杀菌和酸乳热处理的方式对酸马奶进行热加工,测定其相关指标,并分析其蛋白质二级结构的变化,旨在揭示热处理所致酸马奶蛋白质稳定性的变化规律,为进一步研究其蛋白质结构的多样性以及工业化生产提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 酸马奶,内蒙古中蕴马产业发展有限公司;十二烷基硫酸钠、过硫酸铵、四甲基乙二胺、丙烯酰胺(30%),美国BIO-RAD 公司;Tris、甘氨酸、考马斯亮蓝,美国Amresco 公司。以上试剂均为分析纯级。牛血清白蛋白,瑞士Roche 公司;双色预染蛋白Marker,上海生工生物工程股份有限公司;溴化钾(光谱级),上海麦克林生化科技有限公司。
1.1.2 主要仪器与设备 DELTA-320 精密pH计,梅特勒-托利多国际贸易(上海)有限公司;HH-4 数显恒温水浴锅,常州国华电器有限公司;NANO ZS90 马尔文纳米粒度电位仪,英国马尔文仪器有限公司;UV-2600 紫外分光光度计,日本岛津公司;3K30 低温高速离心机,德国SIGMA 公司;变性梯度凝胶电泳仪,美国BIO-RAD 公司;GelDoc 2000 凝胶成像仪,伯乐生命医学产品(上海)有限公司;K775X 高真空冷冻干燥仪,英国Quorum 公司;Nicolet 6700 傅里叶变换红外光谱仪,美国Thermo Fisher 公司。
1.2 试验方法
1.2.1 酸马奶的热处理 以30 ℃、200 bar 均质的酸马奶为研究对象,热处理条件:65 ℃/30 min低温长时巴氏杀菌,75 ℃/15 min,83 ℃/10 min 和90 ℃/5 min 酸乳热处理。参考Li 等[10]的方法并稍作修改,具体操作:将酸马奶分装于试管(Ф10×150 mm)中,试管口用封口膜密封,将试管浸于沸水浴中至样品中心温度达到所需温度,迅速取出,置于该温度的水浴中,分别保持30,15,10,5 min后冰水浴快速冷却至4 ℃,以未作热处理的酸马奶为对照组。
1.2.2 悬浮、沉淀及乳清样品制备 参考Xiong 等[11]的方法并稍作修改,具体操作:热处理前、后酸马奶样品经4 ℃、10 000×g 高速离心30 min,弃脂肪层,分别收集悬浮上清液和沉淀物质,将沉淀物在与原取样液等量的超纯水中重新分散均匀,备用。取适量悬浮上清液,用1.0 mol/L 碳酸钠溶液调整其pH 值至4.6,沉淀酪蛋白及所有变性的乳清蛋白,4 000 r/min 离心15 min 除去沉淀,经0.45 μm水系微孔滤膜过滤,得到乳清样品。
1.2.3 酸马奶酸度的测定 酸马奶酸度采用0.1 mol/L NaOH 标准溶液滴定测得,以吉尔涅尔度表示[12]。
1.2.4 酸马奶pH 值的测定 pH 值使用精密pH计测定。
1.2.5 酸马奶黏度的测定 采用NDJ-5S 数显黏度计测定,选择1 号转子,60 r/min 转速保持30 s,待数值稳定后读取。
1.2.6 酸马奶ζ-电位的测定 ζ-电位按照Ziaefar 等[13]的方法测定。
1.2.7 离心上清液蛋白质含量的测定 采用考马斯亮蓝染色法测定[14]。
1.2.8 SDS-PAGE 参考Pan 等[15]的方法并稍作修改进行SDS-PAGE。选用5%的浓缩胶和12%的分离胶,采用5×Tris-甘氨酸电泳缓冲系统。凝胶电泳初始电压设定为70 V,经30 min 或染色条带刚经过浓缩胶与分离胶的分界线时,调整电压为110 V,样品电泳至胶底部时结束。考马斯亮蓝R-250 摇床染色2~3 h,然后,用醋酸-乙醇溶液(V无水乙醇∶V乙酸∶V水=25∶8∶67)摇床脱色过夜至背景清晰后置凝胶成像系统中扫描拍摄。
1.2.9 乳清蛋白变性率的测定 根据乳清蛋白氮指数(WPNI)的方法原理测定[16]。采用考马斯亮蓝法测定乳清样品中未变性乳清蛋白含量,即WPNI,计算方法见公式(1)。
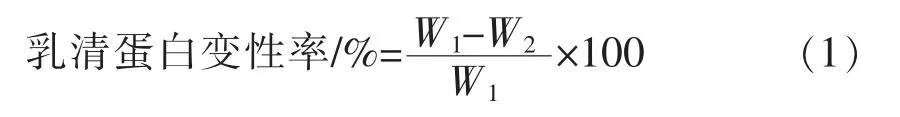
式中:W1——原酸马奶的WPNI/(mg/mL);W2——热处理酸马奶的WPNI/(mg/mL)。
1.2.10 红外光谱分析 将酸马奶离心脱脂后冷冻干燥呈细粉末状,取粉末(约1 mg)与干燥的色谱级溴化钾(约200 mg)在玛瑙研钵中充分研碎、研匀,压制成均匀透明或半透明薄片。傅里叶变换红外光谱仪测定前,先扣除背景吸收,设定条件:扫描波段4 000~400 cm-1,分辨率4 cm-1,扫描32次。使用PeakFit Version 4.0 软件对特征谱带进行基线校正、斯托克斯平滑和去卷积处理,二阶导数高斯(Gaussian)拟合后分析蛋白质的二级结构[17]。
1.3 数据统计分析
以上试验均重复3 次,结果表示为“平均值±标准偏差”。采用Origin 9.0 软件作图,采用SSPS 19.0 进行单因素方差分析(Duncan 新复极差检验法,显著水平P<0.05)。
2 结果与分析
2.1 热处理对酸马奶酸度、pH 值、黏度和ζ-电位的影响
表1 列出不同热处理的酸马奶酸度、黏度和ζ-电位的变化情况。热处理后酸马奶的吉尔涅尔度和pH 值无显著变化(P>0.05),而黏度和ζ-电位变化显著(P<0.05)。随着热处理温度的升高,黏度呈上升趋势,这可能与酸马奶蛋白间交联度增强有关;加热引起酸马奶乳清蛋白变性,其与酪蛋白胶束缔合,影响胶束间的相互作用,随着变性程度增加,黏度增加[18]。随着热处理温度的增强,ζ-电位呈先增大后减小的趋势,其中83 ℃/10 min 时的ζ-电位达到最大值27.1 mV,而90 ℃/5 min 时显著降至25.9 mV,这可能是因为酸性条件下,适当热处理,κ-酪蛋白与乳清蛋白结合成稳定的可溶性β-乳球蛋白-κ-酪蛋白复合物,导致胶体表面电势增加[19];而表面电势降低推测为,温度较高的热处理引起κ-CN 解离,酪蛋白胶束形成不规则复合体,这可能也与酸马奶中酪蛋白具有特殊的海绵状结构,且蛋白质含量低于牛奶、羊奶、骆驼奶等有关[20-21]。
根据Stokes 定律,悬浮体系中颗粒的沉降速率与黏度呈反比,同时,ζ-电位可以衡量蛋白胶束间静电作用的强弱,其绝对值越高,越有利于体系稳定[22]。由表1 可知,在65~83 ℃对酸马奶进行适当时长的热处理,能提高其蛋白质的稳定性,而在90 ℃热处理会减弱其稳定性。

表1 不同热处理对酸马奶酸度、pH 值、黏度和ζ-电位的影响Table 1 Effect of different thermal treatments on acidity,viscosity and ζ-potential of koumiss
2.2 热处理对酸马奶蛋白质悬浮稳定性的影响
乳蛋白的悬浮稳定性可用高速离心上清液蛋白质含量和组成变化来表示,见图1 和图2。由图1 可知,热处理后的酸马奶相比未处理的酸马奶离心上清液蛋白质含量显著增加(P<0.05)。热处理后蛋白悬浮性增强的原因可能是该条件下蛋白质凝聚颗粒不大,而适当变性的乳清蛋白与酪蛋白交联提高了体系的黏度,同时在疏水基团没有完全暴露的情况下,静电斥力仍大于凝聚力,起到悬浮稳定的作用。结果表明适当的热处理能提高酸马奶蛋白质的悬浮稳定性。
由图2 可知,经不同的热处理后,酸马奶中蛋白质整体条带数量及α-乳白蛋白(α-lactalbumin,α-LA)条带颜色未发生明显变化,其余组分条带颜色变化明显,主要表现在沉淀蛋白质中的β-乳球蛋白(β-lactoglobulin,β-LG)条带颜色有所加深,悬浮上清液中的所有酪蛋白条带颜色深浅变化更加明显;沉淀部分酪蛋白条带颜色随热处理温度的增强而变浅,悬浮液中乳清蛋白条带未发生明显变化。表明在酸马奶本身特定的环境中,经热处理,酪蛋白胶束颗粒的悬浮稳定性提高,而β-LG 聚集程度增加并形成沉淀。结合图1,进一步说明其酪蛋白悬浮增量大于乳清蛋白沉淀量。这与Fang 等[23]的研究结果相似,即热处理后β-LG 的变化最为明显,较其它蛋白对热更加敏感。热处理过程中一部分β-LG 与酪蛋白交联,促进了酪蛋白的悬浮稳定性;另一部分通过二硫键和疏水相互作用不断聚集成大颗粒,导致沉淀增加[24]。
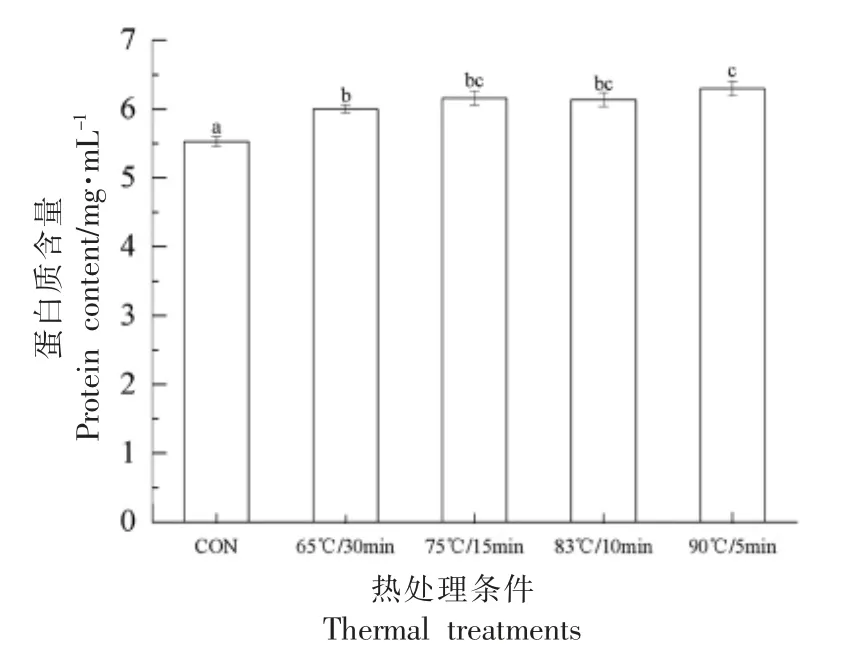
图1 热处理对酸马奶离心上清液蛋白质含量的影响Fig.1 Effect of thermal treatment on protein content of centrifugal supernatant

图2 不同热处理酸马奶的离心沉淀和上清液蛋白质组成Fig.2 The koumiss protein composition in centrifugal precipitation and supernatant under different thermal treatment conditions
2.3 热处理对酸马奶乳清蛋白变性的影响
热处理对酸马奶乳清蛋白组成及变性率的影响分别见图3 和图4。由图3 可知,热处理后,酸马奶乳清蛋白组分中的乳铁蛋白(lactoferrin,LF)条带基本消失,表明乳铁蛋白对热十分敏感。通过光密度分析,α-LA 无明显变化,β-LG 条带颜色与面积随热处理温度的增强逐渐降低,90 ℃/5 min处理后β-LG 基本消失。结果表明酸马奶的α-LA具有较好的热稳定性,能耐受90 ℃的高温,这可能与酸马奶本身特殊的环境有关,其较低的pH值和较高的乳清蛋白与酪蛋白比例提高了α-LA的热稳定性。有研究发现,乳清蛋白在酸性环境中的热稳定性较好[25]。而β-LG 对热敏感,在90 ℃时基本变性,此时更趋向于自身聚集沉淀。由图4 可知,4 种热处理方式对酸马奶中乳清蛋白的影响存在显著性差异(P<0.05),随着热处理温度的增强,变性率分别为38.52%,40.88%,50.94%,69.03%,呈加速增大的趋势,90 ℃/5 min 的热处理严重破坏了乳清蛋白的稳定性。
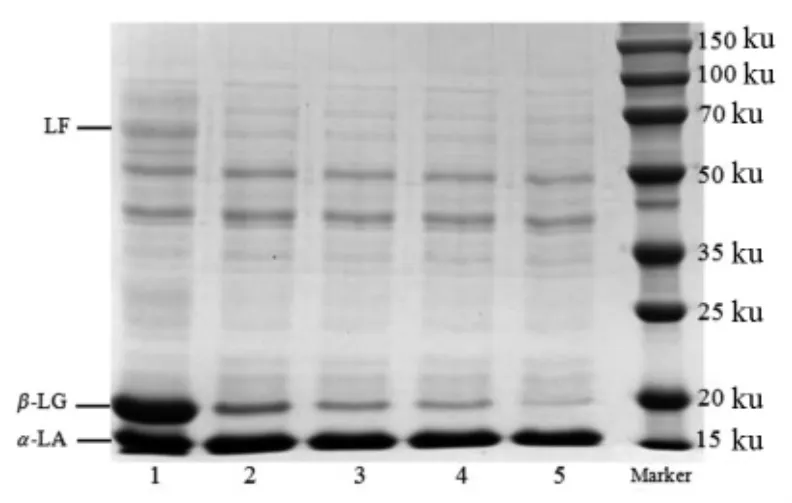
图3 不同热处理酸马奶的乳清蛋白组成Fig.3 The whey protein composition of koumiss under different thermal treatment conditions

图4 不同热处理条件下酸马奶乳清蛋白的变性率Fig.4 The denaturation rate of koumiss whey protein under various thermal treatment conditions
2.4 热处理对酸马奶蛋白质二级结构的影响
图5 所示不同热处理后酸马奶蛋白质的红外谱图。蛋白质的特征吸收峰出现在3 400 cm-1和1 650 cm-1附近,分别表示O-H、N-H 的伸缩振动和C=O 的伸缩振动,这与Markoska[26]、Guo 等[27]的研究结果基本相同。不同热处理的酸马奶蛋白质红外谱图总体无较大差异,然而,3 400 cm-1附近的特征吸收峰出现不同方向的位移,说明酸马奶蛋白质热处理后分子内和分子间氢键在发生变化,这可能是其二级结构之间相互转化与结合水的变化所致[28]。1 700~1 600 cm-1范围的特征吸收峰随热处理强度的提高向低波数方向移动,具体表现为65 ℃/30 min 处理后红移1.85 cm-1,75 ℃/15 min 和83 ℃/10 min 分别比前一次热处理再红移0.31 cm-1和1.14 cm-1;90 ℃/5 min 热处理酸马奶蛋白特征峰从1 657.11 cm-1红移至1 654.80 cm-1,较83 ℃/10 min 蓝移约0.7 cm-1。可以推测,波数的移动主要由乳清蛋白变性引起,热处理使具有明确二级结构的不耐热乳清蛋白变性,主要表现在有序二级结构(主要结构为β-LG)减少,由此导致羰基电子云密度下降,吸收峰红移[29]。更高强度的热处理使乳清蛋白大量变性,β-LG 热聚集达一定程度时,分子间氢键减弱,吸收峰蓝移。
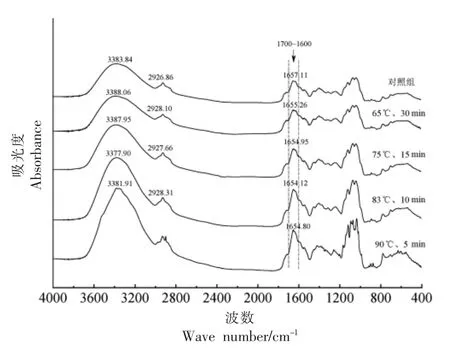
图5 不同热处理酸马奶蛋白的FT-IR 谱图Fig.5 FT-IR spectra of the koumiss protein in different thermal treatment degree
由表2 可知,未热处理酸马奶蛋白质4 种二级结构含量分别占31.90%,34.59%,18.64%,14.87%,α-螺旋和β-折叠含量接近1∶1,无规卷曲含量最低。热处理后各二级结构含量与对照组均产生显著性差异(P<0.05),α-螺旋含量随热处理程度的提高从31.92%降至17.01%;β-折叠显著增加,最高含量达45.02%。分析其原因,乳清蛋白内部折叠区域常存在较多的β-折叠结构,热处理引起乳清蛋白变性,α-螺旋不断展开,内部区域暴露[30];其次,变性乳清蛋白与酪蛋白胶束表面的κ-CN 通过二硫键结合,可能形成不同的β-折叠片段。此外,90 ℃/5 min 热处理的酸马奶蛋白质β-折叠含量为42.52%,较83 ℃/10 min 时有所降低,而无规卷曲显著增至22.44%,表明在较高强度的热处理条件下,乳清蛋白变性程度急剧增大,疏水基团严重暴露,β-LG 形成更大的热聚集体,部分β-折叠再次被包裹。从以上结果推断,不同热处理过程中β-折叠比例变化对酸马奶蛋白热聚集体的聚集程度有重要影响,而蛋白热聚集体达到一定量时,不利于贮藏稳定性。
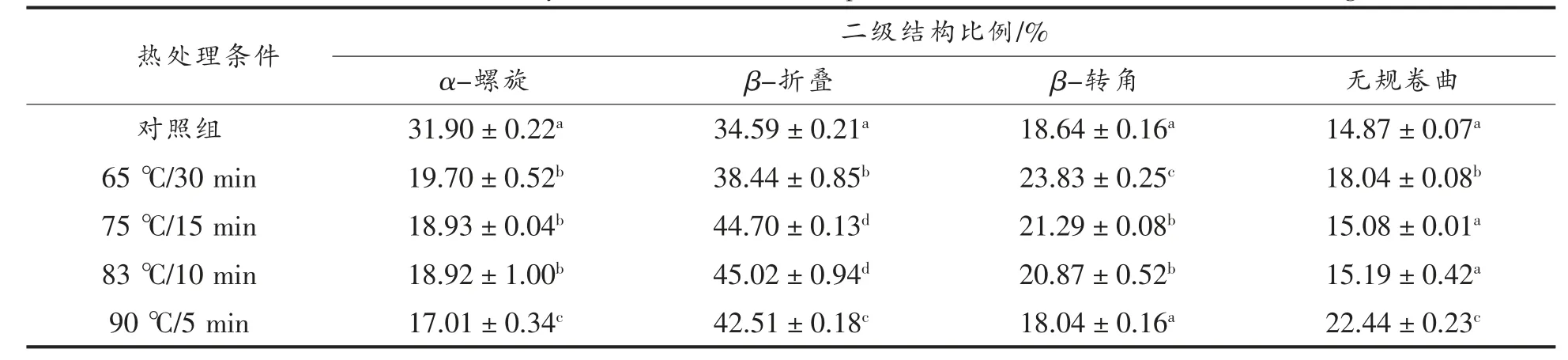
表2 不同热处理的酸马奶蛋白质二级结构的比例Table 2 Estimated secondary structures of koumiss protein in different thermal treatment degree
3 结论
酸马奶在热加工过程中,酸度和pH 值未发生显著变化的情况下,热处理能增加体系的黏度和ζ-电位,提高蛋白质悬浮稳定性。与未热处理相比,热处理后的酸马奶乳清蛋白变性程度和蛋白质二级结构均发生显著变化,其中β-LG 分子内氢键被破坏,α-螺旋结构逐渐展开,比例降低,蛋白质发生不同程度的热聚集。β-折叠的比例变化对于酸马奶蛋白热聚集体聚集程度具有重要影响,随着热处理程度的增加,酸马奶蛋白质ζ-电位、离心悬浮量和β-折叠比例均呈先增加后降低的趋势,90 ℃/5 min 的热处理引起β-LG 大量变性,无规卷曲比例显著增加,β-LG 更趋向于自身聚集沉淀,不利于其贮藏过程中的稳定。在实际生产中,考虑酸马奶蛋白质组成的特殊性,研发相关酸马奶产品时建议尽可能选择低于90 ℃的热处理条件,既能提高稳定性,又能避免引起不必要的损失。

