基因转录介导同质园条件下拟南芥不同地理种群的光合能力分化
李梦烁 刘莹泽 鲁 焕 强 胜
(南京农业大学生命科学学院,南京 210095)
光合作用是植物最重要的生理过程,也是地球上生命能量的关键来源[1]。植物通过光合作用将太阳能转化为其生长发育所需的化学能。光合作用的强弱不仅反映出植物本身的生长发育水平,而且直接关系到其产量与品质[2]。植物的光合能力受环境条件的影响,其生长地的光照强度、温度、水分、CO2浓度等均会影响光合效率。研究表明不同生存环境下,植物的光合能力呈现差异性。而同一环境条件下,不同植物的光合能力也有很大差异,其光合能力可相差几十倍[3-4]。不同物种间呈现出的光合能力差异可能是由于叶片中光合酶的含量与活性、CO2的扩散、光合结构中氮分配差异导致的[5],主要受内在遗传差异和外在环境两方面的影响。另外,在相同环境中,同种植物不同种群间也存在光合能力分化。张贵合等[6]研究发现在相同生态条件下,不同马铃薯(Solanum tuberosum)品种(系)间的光合性状存在明显差异。同样,小麦(Triticum aestivum)、水稻(Oryza sativa)不同品种(系)间的光合能力也有明显分化[7-9]。在同质园条件下,排除环境因子对于不同种群光合能力的影响,同种植物表现出的光合能力分化可能是其不同种群内在的遗传多样性导致的。
光合作用过程包括光反应和暗反应2个阶段。有研究揭示了光合作用过程是由3 万种不同的光合作用驱动蛋白共同协调进行的,这些蛋白质由一整套核编码基因组成[10]。这些基因编码的大量蛋白酶用于调控2个最重要的光合作用步骤:光合电子传递(Electron transfer)和卡尔文循环(Calvin-Benson Cycle,CB Cycle)[11]。光合作用不同组分之间联系紧密,改变其中1个基因的表达水平可能导致其他大量光合基因表达模式的同时改变,最终影响植物的光合效率[12]。拟南芥(Arabidopsis thaliana)中psa2基因编码DNAJ-like 锌指蛋白,其突变体严重抑制了植株生长,叶绿素含量也发生了明显下降。psa2可能影响了下游一系列基因的表达,从而影响拟南芥的光同化和叶绿体发育[13]。核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,Rubisco)是 限制暗反应速率的最重要的酶之一,主要在CB 循环中对CO2进行固定。Yoon 等[14]发现在不同温度下的拟南芥种群间Rubisco 小亚基编码基因RbcS的相对表达量有很大差异,推断Rubisco 对环境的适应可能是由其小亚基编码基因RbcS之间的相对表达水平决定。目前,光合作用的分子机理已较为清晰,调控各进程的基因也在多个物种中被发现并验证。但是,何种基因调控了同质园条件下同种植物呈现出的光合能力分化仍不清楚。本研究利用模式植物拟南芥为研究材料,首先对其在同质园条件下的光合能力进行测定,揭示其光合能力分化规律。进一步利用荧光定量PCR 检测光合相关基因的表达水平,以探究影响同质园中拟南芥光合能力分化的基因转录调节机制。
1 材料与方法
1.1 试验材料
本试验使用的23个拟南芥种群的种子购于拟南芥生物资源中心(ABRC,https://abrc.osu.edu/researchers)。将23 个不同生态型的拟南芥种子消毒后春化处理3 d,移栽到泥炭土和蛭石按体积比1∶3 混合的培养土基质中,在温度22 ℃、相对湿度约70%、16 h光照/8 h黑暗条件下培养。所有试验均在28~30 d植株完全展开的莲座叶上进行。
1.2 试验设计
1.2.1 气体交换参数的测量
使用便携式光合仪(Li-6400,美国)测定23 个拟南芥种群幼苗的气体交换参数,包括净光合速率(Pn)、蒸腾速率(Tr)和水分利用效率(WUE)。测定时间为09:30—11:30和14:00—16:00,幼苗在光合有效 辐 射(PAR)为500 μmol·m-2·s-1条 件 下 预 适 应30 min。参考CO2摩尔分数为350 μmol·mol-1,PAR为500 μmol·m-2·s-1,叶温22 ℃。每个种群设8次重复。
1.2.2 叶绿素荧光参数的测定
使用Imaging-PAM(MAXI-version,德国)测定23个拟南芥种群幼苗的的叶绿素荧光参数。所有试验材料在25 ℃的黑暗条件下适应30 min,Imaging-PAM 的测量光、光化光和饱和脉冲光的强度分别为0.25、110、6 000 μmol·m-2·s-1。在测量光和饱和脉冲光下测得最小荧光产量(Fo)和最大荧光产量(Fm),40 s 后打开光化光进行荧光诱导,测得稳态荧光(Fs)之后再进行饱和脉冲光处理,一个脉冲关闭后,得到光化光下的最大荧光(Fm′)。之后每隔20 s 进行1 次饱和脉冲光处理,持续时间为0.8 s,整个测量时间为315 s。通过Imaging-Win(Walz,德国)自动计算获得其PSⅡ有效光量子效率(YⅡ)、电子传递效率(RET)、PSⅡ调节性能量耗散的量子产量(YNPQ)、PSⅡ非调节性能量耗散的量子产量(YNO)、非光化学猝灭(QNP)、非光化学淬灭系数(QN)、稳态光适应光化学淬灭系数(QP)及基于Lake model 的稳态光适应光化学淬灭系数(QL)等参数[13]。除YⅡ仅有一个值外,各参数均以最后3 次数值的平均值作为最终结果,每个种群设10次重复。
1.2.3 相对叶绿素含量的测定
使用叶绿素仪(Chlorophyll Meter SPAD-502,德国)测定叶绿素相对含量(SPAD),每个种群选取4株,每株选取3个叶片。
1.2.4 光合作用相关基因的RT-qPCR检测
根据气体交换参数的测定结果,选择4个典型种群(En-D、Stw-0、Wa-1 和Per-1)进行实时定量PCR(RT-qPCR)测定。取4 周植物幼苗的叶片样本,使用植物RNA 提取试剂盒(TaKaRa Bio Inc.,日本)进行RNA 提取。对RNA 样品质量及浓度进行检测后,使用带有gDNA Eraser 的PrimerScriptTMRT 试剂盒(TaKaRa)进行反转录。使用Mastercycler ep realplex Real-time PCR System(Eppendorf,Germany)进行RT-qPCR 试验,体系为20 μL,包括10 μL SYBR Green(TaKaRa)、正向和反向引物各125 nmol·L-1(见表1)和10 ng cDNA。反应步骤:95 ℃3 min,40 个循环(95 ℃15 s,60 ℃30 s)。熔解曲线(60~95 ℃)在PCR 反应之后进行。Rubisco基因(RbcS1A、RbcS1B、RbcS2B和RbcS3B)的引物参考Izumi 等[15]。其余引物由在线引物设计工具(IDT PrimerQuest Tool,https://sg.idtdna.com/PrimerQuest/)设计。所有引物对的扩增效率均为90%~110%。管家基因为actin基因,使用2-ΔΔCt法计算相对表达水平[16]。
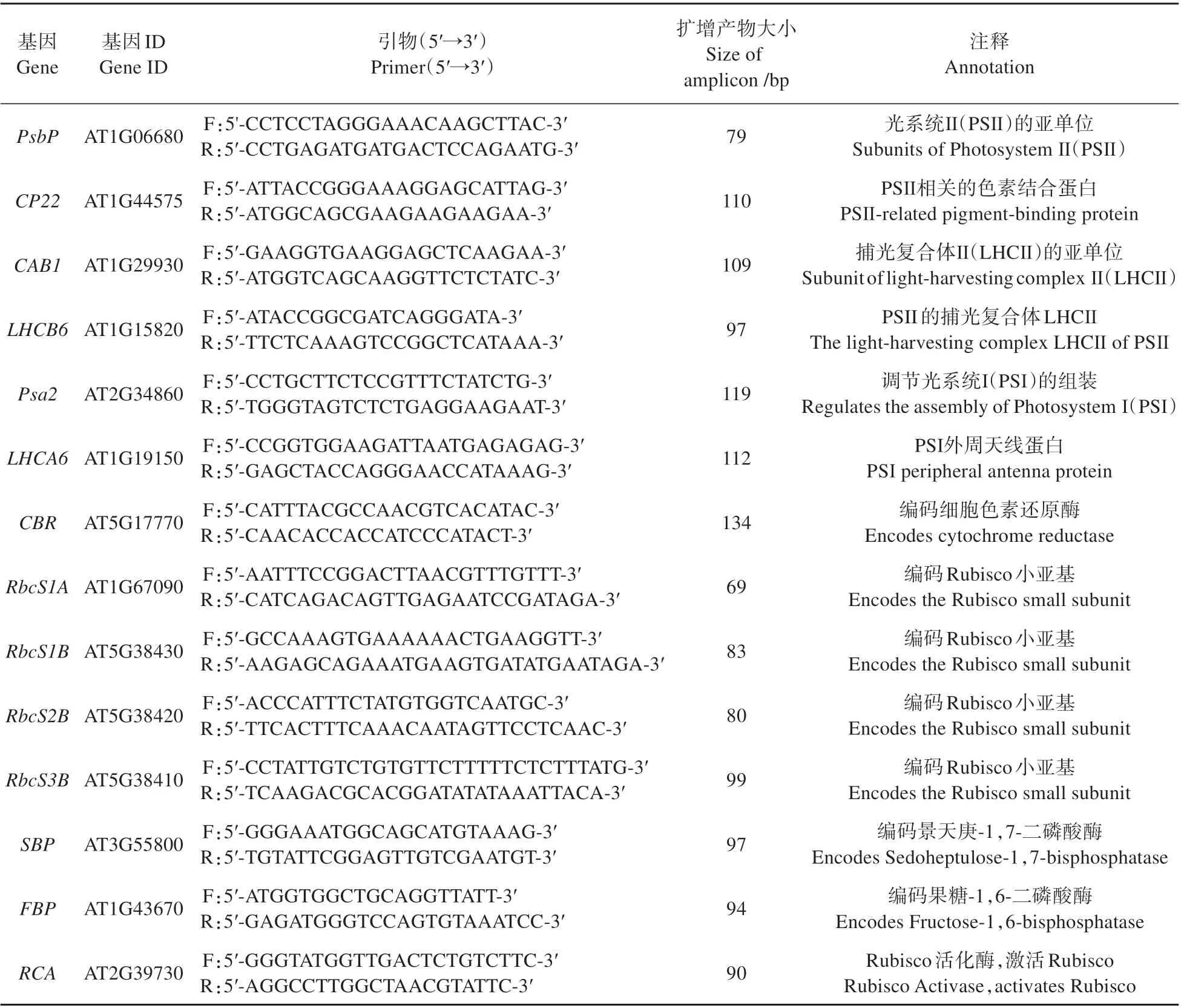
表1 RT-qPCR的引物对信息Table 1 Information of primer pairs used for RT-qPCR experiments
1.3 统计分析
使用R软件中的Vegan以欧氏距离进行聚类分析、光合作用和环境因素(地理信息、气候因素和太阳能辐射)的冗余分析(RDA)以及主成分分析(PCA),其中气候数据来自DIVA-GIS(http://www.diva-gis.org/climate)、太阳能辐射来自WorldClim(https://worldclim.org/data)。使用GraphPad Prism(version 9,USA)通过t检验分析组Ⅰ和Ⅱ之间气体交换参数的显著性差异。使用GraphPad Prism 的单因素方差分析(ANOVA,Duncan post-host)分析全部种群间气体交换参数的显著性差异和4 个拟南芥种群(En-D、Stw-0、Wa-1 和Per-1)中的基因表达水平的显著性差异并作图。用SPSS 22.0 软件进行相关性分析(P<0.05表示显著相关)。
2 结果与分析
2.1 23个拟南芥种群的光合能力指标
本试验测定了23 个拟南芥种群的气体交换参数和叶绿素荧光参数,种群详细信息及测定结果如表2。净光合速率为2~11 μmol·m-2·s-1,变异系数为40.30%。其中,净光合速率最低的种群 是Aa-0,为2.38 μmol·m-2·s-1,最 高 的 种 群 是Hs-0,为11.03 μmol·m-2·s-1。水分利用效率变异幅度与净光合速率相似,为40.61%。除此之外,各种群之间其他光合能力指标变异系数较小,尤其是叶绿素荧光参数,变异幅度几乎不超过10%,说明拟南芥光合能力的分化可能与电子传递的关系较小。Pn是反映植物光合能力的重要指标,相关性分析发现净光合速率与水分利用效率和叶绿素相对含量有显著相关性(见表3),证明拟南芥光合能力可能与叶绿素含量和水分利用效率有关。
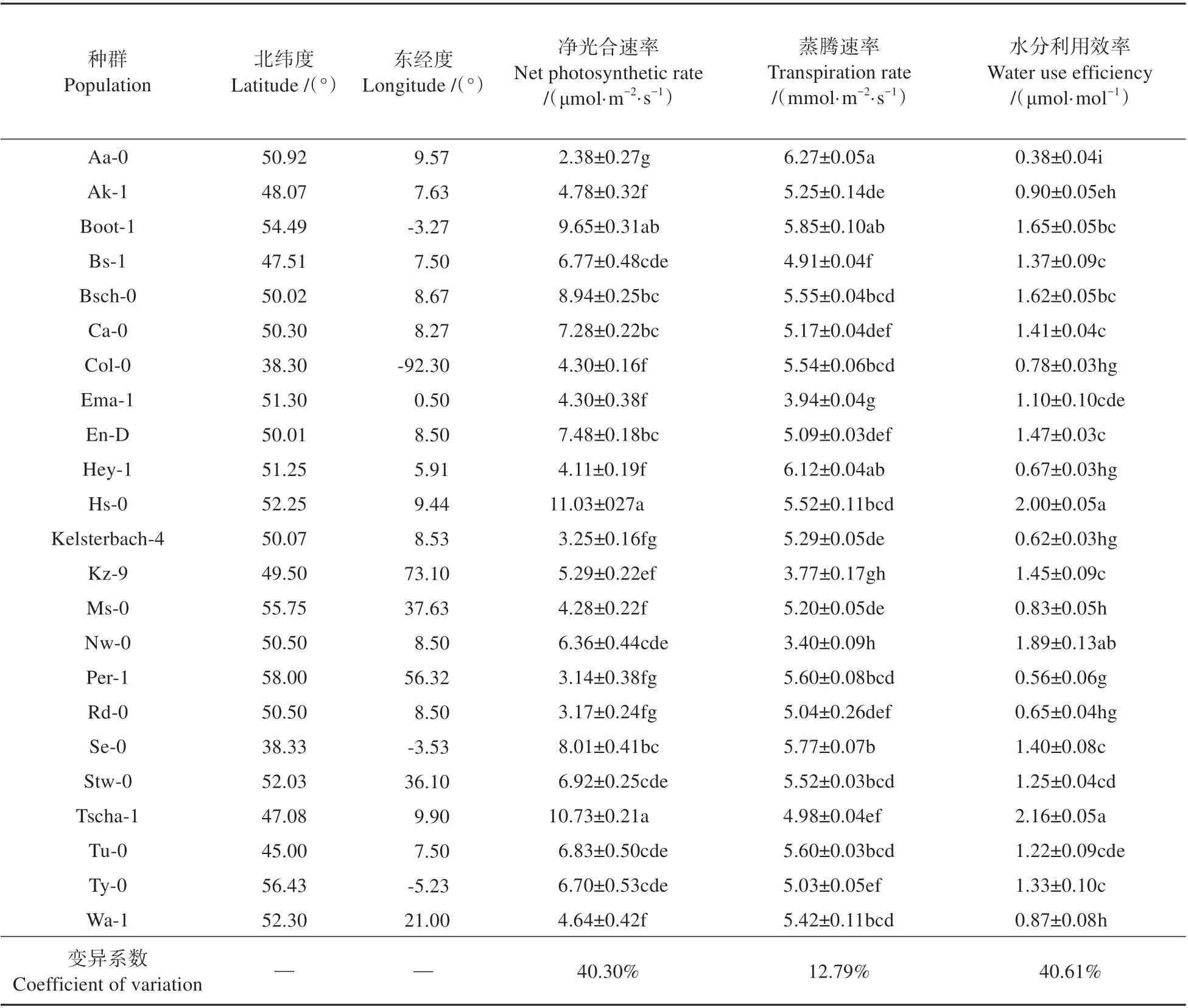
表2 23个拟南芥种群的气体交换参数及经纬度Table 2 Gas exchange parameters,longitude and latitude of the 23 Arabidopsis populations
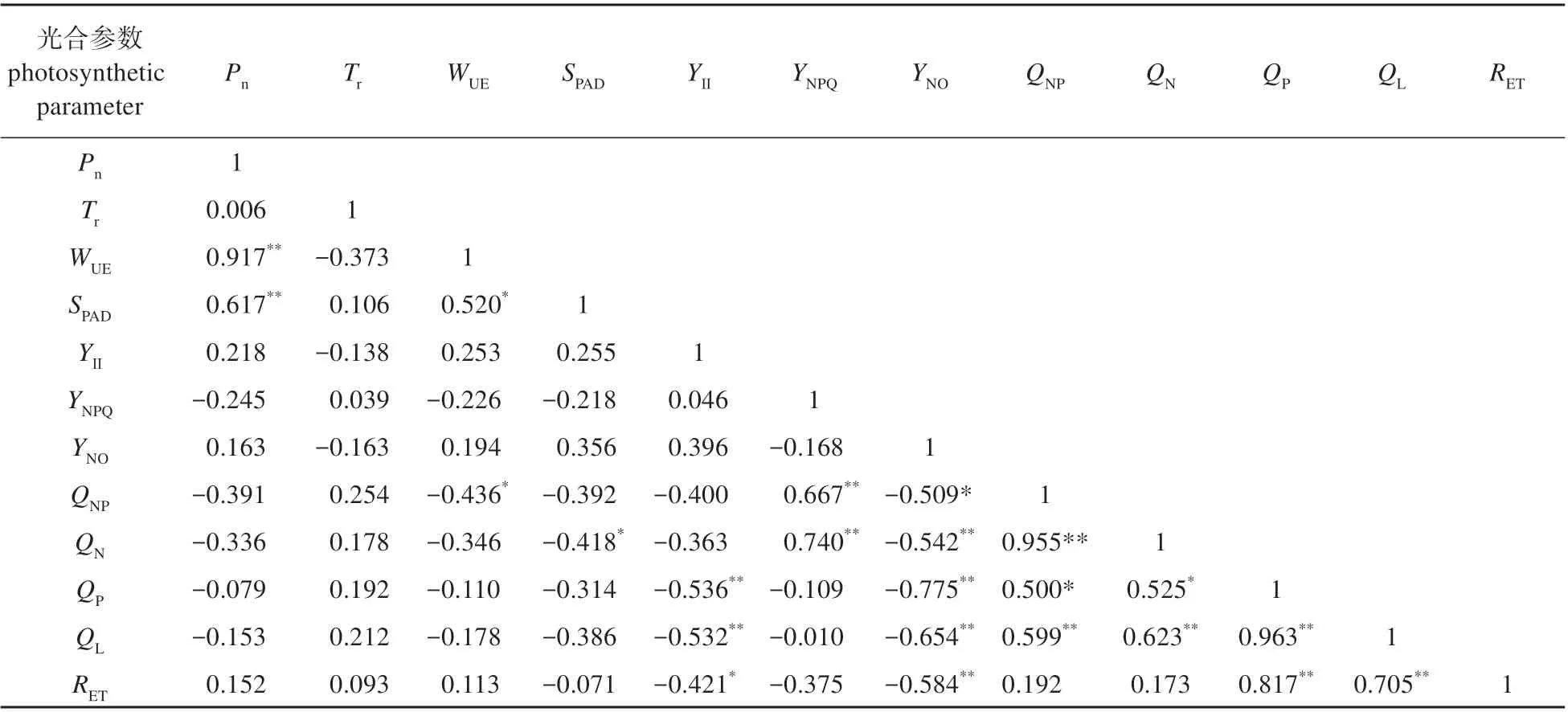
表3 拟南芥种群各光合参数的相关性分析Table 3 Correlation analysis of photosynthetic parameters
进一步聚类分析结果(见图1)表明23 个种群可分为两组(组Ⅰ和组Ⅱ),其中组I 的Pn和WUE显著高于组Ⅱ,Tr则在两组间呈相反趋势(见表4)。 组Ⅰ较 组Ⅱ的Pn高39.48%,WUE高46.01%。组Ⅰ平均Pn为7.37 μmol·m-2·s-1,种群多分布在西欧、中欧地区,在东欧零星分布;组Ⅱ平均Pn为4.46 μmol·m-2·s-1,种群更多分布于东欧、南欧等地。
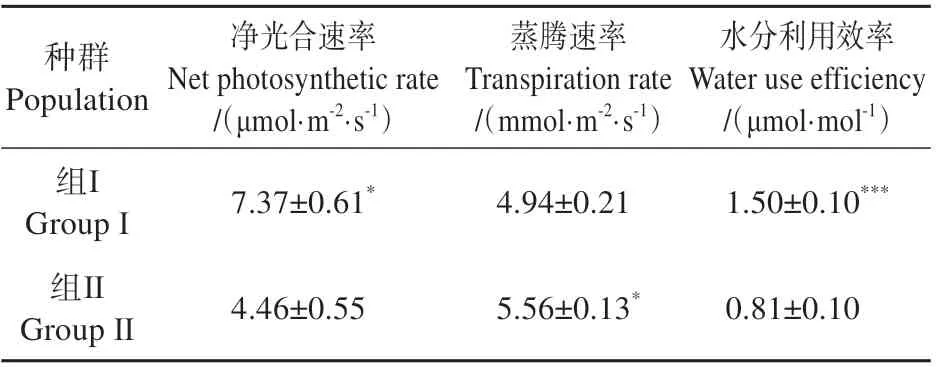
表4 2组拟南芥种群气体交换参数的差异Table 4 Comparison of gas exchange parameters between two groups of Arabidopsis populations
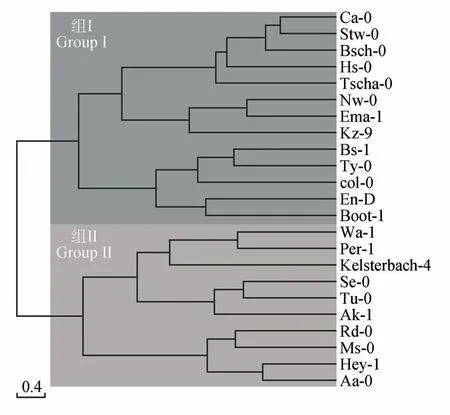
图1 23个拟南芥种群光合参数的聚类分析Fig.1 Clustering analysis of photosynthesis parameters in the 23 Arabidopsis populations
另外,主成分分析(PCA)的结果(见图2)与聚类结果相似,光合能力强弱的两组可以明显分开,第一主成分方差贡献率43.5%,主成分2 方差贡献率21.3%。主成分1 在QL、QNP、QN、QP上有较大载荷,主成分2则在Pn、WUE、RET、YNPQ上有较大载荷。
2.2 光合性状和环境因子间的RDA分析
冗余分析(RDA)结果(图3)从整体上反映了拟南芥种群的光合能力分化与环境因子之间的关系。RDA 第1 排序轴解释了环境因子对拟南芥光合能力影响程度的78.43%,第2 排序轴解释了21.46%。RDA分析结果提取了能最大程度上代表所有指标解释能力的最小变量组合:海拔(alt)、坡度(slop)、等温度(bio3)、季候性(bio4)、年温差(bio7)、旱季平均温(bio9)、冬季平均温(bio11)、年降水量(bio12)和2 月降水量(prec2)。第1 排序轴中alt、slop、bio4 和bio7 与第1 轴关系最为密切,第1 排序轴与bio4(相关系数为0.340)、bio7(0.324)正相关,与alt(-0.662)、slop(-0.744)负相关。第2排序轴中的bio3、bio9、bio11、bio12、和prec2 与第2轴关系密切,第2 排序轴与bio3(相关系数为-0.475)、bio9(-0.653)、bio11(-0.534)、bio12(-0.475)、prec2(-0.526)负相关。其中,组Ⅰ(图2中蓝点)主要占据坐标第二象限,组Ⅱ(图2 中橙点)主要位于第一象限,两组内各种群相对分散。alt(负相关)、bio7(正相关)、bio9(负相关)、bio11(负相关)、bio12(负相关)和prec2(负相关)等环境因子对拟南芥光合能力分化产生较高影响。这些结果表明,拟南芥所在地的温度和降水量是造成其光合能力差异的主要环境因素。
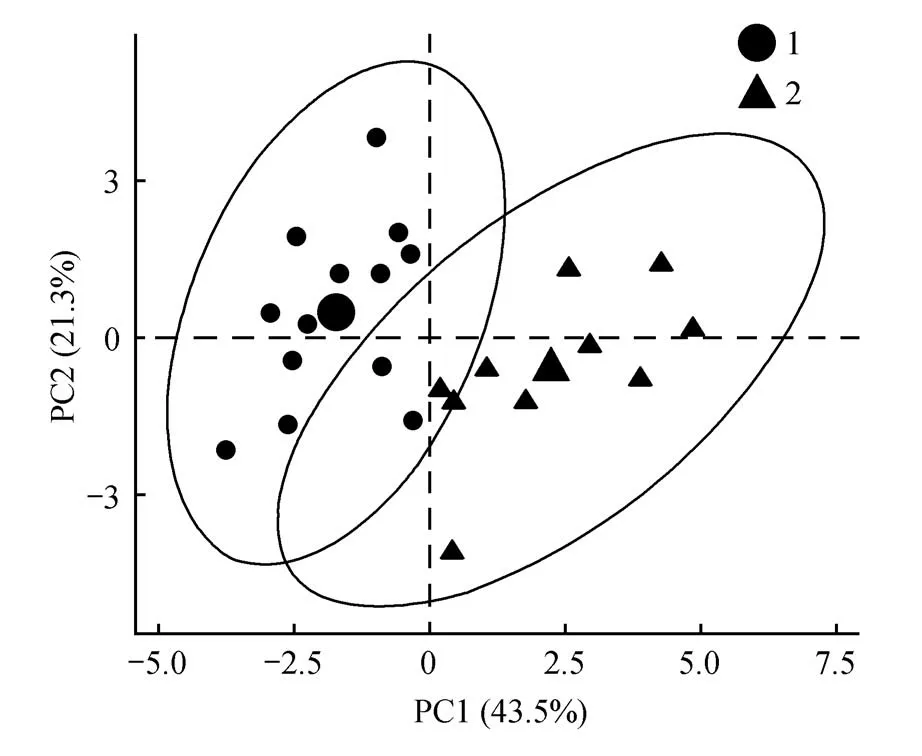
图2 23个拟南芥种群光合参数的主成分分析Fig.2 Principal component analysis of photosynthesis parameters in the 23 Arabidopsis populations
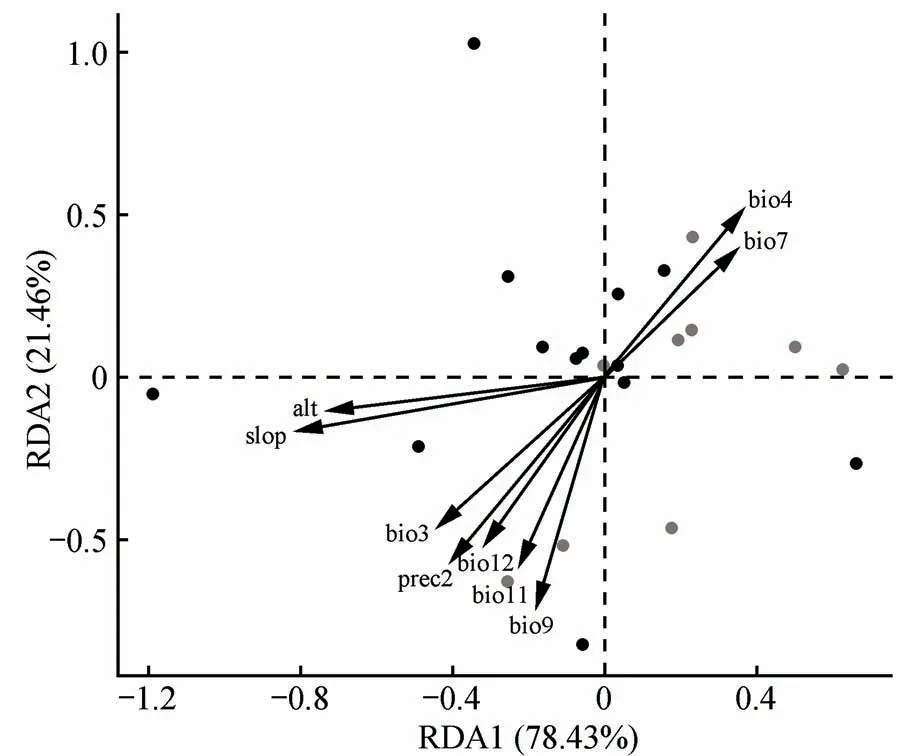
图3 23个拟南芥群体光合性状与环境因子的RDA图图中点为拟南芥种群,黑点代表组Ⅰ,灰点代表组Ⅱ;Alt.海拔(m);slop.坡度(%);bio3.等温性;bio4.季候性;bio7.年温差(℃);bio9.旱季平均温(℃);bio11.冬季平均温(℃);bio12.年降水量(mm);prec2.2月降水量(mm)Fig.3 RDA plot of photosynthetic traits in the 23 Arabidopsis populations with environmental factors The dots in the figure are Arabidopsis populations,black dots represent group Ⅰand gray dots represent group Ⅱ;Alt.Indicates altitude(m);slop.Indicates slope(%);bio3.Isothermal;bio4.Seasonal;bio7.Annual temperature difference(℃);bio9.Average dry season temperature(℃);bio11.Average winter temperature(℃);bio12.Annual precipitation(mm);prec2.Indicates February precipitation(mm)
2.3 不同拟南芥种群光合作用相关基因表达
根据聚类分析的分类结果选择4 个拟南芥种群(组Ⅰ中的En-D 和Stw-0,组Ⅱ中的Wa-1 和Per-1)作为典型种群来进一步研究光合作用相关基因的表达水平。本试验选择了光反应和暗反应共15个光合相关基因,包括PSⅡ、PSⅠ、Rubisco 以及CB 循环其他的关键基因(见表1)。结果表明,在4个种群中,所研究的大多数基因在En-D(净光合速率最高的种群)中的表达水平要高于其余净光合速率较低的种群。其中,PSII 相关基因(PsbP、CP22和CAB1)、PSI 相关基因(LHCA6)和Rubisco相关基因(RbcS1A、RbcS1B、RbcS2B和RbcS3B)的表达模式与4 个种群的净光合速率相对应(见表2),即从强光合能力到弱光合能力的种群中,各基因表达水平逐渐递减(见图4),并且组Ⅰ种群(En-D和Stw-0)中各基因的表达水平显著高于组Ⅱ种群(Wa-1 和Per-1)(P<0.05)。除此之外,SBP基因表达模式也呈现出类似规律。而其他涉及PSⅠ(如Pas2、CBR)和CB 循环(如FBP、RCA)的基因的表达水平没有明显趋势。结果表明,PSⅡ和Rubisco相关基因可能与拟南芥种群光合能力的分化有关。
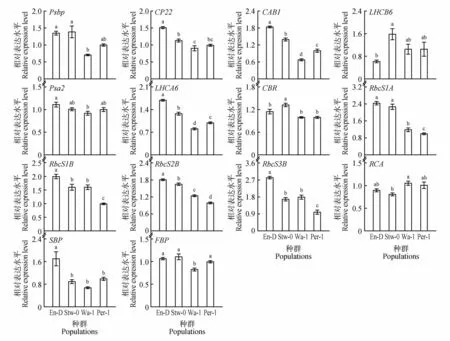
图4 拟南芥4个种群光合作用相关基因的相对表达水平不同字母代表4个种群基因表达水平差异显著,P<0.05Fig.4 The relative expression levels of photosynthesis-related genes in four Arabidopsis populations Different letters represent significant differences of the gene expression levels among the four populations,P<0.05
3 讨论与结论
本研究通过测定23个不同欧洲地理分布的拟南芥种群的气体交换参数和叶绿素荧光参数,揭示了在同质园条件下拟南芥不同地理种群光合能力的分化规律,强光合能力的种群大都分布于中欧、西欧,而弱光合能力的种群分布于东欧和南欧等地。这种光合能力的地理分化与各种群所在地温度和降水量有着密切关系。进一步深入研究发现光合相关基因,特别是PSⅡ、Rubisco 相关基因转录水平存在差异,暗示着这些基因的差异表达可能与同质园条件下拟南芥种群光合能力的分化有关。
气候条件会对植物的生理和分布产生影响[17]。植物在应对环境变化时通常表现出表型可塑性,这意味着不同地区的植物在物种内部或物种之间表现出不同的表型(表型多态性)[18]。光合速率是衡量绿色植物光合能力大小的一个重要指标[19],而净光合速率是评估植物光合能力的重要参数,直接反应了植物光合作用的强弱。本试验结果显示23个拟南芥种群之间的净光合速率存在差异,表明在相同环境中,不同地理种群拟南芥的光合能力依旧存在差异,而光合能力的分化可能与植物体内水分利用率以及叶绿素含量有关(表3)。RDA 结果表明,温度和降水影响了拟南芥的光合能力,使各种群光合能力具有较大差异(图2),年温差(正相关)、旱季平均温(负相关)、冬季平均温(负相关)、年降水量(负相关)、2 月降水量(负相关)等环境因子均对拟南芥光合能力差异产生较大影响。温度和水分是影响光合作用的2 个主要因素[20]。不利的温度会影响光合色素的合成并损害PSⅡ,干旱胁迫不仅会通过降低气孔导度而降低CO2同化速率,还会降低光合作用相关酶的含量和活性,包括Rubisco 和叶绿素[20-21]。不同生境下植物生理生态特性差异的产生主要是由于其所处环境条件的改变引起的[22]。而这种生理生态差异的产生往往是瞬时的,待环境恢复正常后,差异会逐渐消失[22-23]。本研究在同质园条件下进行,整个处理过程中环境条件相对恒定,基本排除环境条件变化对不同拟南芥种群性状的影响。但是结果发现不同拟南芥的地理种群光合特性依然存在分化。这说明在长期的适应性进化过程中,不同地理分布的拟南芥种群为适应环境所发生的改变遗传给了后代,因此呈现出同质园条件下不同拟南芥种群光合能力的分化。这种可遗传的改变可能与基因突变、基因转录模式和表观遗传等因素有关。
环境因素往往通过调控基因转录水平来影响植物表型的变化,因此本试验研究了光合作用相关基因的表达水平。根据聚类结果,本研究挑选了2 个强光合能力种群(En-D、Stw-0)以及2 个弱光合能力种群(Wa-1、Per-1)作为典型种群进行基因转录水平检测。结果表明,在4个挑选的拟南芥种群中,PSⅡ和Rubisco 相关基因的表达模式与净光合速率相对应(从En-D 到Per-1 有下降的趋势)。PSⅡ是1 种复杂的多蛋白组装体,位于类囊体膜上[24]。PsbP 蛋白的功能在于优化PSⅡ中的氧气释放[25]。CP22基因编码1种PSⅡ-S色素结合蛋白,负责调节QNP活性,从而参与维持PSII 的稳定性和活性[26]。CAB基因是光捕获复合物Ⅱ(Light-harvesting Complex Ⅱ,LHCII)的亚基,编码叶绿素A/B 结合蛋白,在光吸收和能量转移到PSⅡ反应中心的过程中发挥作用。因此CAB表达量的增加促进了叶绿素的积累和类囊体膜的稳定性[27-28]。本研究发现En-D 和Stw-0 的CAB转录水平显著高于Wa-1和Per-1,表明CAB表达水平可能对拟南芥光合能力有着正调节作用,这与净光合速率和SPAD 的显著相关性相对应(见表3)。此外,Rubisco 是植物中含量最丰富的蛋白质,不仅催化光合作用暗反应中的碳固定,还可以催化光呼吸的碳氧化,从而影响植物的光合能力[29]。该酶处在2 个方向相反但又相互关联的循环交叉点上,其对植物净光合速率起着决定性的影响。改变Rubisco 性能的研究已经证明了Rubisco 与植物光合作用和生长之间的直接关系[29-30],Rubisco 含量的增加可导致植物叶片光合速率和产量的提高。Rubisco 是1个动态催化酶,由多个基因编码,其相关基因单独受抑制均可导致Rubisco 含量的减少,影响植物光合能力[31]。因此Rubisco 基因的相对高表达可保证Rubisco 的羧化效率并维持暗反应的进行。在本研究结果中,PSⅡ和Rubisco 相关基因在4个典型种群中的表达存在显著差异(见图3),高净光合速率的种群(En-D和Stw-0)的转录水平明显高于弱净光合速率的种群(Wa-1 和Per-1)(见图3,表1)。这暗示着拟南芥光合能力的分化可能主要由PSⅡ和Rubisco 相关基因表达差异的调控。除了PSⅡ和Rubisco 相关基因外,SBP基因也有类似的结果(见图3)。与野生型相比,SBPase 活性的增加导致转基因烟草(Nicotiana tabacum)的光合速率提高,主要是由于RuBP再生能力的增强[32]。因此,表明SBP也可能参与拟南芥分化的调节。
综上所述,欧洲不同地理分布的拟南芥种群的光合能力在同质园条件下发生了地理分化,强、弱光合能力的种群有着不同的地理分布。这种差异可能是由于环境因子影响的PSⅡ和Rubisco 等相关基因转录差异所导致的。然而,这些基因的表达模式为何会出现以上的差异,其更深入的调控机理仍需进一步探索。

