体外膜氧合成功救治Stanford A型主动脉夹层术后急性呼吸窘迫综合征患者1例
Stanford A型主动脉夹层是一个发病急、死亡率高的疾病,常需急诊手术进行外科修复。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是外科术后的严重并发症,主要特征是难治性低氧血症和双肺浸润[1]。主动脉手术后出现ARDS的比例约16%,死亡率高达80%以上[2]。体外膜氧合(extracorporeal membrane oxygenation,EC⁃MO)可临时替代自然肺的呼吸功能,维持氧合和通气,但ECMO在Stanford A型主动脉夹层患者中的应用具有争议性。目前Stanford A型主动脉夹层术后发生ARDS采用ECMO支持辅助的研究较少,本文分享1例ECMO成功辅助Stanford A型主动脉夹层术后ARDS的案例(本研究已得到本院伦理委员会同意,伦理号2021-1496)。
1 资料与方法
1.1 一般资料 患者,男性,37岁,身高171 cm,体重105 kg,突发撕裂样胸痛一天,于2021年4月15日收入本院,胸片CT显示为Stanford A型主动脉夹层,破口位于升主动脉和主动脉弓部。超声检查左心室射血分数为60%,合并主动脉瓣中大量反流。心肌梗死三项指标(肌钙蛋白I、肌红蛋白、肌酸激酶同工酶)升高。既往有吸烟史,否认肺部疾病。术前白细胞17.59×109/L,D二聚体7.58 mg/L。
1.2 手术过程 患者于2021年4月16日急诊行全主动脉弓人工血管置换并支架象鼻手术,正中胸骨切开入路,经右侧股动脉和腋动脉及右心房插管,建立体外循环,降温阻断升主动脉,心脏灌注含血停搏液静止后,探查主动脉夹层累及左右冠状动脉开口。鼻咽温降至24℃,全身停循环22 min,同时经腋动脉进行单侧选择性脑灌注。心脏复跳心功能良好时顺利停止体外循环。体外循环过程中给予白蛋白80 g,甲强龙1 000 mg,常规超滤4 000 ml,平衡超滤4 000 ml。停机后20 min,患者脉搏氧合度(SpO2)降至70%左右,麻醉医生手动膨肺,常规处理无改善后,再次建立体外循环辅助,同时行纤支镜镜检,发现气道大量胶冻样渗出,吸除后数分钟,气道又出现白色稀薄物渗出,给予地塞米松10 mg减少渗出。体外循环辅助100 min后再次尝试停机,在呼吸机吸入氧浓度100%的情况下,停机即刻SpO2迅速降至60%,氧合指数(PaO2/FiO2)低于80 mmHg,pH<7.25,动脉血二氧化碳分压66.9 mmHg,氧合不能维持,符合ARDS诊断的柏林标准[3],决定给予ECMO治疗。术后橡胶管支撑胸骨,延迟关胸,皮肤缝合。转运回ICU后3 h内,胸腔引流700 ml,血红蛋白下降明显,为节约用血,将胸腔引流管和血液回收机相连,并追加鱼精蛋白和输新鲜冰冻血浆、血小板、注射用重组人凝血因子VⅡa,但出血情况均无明显改善,术后第1日再次进手术室开胸探查,清除心包血块,止血后胸液量显著减少,循环稳定。
1.3 ECMO辅助 考虑到患者夹层术前累及冠脉口,且为避免后续缺氧对肺动脉高压和心功能产生影响,决定采用静脉-动脉(veno-arterial)ECMO(VA ECMO)模式。ECMO设备采用离心泵(Rotaflow,德国)和套包(MAQUET,德国),股静脉采用28 Fr静脉插管(Edwards Lifesciences,美国)。切开置管,动脉端通过10×8接头和主动弓部人工血管分支相连接作为输血通路。初始转数3 200转/min,ECMO流量4.8 L/min。ECMO早期,为了维持有效血容量和流量稳定,维持出入量近乎平衡,情况稳定后,尽量维持出入量负平衡,祛除体内多余的水分。
1.4 血制品和血管活性药物情况 关胸过程中由于出血、止血困难,患者需间断输液和红细胞,术中输注红细胞8 U、新鲜冰冻血浆1 200 ml、血小板1 U。激活部分凝血酶原时间(activated partial thromboplastin time,APTT)低于80 s后启动肝素抗凝治疗,ECMO期间维持活化凝血时间(activated clotting time,ACT)的范围为180~220 s,APTT范围50~80 s。ECMO期间血红蛋白低于80 g/L输注红细胞;血小板低于50×109/L时输注血小板;国际标准化比率1.5~2倍的正常值时输注新鲜冰冻血浆。该患者在ECMO辅助过程中总计输注红细胞19 U,新鲜冰冻血浆2 400 ml,血小板3 U。
术后第2天,血管活性药逐渐减量,多巴胺从6 μg/(kg·min)减至2 μg/(kg·min),肾上腺素从0.07 μg/(kg·min)逐渐减至停药,患者内环境逐渐改善。
2 结 果
ECMO期间患者维持镇静状态,结合采用肺保护性通气策略,利尿、补充白蛋白维持出入量负平衡,并间断行纤支镜镜检以及抗感染治疗后,肺部氧合逐渐改善,于ECMO运行159 h后再次入手术室顺利撤机、闭合胸骨。患者术后第10日,拔出气管插管,术后第24日顺利康复出院。治疗期间胸部X光影像学表现见图1。
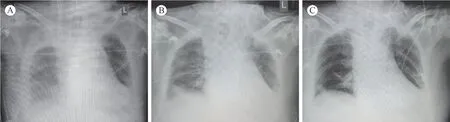
图1 患者胸部X光影像学表现
3 讨 论
Stanford A型主动脉夹层患者术后出现ARDS的机制尚不明确,可能与手术和呼吸机的创伤打击、炎症反应、体外循环和停循环的缺血再灌注损伤、以及大量血制品输注相关。肥胖、术前氧合功能损害和深低温停循环均是Stanford A型主动脉夹层患者发生ARDS的危险因素[4]。
静脉-静脉(veno-venous)ECMO(V-V ECMO)可部分替代自然肺的通气氧合功能,并降低呼吸机相关肺损伤,但不能直接维持血流动力学稳定[5]。本例患者不仅出血风险高,循环波动明显,且肺部氧合功能差也会间接影响心脏功能,因此采用V-A ECMO模式,维持呼吸和循环功能稳定。此外,在该患者ECMO管理过程中,采用人工血管分支作为ECMO回血通路、高流量辅助、镇静联合肺保护性通气策略以及适当液体管理均是本例ECMO辅助成功的关键点。
一般情况下,V-A ECMO插管方式首选外周股动静脉插管,创伤小、有利于闭合胸骨、降低感染与出血发生率,但它不利于静脉引流和左心室卸负荷,容易发生南北综合征。对于肺功能差的患者,中心插管建立ECMO更有益[6]。首先,中心插管可以保证ECMO高流量辅助,提高氧供,改善氧合,维持循环稳定;其次,中心插管可减轻上半身缺氧,降低南北综合征的发生,进而避免缺氧对冠脉和心功能的后续影响。此外,中心插管不影响下肢血供,有益于ECMO管理。
ECMO期间最优化的肺保护性通气策略虽然尚不明确,但维持小潮气量和较高的呼气末正压仍是公认的治疗观点,它可保证在满足机体气体交换的情况下,尽可能降低呼吸机强度,减轻气压伤和容积伤[7]。本例患者105 kg,设定呼吸机潮气量为600 ml/min、呼气末正压6~8 cmH2O、吸气平台压25 cmH2O,符合以上肺保护性通气策略。
除了尽可能提高机体氧供外,维持患者镇静状态、使用肌松剂、积极抗感染治疗,均可降低患者氧耗。ECMO期间液体管理也是影响患者预后的一个重要因素,ECMO早期常需液体复苏,维持有效血容量,确保ECMO流量稳定,以提供充足氧供;后期在循环稳定的前提下应积极祛除体内多余水分,适当维持液体出入量的负平衡,可改善患者预后[8]。
Stanford A型主动脉夹层术后行ECMO辅助患者,出血常是抗凝的禁忌证,且在此类患者中最佳的抗凝策略尚不明确。有文献报道未采取抗凝治疗的V-A ECMO,可以减少血制品输入和肝素诱导血小板减少症的发生,且未增加患者血栓和出现氧合器功能障碍[9],但本病例根据ACT和APTT数值以及临床表现,采用普通肝素进行抗凝,并未增加术后胸腔引流量及其他出血并发症。
4 结 论
V-A ECMO可以有效抢救Stanford A型主动脉夹层术后出现ARDS的患者,维持呼吸和循环功能稳定,为后续的治疗以及脏器功能恢复赢得宝贵时间。

