影响急性A型主动脉夹层患者预后的关键因素探讨
王 雪,邓 超,郭锋伟,曹先通,闫 炀
急性A型主动脉夹层(acute Stanford type-A aortic dissection,aTAAD)是一种致命的疾病,即使在手术修复后也有极高的死亡率[1]。aTAAD发生时,约25%的患者表现为血流灌注不良[2-5],其死亡率高达89%,但灌注不良的程度难以评估。血清乳酸已经成为评估脏器灌注不良早期的有用工具,尤其是肠道灌注不良,是肠道微生物菌群过度生长大量产生的早期肠系膜缺血的敏感标记物[6-7]。本研究旨在用动态乳酸水平变化和乳酸清除率测量来评估周围灌注充分性和代谢状态,评估与患者长期预后的关系,寻找预测预后的因素,为提前临床干预提供依据。
1 研究对象及方法
1.1 一般资料 对2019年10月至2020年12月在西安交通大学第一附属医院心血管外科住院行外科手术治疗的aTAAD患者进行筛选并随访1年。患者经计算机断层扫描血管成像诊断为aTAAD。纳入标准:出现症状2周内的aTAAD患者,年龄为18岁至75岁。共纳入患者320例,其中仅行手术治疗患者276例,随访1年,失访3例,最终纳入符合研究标准的患者273例患者,其中男性184例,女性89例,平均年龄(54±8)岁,按照随访1年后是否死亡分为死亡组和存活组,死亡组患者67例,存活组206例。排除标准如下:①心源性休克或心包填塞史;②创伤性主动脉夹层;③医源性主动脉夹层;④严重的瓣膜疾病;⑤先天性心脏病;⑥严重的器官功能障碍,如肝肾衰竭;⑦恶性肿瘤;⑧疑似亚临床心肌受累(如慢性炎症或急性感染史)。本研究已经通过西安交通大学第一附属医院临床研究伦理委员会批准(伦理号:XJTU1AF2021LSK-405)。所有数据均采用盲法进行分析。
1.2 检测和检查方法 所有患者均留取术前乳酸,术后0、4、8、12、16、20、24 h的乳酸,术前检验、检查及病史,白细胞(white blood cell,WBC)、中性粒细胞(neutrophil,NEU)、C反应蛋白(C-reactive pro⁃tein,CRP)在全自动血液细胞分析仪(mindray,型号:BC6800Plus,深圳迈瑞生物医疗电子股份有限公司,中国)上进行检测;天门冬氨酸氨基转移酶(as⁃partate amino transferase,AST)、丙氨酸氨基转移酶(alanine amino transferase,ALT)、总胆红素、直接胆红素、间接胆红素、总胆固醇、尿素、肌酐、尿酸、心肌酶谱均在全自动生化分析仪(HITACHI,型号:008AS,日本)上进行检测,D二聚体、纤维蛋白原降解产物(fibrinogen degradation product,FDP)在血凝分析仪-3仪器进行检测(SYSMEX,型号:CS5100,日本)。
1.3 统计学方法 所有数据均采用SPSS 26.0统计软件进行分析,计量资料符合正态分布采用均数±标准差(±s),组间比较采用独立样本t检验;不符合正态分布的数据用中位数(四分位间距),即Q(Q1,Q3)表示,组间比较采用秩和检验。计数资料以率比或构成比表示,组间比较采用卡方检验。采用单变量和多变量逻辑回归分析(COX)确定aTA⁃AD患者的预后因素,采用受试者工作特征(receiver operating characteristic,ROC)曲线分析不同指标对患者半年后预后的预测价值。采用双侧检验,P<0.05为差异有统计学意义。对于实验室结果也评估了测量值是否超出了正常范围。
2 结 果
2.1 死亡组与存活组基线资料和临床特征比较 死亡组患者术后24 h乳酸清除率及血清白蛋白显著低于存活组(P<0.01),术后0、4、8、12、16、20、24 h的乳酸水平、最高乳酸水平、年龄、欧洲评分、D二聚体、FDP、CRP、AST、尿素及肌酐显著高于存活组,差异有统计学意义(P<0.01)。余指标差异无统计学意义。见表1。

表1 死亡组和存活组基线资料和临床指标比较
2.2 不同指标单因素和多因素COX分析 通过不同指标单因素和多因素COX比较发现,术后24 h内乳酸清除率、0 h乳酸、24 h乳酸、肌酐水平、D二聚体及年龄等均为影响aTAAD患者的影响因素(表2)。

表2 不同指标对急性A型主动脉夹层患者预后的COX分析
2.3 不同指标预测aTAAD患者预后的ROC分析比较 对aTAAD患者的年龄、术后0 h乳酸水平、术后24 h乳酸水平、术前D二聚体水平、术前肌酐水平及乳酸清除率等预后进行ROC分析和绘制曲线下面积(AUC)见图1。通过比较曲线下面积发现24 h乳酸乳酸清除率预测价值大于其余指标,且特异度最高,模型质量较好(图2)。

图1 急性主动脉夹层患者不同指标的ROC分析
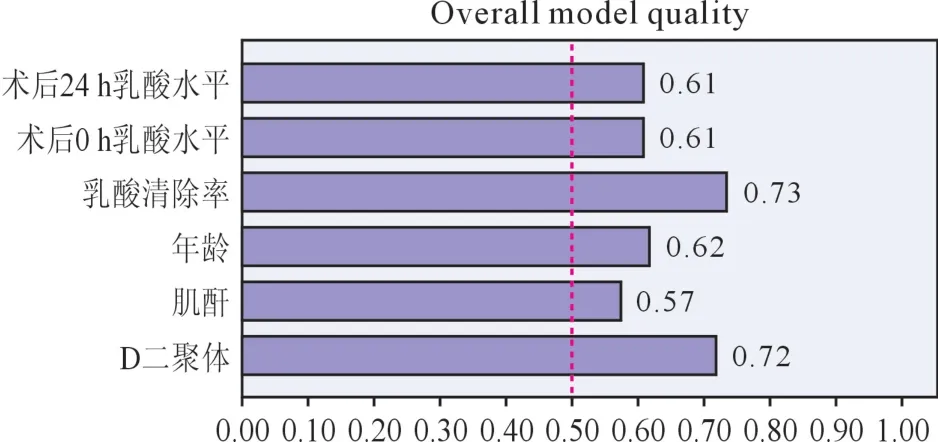
图2 不同指标对急性主动脉夹层患者预后的受试者 工作特征分析的模型质量
2.4 乳酸清除率生存曲线分析 结合ROC和COX分析,乳酸清除率预测aTAAD患者价值最佳,最佳临界值为87.6%,将患者分为乳酸清除率<87.6%组和乳酸清除率>87.6%组,进一步绘制影响aTAAD患者预后的生存曲线发现乳酸清除率>87.6%组患者存活率大于乳酸清除率<87.6%组,且Log Rank检验P<0.01,如图3。

图3 两组患者的生存曲线比较
3 讨 论
目前对于aTAAD的手术方式已经成熟,但一部分患者虽经过积极手术,仍有较高死亡率,仍需进一步探索影响预后的因素。有研究显示,aTAAD术后晚期高乳酸血症可能说明血流恢复不足,或者再灌注损伤,尤其是经过体外循环复温后血管扩张,甚至麻痹,导致乳酸产生和堆积,排泄降低。在Bennet的研究中[8],术前单一乳酸是影响aTAAD预后的高危因素,然而单一乳酸样本的预测可能会产生偏移,而且术前乳酸只能说明主动脉夹层本身的影响,未将体外循环和复温的因素考虑进去,且脏器灌注不良往往在术后表现明显,术前轻或中等升高的水平乳酸难以解释患者术后并发症的发生。有研究显示[9-10],在关于脓毒症及急性应激状态研究中动态乳酸检测较单一乳酸检测更能说明脏器灌注不良严重性,且将其纳入脓毒性休克的诊断标准中,进一步说明动态检测乳酸水平变化预测的重要性。aTAAD患者原发疾病的打击、心脏停跳、体外循环及复温均可能会导致外周脏器灌注不良,尤其是肠道循环灌注不良,而肠道灌注不良难以及时被发现,且肾脏灌注不良也可能会延迟出现。许多研究已经证实乳酸是代表微循环和早期脏器衰竭的敏感指标[11-12],且在临床中,乳酸检测是很容易得到且迅速、便宜的一个指标。然而,乳酸水平与急性脏器灌注不良的诊断和预后预测之间的关系仍存在很大程度的不确定性,到底以什么时候的乳酸水平来判断脏器灌注不良的严重程度最佳,国内外对此研究甚少。
有研究显示心脏手术后24 h内的高乳酸血症被证明具有更高的死亡风险,反映了组织低灌注时间延长或氧利用率增加,但只是针对患者住院早期,而未研究与患者长期预后的关系,且纳入患者不是aTAAD[13]。而本研究不仅留取患者术前乳酸水平,且术后动态检测乳酸水平,计算术后24 h内乳酸清除率,目的就是寻找乳酸水平及清除与aTAAD术后1年死亡率的关系,通过分析显示,死亡组患者术后24 h乳酸清除率较存活组显著降低(P<0.01),术后0、4、8、12、16、20、24 h的乳酸水平,最高乳酸水平显著高于存活组(P<0.01)。通过COX分析比较发现,术后24 h内乳酸清除率,0 h乳酸,24 h乳酸均为影响aTAAD患者的影响因素。其中24 h乳酸清除率预测价值最佳,ROC曲线下面积为0.801,敏感性为65.7%,特异性为83.6%(P=0.000),特异度最高,且模型质量较好。结合ROC和COX分析,最佳临界值为87.6%,将患者分为乳酸清除率<87.6%组和乳酸清除率>87.6%组,进一步绘制影响aTAAD患者预后的生存曲线发现乳酸清除率>87.6%组患者存活率大于乳酸清除率<87.6%组,且Log Rank检验P<0.01。总之,24 h乳酸清除率可预测aTAAD长期预后,且预测价值优于单一乳酸水平。虽然目前也有许多研究[14-17]证实D二聚体为aTAAD的影响因素,但在本研究中也发现,其预测价值也弱于24 h乳酸清除率,故可认为24 h乳酸清除率为预测aTAAD长期预后的最佳指标。
患者术前的治疗,术中的麻醉护理、手术治疗和决策虽然是按照标准进行,但都是由各自的医生自行决定,且乳酸检测时间间隔为4 h,时间间隔较长,只留取24 h内的乳酸,这可能导致低估了持续性或晚发乳酸酸中毒对预后的影响。乳酸水平升高的潜在混杂因素是肝功能障碍、硫胺素缺乏、先天性代谢障碍、药物和相关毒素等,但这些研究未进行研究和解释。希望今后的研究能够纳入更多患者,乳酸检测间隔时间缩短,对影响的乳酸的混杂因素进行分析,按配对研究进行排除混杂因素,为患者提高干预提供方便简单的证据。且在手术方案中,乳酸水平持续高的患者可能需要进行远端血运重建,及时再次行影像学检查,以进一步治疗提供依据。
4 结 论
aTAAD术后24 h乳酸清除率是影响长期预后的独立影响因素,术后0 h和24 h乳酸也可能影响长期预后,且24 h乳酸清除率预测价值优于单一乳酸水平,是最佳的预后指标,为临床提前干预和治疗提供依据。

