抵抗素诱导血管平滑肌细胞表型转化的作用及机制研究
李红芳,刘 鹏,曹 露,徐一君,陈志强,温 文
移植血管再狭窄是影响冠脉旁路移植术远期效果的重要原因,其主要病理基础是血管平滑肌细胞(vascular smooth muscle cells,VSMCs)发生表型转化、增殖、迁移[1],导致血管重塑、狭窄。抵抗素等脂肪因子可诱导VSMC增殖、迁移,但具体机制尚不清楚。腺苷酸活化蛋白激酶(adenosine monophos⁃phate actived protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号在VSMC增殖中发挥重要作用[2]。本实验观察抵抗素诱导VSMCs表型转化作用的可能机制,以及二甲双胍的防治作用,为防治移植血管再狭窄提供理论依据。
1 材料与方法
1.1 材料 人血管平滑肌细胞(human aortic vascu⁃lar smooth muscle cells,HVSMCs)(ScienCell),高糖细胞培养基(DMEM)(Gibco),胎牛血清(杭州四季青),0.25%胰蛋白酶(北京全式金),盐酸二甲双胍(AMPK激活剂)(Sigma),重组人抵抗素(Pepro⁃Tech),细胞周期检测试剂盒(美国BD),UNIQ-10柱式Trizol总RNA提取试剂盒及引物(上海Sangon Biotech),cDNA合成试剂(PrimeScriptRT Master Mix Perfect Real Time)及荧光定量试剂盒(SYBR Premix Ex TaqTMⅡ)(大连Takara),p-AMPKα(Thr485)、mTOR、细胞周期蛋白D1(Cyclin D1)(Cell Signaling Technology),p-mTOR(Abcam),AMPKα1/2、β-肌动蛋白(β-actin)、HRP-linked antibody、Goat anti-rabbit IgG(武汉博士德)。
1.2 细胞培养与传代 HVSMCs复苏后,培养于含10%胎牛血清(FBS)、100 IU/ml青霉素及100 μg/ml链霉素的高糖DMEM中。于37℃、5% CO2细胞培养箱中培养,2~3 d更换一次培养液,传至4~5代细胞进行实验。生长状态良好的细胞,1.0×105个/孔接种于六孔板,用高糖DMEM培养24 h,用不含FBS的高糖DMEM饥饿24 h,分组进行相应药物处理。
1.3 实验分组及处理 实验分4组:对照组(Con):不加干预;抵抗素组(Res):加入含50 μg/L抵抗素培养;二甲双胍组(Met):加入含2 mmol/L二甲双胍培养;抵抗素+二甲双胍组(Res+Met):二甲双胍2 mmol/L处理细胞2 h后,再加入抵抗素50 μg/L培养22 h。分组处理后的细胞继续孵育,各组孵育24 h后进行蛋白质免疫印迹(Western blot)检测p-AMPK、p-mTOR、AMPK、mTOR及Cyclin D1表达;孵育48 h后进行流式细胞术测定细胞周期,实时荧光定量聚合酶链反应(RT-PCR)测定α-平滑肌肌动蛋白(α-SMA)及骨桥蛋白(OPN)表达。抵抗素浓度的选择参考本研究前期研究结果及相关文献[3]。
1.4 流式细胞术检测细胞周期 胰蛋白酶消化并收集细胞,按照细胞周期检测试剂盒说明进行相应操作,流式细胞术检测。
1.5 实时荧光定量PCR(RT-PCR)检测相关基因表达 采用柱式Trizol法提取总RNA,并进行浓度测定,按照试剂盒步骤进行反转录及RT-PCR反应。引物:α-SMA:上游:5'-GGCTGAAGAATG⁃GCGTGATT-3′,下游:5′-CTGCCATGTCTTTGCCT⁃TCA-3′;OPN:上游:5'-ACTGATTTTCCCACGGAC⁃CT-3',下游:5'-CTCCTCGCTTTCCATGTGTG-3';内参:β-actin。反应条件:95℃30 s,(95℃5 s,60℃31 s),40个循环,即得出相应CT值。待测样本目的RNA表达量相对值=2-△△Ct,△△Ct=△Ct待测样品-△Ct β-actin,△Ct=Ct待测样品-Ct阴性对照。
1.6 Western blot法检测相关信号蛋白表达 收集细胞并裂解,提取总蛋白质,BCA法测得相应浓度。每泳道上样30 μg进行电泳;电泳结束后,Page-凝胶平衡后恒流半干转膜;BSA液封闭,室温2 h。抗体杂交,一抗1∶1 000稀释,4℃过夜;二抗1∶2 000稀释,室温孵育2 h。配制ECL化学发光液,荧光成像仪(ProteinSample-HD2)曝光成像。检测AMPK、p-AMPK、mTOR、p-mTOR和Cyclin D1表达量。
1.7 统计方法 应用SPSS 22.0软件进行统计分析,组间比较采用单因素方差分析和t检验,所有数据采用平均数±标准差(±s)表示。以P<0.05为有统计学意义。
2 结 果
2.1 抵抗素对HVSMCs细胞周期的影响 与Con组相比较,Res组细胞G0/G1期细胞减少(P<0.01),S期细胞明显增多(P<0.01);二甲双胍预处理后,与Res组相比较,细胞G0/G1期细胞增多(P<0.01),S期细胞明显减少(P<0.01)。Con组与Met组相比G0/G1期细胞所占比例无统计学意义(P>0.05)。Con组与Met组相比S期细胞所占比例无统计学意义(P>0.05)。各组细胞及各期细胞所占比例见图1、图2、图3。
图1 经相应处理后的血管平滑肌细胞(100×)
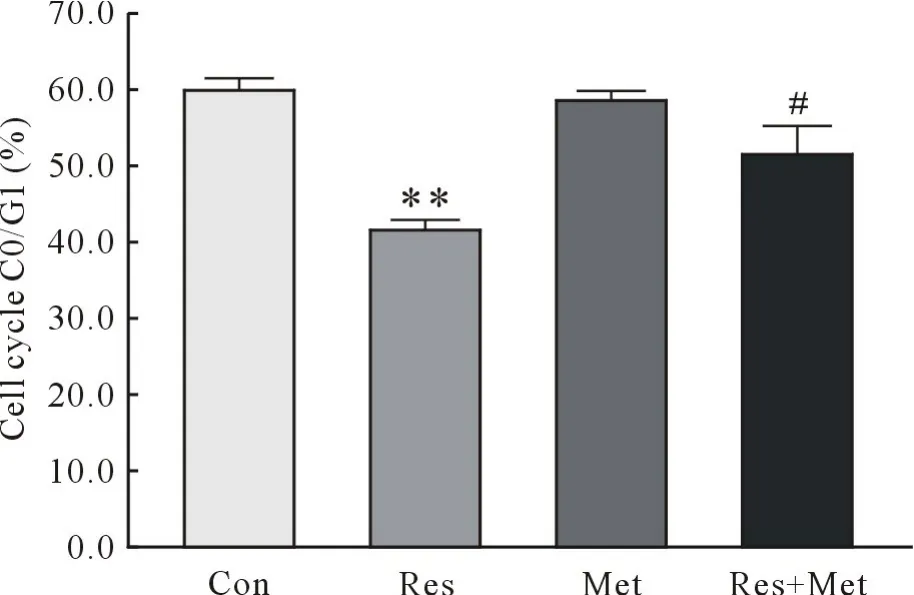
图2 抵抗素对血管平滑肌细胞周期G0/G1期的影响
2.2 抵抗素诱导HVSMCs表型转化相关基因的表达 与Con组相比较,Res组α-SMA表达水平降低(P<0.01),OPN表达水平升高(P<0.01);二甲双胍预处理后,较Res组α-SMA表达水平升高(P<0.01),OPN表达水平降低(P<0.01)。Con组与Met组相比α-SMA基因相对表达量无统计学意义(P>0.05)。Con组与Met组相比OPN基因相对表达量无统计学意义(P>0.05)。见图4、图5。

图5 抵抗素对血管平滑肌细胞骨桥蛋白基因的影响
2.3 抵抗素对HVSMCs表型转化相关蛋白表达的影响 细胞分组处理后通过荧光成像仪系统对各荧光条带扫描,计算各蛋白相对表达量。与Con组相比较,Res组p-AMPK表达量明显降低(P<0.01),p-mTOR表达量明显升高(P<0.01),Cyclin D1表达量明显升高(P<0.01);经二甲双胍预处理后,p-AMPK表达量升高(P<0.01),p-mTOR表达降低(P<0.05),Cyclin D1表达量降低(P<0.05);Con组与Met组AMPK、mTOR总量相比差异无统计学意义(P>0.05)。见图6、图7。

图7 各组细胞p-AMPK、p-mTOR、Cyclin D1蛋白表达光度值相对值
3 讨 论
冠脉旁路移植术是治疗冠心病的主要方法之一,移植血管再狭窄是影响其远期效果的重要原因。在血管内皮损伤、局部炎症反应和多种细胞因子等局部因素,以及高血压病、糖尿病等全身因素的多重作用下,VSMC发生表型转化、增殖、迁移,导致移植血管重塑、狭窄[1,4]。血管平滑肌细胞由分化良好的收缩表型转化为去分化的合成表型,为以上病理过程的启动环节,阐明其具体分子机制,对防治移植血管再狭窄具有重要意义。
抵抗素是脂肪细胞和巨噬细胞分泌的富含同型半胱氨酸的肽类分子,具有引起胰岛素抵抗、诱发炎症反应、促使细胞增殖等多种生物学活性[5-6]。Hi⁃royuki等[7]研究发现,抵抗素可以诱导血管平滑肌细胞增殖,促进动脉粥样硬化形成。近期研究发现,抵抗素也可以促进高糖诱导的VSMC表型转化及增殖[8]。本实验通过抵抗素干预HVSMCs,通过RTPCR法检测显示,平滑肌细胞收缩型标志蛋白基因α-SMA明显减少,分泌型标志蛋白基因OPN表达明显增多,提示抵抗素可以诱导HVSMCs表型转化。
AMPK是调节细胞能量代谢关键激酶,通过感知细胞能量代谢状态,调节ATP合成与分解代谢,进而调节细胞生物活动[9];mTOR可感知细胞营养、能量代谢等外界刺激,整合细胞内信号传导,并传至细胞核内诱发相应生物效应[10]。实验研究证实,AMPK/mTOR信号通路在VSMC增殖、迁移及周期变化中发挥重要作用[11]。Yang等[12]通过大鼠动静脉瘘模型中发现,通过激活AMPK,抑制mTOR而抑制大鼠VSMC表型转化。本实验中发现,抵抗素可以诱导HVSMCs表型转化,与AMPK磷酸化表达减少,mTOR磷酸化表达增加有关。通过二甲双胍激活AMPK可以逆转抵抗素诱导的表型转化作用。据此,我们推测抵抗素可以通过抑制AMPK/mTOR信号通路诱导HVSMCs表型转化,在移植血管重塑中发挥起始作用。
Cyclin和细胞周期蛋白激酶(CDKs)组成的复合体Cyclin/CDKs是调控细胞周期的主要信号蛋白分子,其中CDKs保持相对恒定,主要通过Cyclin的周期变化来完成细胞周期调控[13]。Cyclin D1结合并激活CDK4而促进细胞周期由G1期进入S期,从而引起细胞增殖,在细胞周期调控中起关键作用[14-15]。研究发现,脂联素激动剂AdipoRon可以激活mTOR信号而上调Cyclin D1表达,抑制血小板生长因子诱导的VSMC增殖[16]。本研究显示,抵抗素可诱导HVSMCs的G0/G1期细胞减少,S期细胞明显增多,通过二甲双胍预处理HVSMCs后,G0/G1期细胞增多,S期细胞减少。进一步研究发现,Cyc⁃lin D1表达明显增加,而通过二甲双胍预处理细胞,Cyclin D1表达明显减少。这提示抵抗素通过抑制AMPK/mTOR信号,上调Cyclin D1表达,促进细胞进入S期,进而使VSMC由收缩型向合成型转化。
实验研究表明,二甲双胍具有抑制肿瘤细胞增殖,改善心肌细胞肥大,减缓血管内膜重塑等多种生物作用[17]。本研究发现,经二甲双胍预处理的HVSMCs明显改变细胞表型转化,可能与抑制AMPK/mTOR信号有关,但能否在移植血管狭窄防治中起到同样作用,需要进一步研究证实。
综上,抵抗素可以诱导HVSMCs表型转化,其机制可能是抑制AMPK,激活mTOR信号,进而上调细胞周期蛋白Cyclin D1表达,促进细胞进入S期,诱导表型转化。二甲双胍可减轻抵抗素对血管平滑肌细胞表型转换的作用,有潜在抑制冠脉移植血管平滑肌细胞增殖、重塑及防治移植血管狭窄的作用。

