国产体外膜氧合设备的研发现状和应用前景
任明仕,董士勇,申 华,王 嵘
体外膜氧合(extracorporeal membrane oxygena⁃tion,ECMO)是心脏外科体外循环技术的延伸,通过由主机、泵头、长效膜肺组成的人工心肺支持装备,为急性心/肺功能衰竭患者提供短期生命支持,为脏器功能恢复提供时间和机会。目前,临床上主要用于常规治疗无效的呼吸衰竭和/或循环衰竭重症患者的辅助支持、紧急心肺复苏和移植供体器官保护等。近年来,随着ECMO技术的进步,越来越多的临床科室开始应用该技术救治危重患者,包括心外科、心内科、呼吸科、重症医学科、急诊科、新生儿科等,使危重心肺衰竭患者从中获益[1-2]。新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的全球化传播进一步强化了医疗机构和公众对ECMO技术救治危重患者的认识。然而在我国,与该技术相关的设备及耗材仍完全依赖进口,存在来源受限和价格高昂等严重制约性问题,在面临大面积疫情爆发和局部战争冲突时,ECMO设备及耗材的短缺已成为严重“卡脖子”问题。基于此,ECMO设备及耗材的国产化研发已成为当前迫在眉睫的科技攻关任务。
1 ECMO技术开展现状
1.1 ECMO应用模式、场景及应用对象 目前,EC⁃MO在救治心肺功能障碍患者时,常采用静脉-动脉(veno-arterial,V-A)ECMO、静脉-静脉(veno-ve⁃nous,V-V)ECMO支持模式。V-A ECMO通过静脉插管将血液引出,经过膜肺氧合后,再经动脉插管回输至体内,可以起到循环及呼吸支持的作用。VV ECMO则是通过静脉插管将血液引出,经过膜肺氧合后,再经静脉插管回输至体内,只提供呼吸支持的作用。由于ECMO治疗技术相对复杂、风险高、费用高昂,且并发症较多,因此ECMO的实施需要在具有ECMO多学科治疗团队和丰富的实施经验的医疗中心开展,从而保证治疗的安全[3]。
ECMO技术救治的患者包括成人、儿童及少数新生儿,其中以成人为主。而根据国际体外生命支持组织(Extracorporeal Life Support Organization,EL⁃SO)统计,2018年世界范围内共计上报注册10 423例ECMO病例[4]。2021年全年世界范围内有17 777例患者(成人与儿童、新生儿的比例接近1∶1)接受了ECMO治疗[5]。截止到2022年初中国医师协会体外生命支持专业委员会和ELSO注册(数据为截至2022年4月)统计的ECMO开展数据见表1。
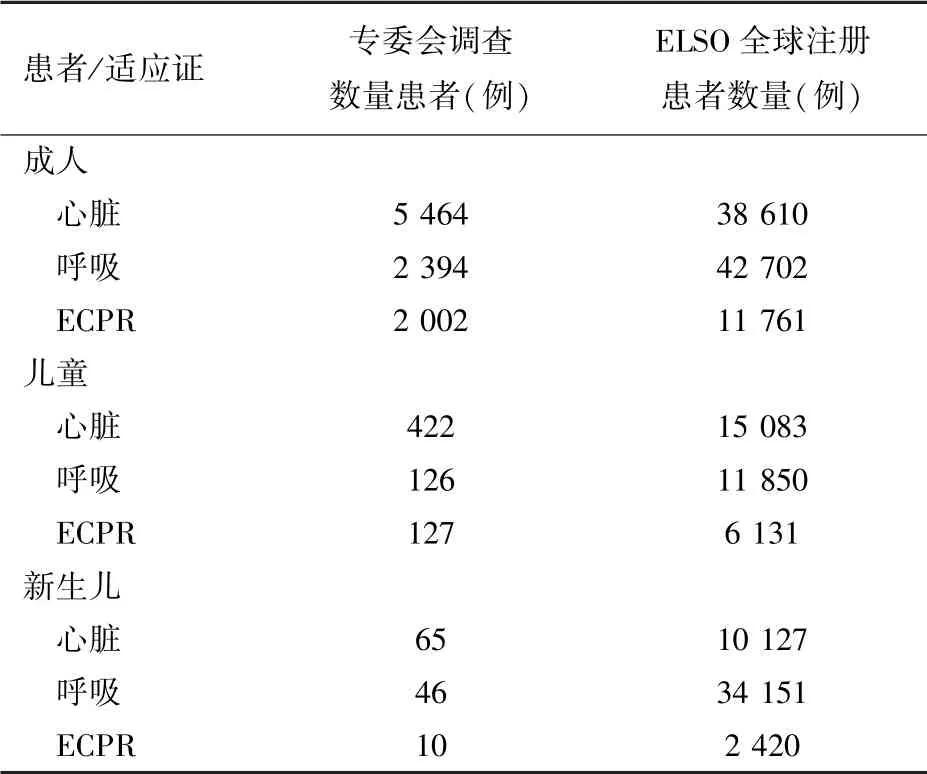
表1 2022年不同适应证患者体外膜氧合开展情况
1.2 国内ECMO开展现状 近年来,我国ECMO治疗例数增加迅猛,截止到2018年全国共233个医疗中心进行ECMO支持治疗2 826例患者[6]。随着COVID-19疫情的蔓延,相关性ECMO开展数量增加较明显。2022年初,经统计全国共有592家医院上报开展ECMO总例数达到10 656例,较前一年(6 937)增加53.6%。然而,国内能开展ECMO技术的592家医院中,仅仅约有14%能持续开展,开展5例以下的医院有248家,而开展50例以上的医院仅54家(见图1)。开展ECMO技术例数前十位的医院情况及地区分布见图2、3(数据均来自第六届中国医师协会体外生命支持委员会年会-2021中国ECMO调查报告)[7]。

图1 全国开展体外膜氧合的医院与例数分布情况

图2 体外膜氧合例数前十位的医院情况

图3 不同地区开展体外膜氧合的医疗中心和数量
1.3 开展条件及受限因素分析 ECMO在我国尚未全面普及,开展条件主要是依赖医疗机构团队技术能力水平和当地经济状况。值得注意的是,年开展ECMO例数20例以上的中、大规模ECMO中心,其患者的住院生存率要高于小规模ECMO中心,这与国际报道结论相一致[8]。由此可见,医疗机构团队能力水平与ECMO辅助的临床效果有很大关系,可以考虑对小规模的ECMO中心通过技术培训来解决;ECMO支持例数与开展中心数较多的省份基本为经济较发达地区,如经济较发达的华东、华南、华中与华北地区ECMO占全国总例数的87%[9]。可见ECMO的开展不仅受限于医疗机构团队能力水平,还与国外垄断导致的设备耗材的超高费用有关。如能尽快实现ECMO设备和一次性耗材国产化,将能大大加快ECMO技术的发展、推进临床应用步伐。
2 国产化ECMO设备及耗材的研发需求及现状
2.1 国产化ECMO研发需求 我国ECMO技术起步较晚但发展迅速,前期主要应用于心脏病领域,呼吸衰竭领域的大规模应用源于2009年新型H1N1流感在国内的流行和重症病例的集中出现。在此次COVID-19疫情期间,根据国家卫健委制定的《新型冠状病毒感染的肺炎诊疗方案》(试行第七版)建议,对于常规治疗无效的危重型患者可采用ECMO作为挽救性治疗[10],ECMO成为救治重症患者的重要医疗技术,在进一步降低COVID-19患者病死率方面发挥了积极作用。目前ECMO主机和耗材均被西方国家技术垄断。国内应用的ECMO主机和一次性耗材,主要来源于美国的美敦力(Medtron⁃ic)、德国的迈柯唯(MAQUET)公司提供,前者设备占据国内市场的20%左右份额,后者则占近80%。随着西方发达国家对发展中国家的经济限制加剧、COVID-19全球蔓延等因素,使得国内ECMO主机和一次性耗材短缺更加明显。因此,近年来,国家投入了大量科研经费来突破ECMO设备的关键技术,基金支持来源有国家自然科学基金、首都卫生科研发展专项计划、天津科技计划项目、辽宁省科技攻关计划项目和高等学校博士学科点专项科研基金。
2.2 国产化ECMO相关专利申请情况 专利是ECMO技术创新的重要方式和必要资源,据统计,2017至2019年,世界范围内ECMO技术及装备研发进入成熟期,发明专利申请量和申请人数量呈现波动式发展,关键技术难题需要有质的突破,如仪器设备与生物机体的组织兼容性,以期在尽可能少的并发症或无严重并发症的的情况下,开展长时间体外生命技术支持治疗。ECMO最核心的部件是膜肺和血泵,研发技术门槛高,是国产化过程中的攻关重点。目前技术创新热点聚焦于体外循环、体外生命支持、中空纤维、ECMO设备、血液处理等方向[11]。申请的专利数量在不同层面上反映ECMO研发技术创新活动水平[12-14]。据全球申请ECMO设备专利的情况来看,中国是全球第二大技术创新来源地。2016年后每年的发明专利申请量超越美国,居全球第一位,且领先优势明显,表明中国近几年在ECMO领域技术创新活跃,有较好的发展前景。已公开申请专利数量占前五位的单位分别是:广东顺德工业设计研究院4项(CN108553703A、CN108630858A、CN108704172A、CN108744099A)、深圳汉诺医疗科技有限公司荐2项(CN110404129A、CN109821086A)、中国人民解放军北部战区总医院2项(CN105816927B、CN105268040B)并已授权、赣南医学院第一附属医院2项(CN110124139A、CN110141704A)和北京精密机电控制设备研究所1项(CN307246626S)已授权,国内主要的体外膜氧合设备研发单位及研究进展见表2。
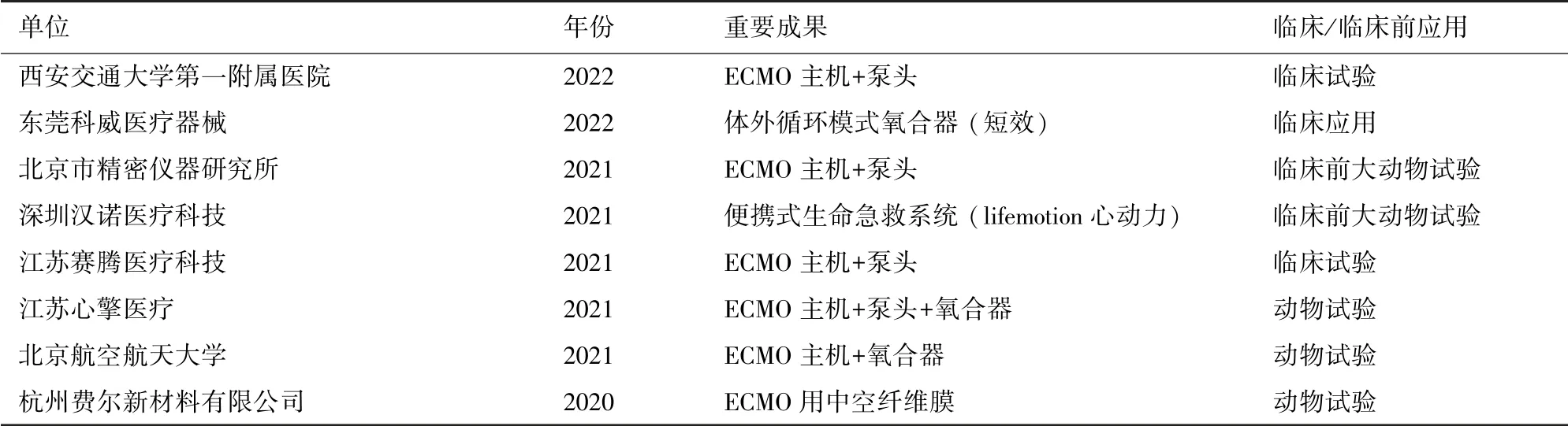
表2 国内主要的体外膜氧合设备研发单位及研究进展
2.3 国产化长效膜肺研究现状 膜肺也称为膜式氧合器,是体外循环运行中完成气体交换的装置。最初的膜式氧合器采用的是血液透析膜,于1956年由Kolff首次应用于临床。20世纪60年代至80年代,随着分子材料和医学工程领域的发展,平板式膜肺以及中空纤维膜肺先后问世。成功的膜肺氧合器研发,需要从膜材料研制、膜结构调控、纤维膜制备技术优化、膜丝排布、表面抗凝改性,以及组件设计等方面进行综合考量,其中膜材料研制以及中空纤维膜制备是关键所在。在膜材料方面,早期的血液透析膜多采用赛璐玢、聚乙烯或聚四氟乙烯等材料,但O2透过性差是其致命弱点。其后对氧气有较大透过性的硅橡胶类材料被应用于平板式膜肺的研制中,硅胶膜为无孔膜,需要较大的膜面积以保持O2交换速率,导致氧合器预充体积过大,血液破坏增加。多孔聚丙烯的出现有效解决了以上问题,无论是应用于平板式分离膜或中空纤维分离膜,均实现O2透过效率大幅度提高,从而有效减少了氧合器的预充体积和血液破坏程度,然而,血浆渗漏导致的血栓形成从而降低膜肺使用寿命又成为制约其发展的主要瓶颈[14]。近年来,聚4甲基1戊烯(Poly4-methyl1-pentene,PMP/TPX)成为长效膜肺的首选材料,该材料为无孔型结构同时具有优异的气体渗透性,因此在充分保证02/CO2交换的同时显著降低了血浆渗漏对膜肺寿命的影响。在纤维膜制备方面,中空纤维膜采用外腔走血、内腔走氧气的结构设计[14](图4),其优点是血液在中空纤维外流动可减少剪切力从而减轻血液破坏;减少血液层流从而提高血气交换效能[15];提高氧合能力从而减少中空纤维膜数量,进一步减少血液与异物接触的面积,降低预充体积。目前国际主流的商业公司长效膜肺均采用PMP热塑性树脂为材料的中空纤维膜设计方法,在理想的状态下其使用寿命可以超过4周。

图4 血氧交换流经示意图
我国在长效膜肺研发领域发展严重滞后,在膜材料研制、中空纤维膜制备等方面长期处于初级阶段。近年来国内部分学者和单位在膜肺中空纤维纺织技术及膜改性方面取得了显著进步,如南京工业大学崔朝亮等人在以PMP制备ECMO膜丝、编织成型方面取得了一定成果[16],湘雅医院在膜肺涂层改性方面取得了阶段性成果[17]。但目前仍无可应用于临床、甚至临床前研究技术成熟的膜肺产品。详见表3。
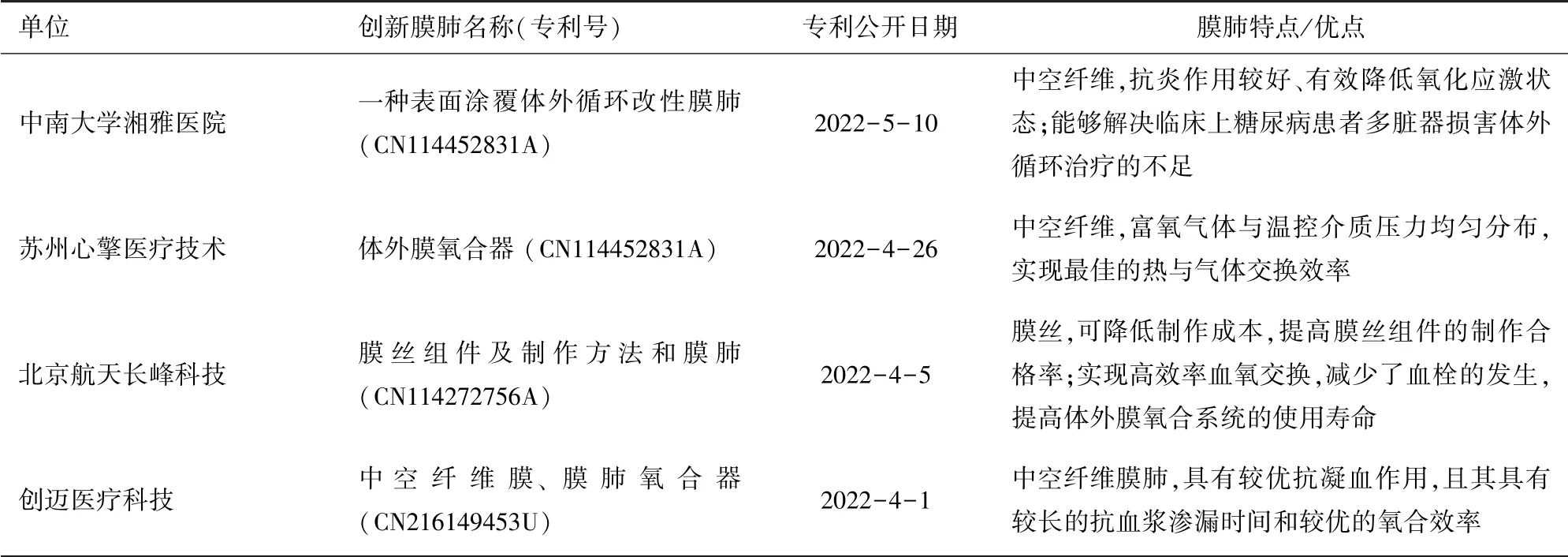
表3 已公开的部分体外膜氧合膜肺专利及相关信息
2.4 国产化ECMO离心泵和主机的研发现状 体外膜肺生命支持系统的另一个关键技术是离心血泵和主机,ECMO离心血泵的技术难点在于要达到足够的输出量、最少的血栓形成及血液成分破坏[18]。目前国内一些研究团队在此方面取得重大突破,研究出了全磁悬浮技术支持的ECMO主机及泵头[19],磁悬浮驱动泵头具有更高的压力缓冲、流量调节更可控、不易产生溶血等特点,相较于其它设备具有更小的体积、更高的安全性。江苏赛腾医疗科技有限公司研发的OASSIST ECMO设备和磁悬浮离心泵,具有控制系统集成化、小型化,便携式等特点。目前已在部分实验中心进行临床前大动物实验,短时间内的实验观察过程中,主机及离心血泵功能稳定,能够满足有效循环血容量的需求。但主机和离心血泵对血细胞的破坏程度、主要脏器功能影响的实验数据仍有待进一步完善。近期,由西安交大一附院等研发的国内首款ECMO主机和离心血泵率先应用于临床,成功救治两名危重心血管病患者。国内公开申请专利的ECMO设备和离心泵情况见表4。这些成果标志着我国在该领域实现重大突破。

表4 已公开的部分体外膜氧合设备和离心泵专利及相关信息
总之,国产化ECMO设备及相关一次性耗材的研发已取得了一定成果,但在氧合器原材料生产、膜丝制作、氧合器整体组装、膜表面改性及离心泵稳定性方面存在“短板”,是进一步应用实践的突破方向。
3 国产化ECMO设备的临床应用前景
ECMO作为一种新型的高级生命支持手段,在治疗危重症心肺功能衰竭上得到了广泛应用,救治成功率逐步提升[4,20-22]。随着COVID-19在全球流行并蔓延,病毒以极强的传染性导致肺部炎症反应,部分重症患者出现呼吸、循环功能衰竭。体外膜氧合生命支持技术,可以完全替代肺功能(V-V模式)或者完全替代心肺功能(V-A模式),ECMO技术的进一步优化、护理经验的进步,该技术将被更多的临床工作者认可并接受。研究表明,急性心源性休克、急性呼吸功能衰竭患者应用ECMO治疗,可保持有效的气体交换和循环状态[23-24],迅速改善此类患者重要脏器血液灌注[25],早期应用ECMO对于呼吸功能改善有显著效果,更为危重患者救治赢得时间。
随着我国老龄化社会的出现,我国老龄化人口逐渐增加,老年人患心血管疾病的人数正在急剧增加。以及前期工业化造成的空气污染对呼吸功能的潜在影响,未来一段时期内,我国呼吸系统疾病可能仍将处于较高的发病率状态。上诉疾病均可能在疾病发展的某个阶段需要ECMO治疗。随着ECMO治疗技术的逐渐成熟,其适应证和治疗时机正在不断扩展,ECMO的应用将有助于全国心血管外科领域更多急危重患者的救治[26],如在终末期心衰等待移植患者、供体器官保存、心肺移植器官保护及围手术期支持、体外心肺复苏、战伤救护等诸多方面,ECMO都有广阔的应用空间。
危重症患者有时需要特殊的检查、治疗,常面临转运艰难的困境。ECMO运转期间,患者院内转运甚至跨区域院际转运的安全保障,是后续治疗的关键环节。该场景对于ECMO设备的小型化、便携化、智能化、集成化的研发提出了新的要求。随着电子科技的发展,更加精密的集成电路系统使得ECMO设备小型化成为可能。
未来便携式ECMO将实现装置的小型化,可以实现病患的现场救治、院内行走、院间转运,极大地拓展了ECMO的应用范围。ECMO装备的发展方向将是:①一体化离心血泵、氧合器、热交换器,结构紧凑、减少溶血;②新表面涂层,无需抗凝,减少血栓并发症;③自动控制离心泵转速,保障体外血液循环稳定,简化操作;④集成的传感器技术,智能监测所有生理参数;⑤优化外观设计,结构稳固、便于携带、方便操作。
4 国产化ECMO研发面临的机遇及挑战
目前ECMO技术在国内蓬勃发展,随着相关管理和护理技术的日渐完善,临床上对ECMO技术的需求呈逐步增加的趋势,接受ECMO辅助治疗的患者数量也在不断增加,能够开展ECMO的中心数也在不断增多,它不仅提高了危重患者的抢救成功率,同时也为临床中新技术、新项目及高风险、高难度手术提供了重要保障,在呼吸、心血管重症救治单元救治中发挥了非常重要的作用。由于西方国家对生物材料和技术的垄断,膜氧合器的研发将面临诸多阻碍,如何解决ECMO长时间转流情况下组织液渗漏、保持氧合能力不下降、有效减少血栓形成等问题,将是最主要的挑战。未来,国产化ECMO设备和相关一次性耗材研发如能在仪器设备便携性、组织兼容性、数字一体化、操作简便化等方面做出突破性进步,将有望实现后来居上、弯道超车的效果,打破西方国家的行业垄断,更好的服务人类健康。
综上所述,目前我国在ECMO设备和离心泵的研发方面已经取得了突破性成就,膜氧合器的研发亦有重大突破。随着临床需求量的增加,必将加速ECMO设备及一次性耗材的研发进度,国产化EC⁃MO设备和一次性耗材未来几年内逐渐投入到临床应用中是极有可能的。

