海洋沉积物中甲烷代谢微生物的研究进展
陈烨,孙治雷,吴能友,刘昌岭,徐翠玲,辛友志,曹红,耿威,张喜林,翟滨,孙运宝,李晶,张栋,闫大伟,吕泰衡
1.自然资源部天然气水合物重点实验室,中国地质调查局青岛海洋地质研究所,青岛 266237
2.青岛海洋科学与技术国家试点海洋实验室海洋矿产资源评价与探测技术功能实验室,青岛 266237
甲烷是二氧化碳之外最重要的温室气体,在百年尺度上的增温潜能是CO2的28倍(IPCC, 2014)[1]。一般认为,甲烷的成因包括生物成因和非生物成因两种。非生物成因形成的甲烷是指在油页岩的高温加热分解或在热液系统水岩反应等过程中无机碳与氢气高温合成的热成因甲烷,而大气中80%的甲烷来自生物成因甲烷,该过程是在微生物的参与下完成的[2]。海洋占全球表面积的70%,每年产生的甲烷量为85~300 Tg,90%的甲烷在释放到大气圈之前会被由微生物参与的AOM所消耗[3-4]。甲烷厌氧氧化过程分为以SO42-为电子受体的硫酸盐还原型甲烷厌氧氧化[5](sulfate-reduction dependent anaerobic methane oxidation, S-AOM)、以NO3-/NO2-为电子受体的反硝化型甲烷厌氧氧化[6](denitrificationdependent anaerobic methane oxidation, D-AOM)以及后来发现的以Fe3+和Mn4+为最终电子受体的甲烷厌氧氧化(metal (Fe3+and Mn4+)-Dependent Anaerobic Methane Oxidation, Metal-AOM)[7]。AOM 在调控全球甲烷收支平衡以及缓解因甲烷引起的温室效应等方面扮演着十分重要的角色,已成为微生物生态学和生物地球化学领域的研究热点。
海洋沉积物是一个重要的生物地球化学反应器,有机质在运移、沉降、降解及埋藏的过程中,会伴随着一系列的生化反应。海洋沉积物中蕴藏着丰富的微生物,据估计,海洋沉积物大约含有2.9×1029个微生物细胞,相当于4.1 PgC,占地球总活体生物量的0.6%[8]。栖居在沉积物表层的微生物,利用氧气作为电子受体将复杂有机质进行降解。氧气在表层范围内被快速耗尽后,亚硝酸盐/硝酸盐、铁锰等金属离子和硫酸根成为微生物代谢的主要电子受体,将有机质进行厌氧降解,产生二氧化碳或甲烷。游离甲烷气以及溶解甲烷在高压低温的条件下,与水聚合成一种类似冰的具有笼型结构的晶体——天然气水合物,较为稳定地储存在沉积物中。当海底温度和压力条件发生改变时,海底水合物会发生分解,产生的甲烷气体在向上运移的过程中,与孔隙水中的硫酸根发生AOM反应,并在沉积物中形成硫酸盐-甲烷转换带(sulfate methane transition zone,SMTZ)(图1)。此外,ANME 古菌还可以利用NO3-、Fe3+以及Mn4+电子受体,将甲烷氧化成二氧化碳(图1)。AOM过程将产生HCO3-和HS-,这两种产物和孔隙水中的Ca2+和Fe2+结合,生成碳酸盐岩、黄铁矿、重晶石、石膏等多种矿物质。
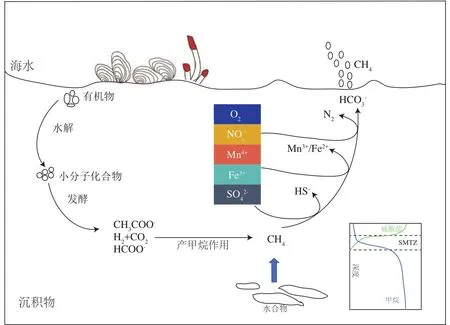
图1 海洋沉积物中甲烷的迁移与转化过程Fig.1 The process of methane migration and transformation in marine sediments
随着分子生物学技术和海底勘探技术的不断发展和进步,近些年来关于海洋环境中甲烷代谢过程的研究有了长足的发展,尤其是新的甲烷代谢方式和新的甲烷代谢微生物不断的被发现,同时,人们对甲烷代谢微生物在海洋环境中的分布模式有了新的认识。深入了解和研究海洋生境中微生物介导的甲烷代谢过程及其机理,对进一步理解海洋碳循环和控制甲烷气体的排放都有重要意义。本文主要对海洋环境中参与甲烷产生和氧化的微生物的种类及其在海洋环境中的分布特征进行了总结,此外,还对不同类型的产甲烷代谢途径和甲烷氧化途径进行了梳理,最后对未来的研究方向做出了展望。
1 产甲烷菌及产甲烷途径
1.1 产甲烷菌的种类
产甲烷菌是一类严格的厌氧古菌,生成的甲烷是厌氧呼吸的最终产物[9]。传统上,科学界认为产甲烷菌只属于广古菌门,可分为2大类6大目,第1 类 ClassⅠ,包括甲烷球菌目(Methanococcales)、甲烷杆菌目(Methanobacteriales)、甲烷超高温菌目(Methanopyrales);第 2 类 Class Ⅱ则包括甲烷胞菌目(Methanocellales)、甲烷八叠球菌目(Methanosarcinales)以及甲烷微菌目(Methanomicrobiales)[10-11]。然而,随着分子生物学技术的不断发展和进步,许多新型产甲烷古菌类群被发现。这些新型产甲烷古菌包括隶属于广古菌门的产甲烷菌马赛球菌目(Methanomassiliicoccales )[12]、Methanofastidiosa(WSA2)[13]和Methanonatronarchaeia[14]及深古菌门(Bathyarchaeota)[15]、 韦 斯 特 古 菌 门 (Verstraetearchaeota)[16]以及地古菌门(Geoarchaeota)[17]等。
1.2 产甲烷菌代谢途径
产甲烷菌依赖于其他微生物将复杂有机物质转化为简单的小分子化合物(氢、二氧化碳、乙酸盐、甲基类化合物),因而作用于厌氧氧化分解有机质的最后环节。有机质的厌氧分解需要一系列具有食物链关系的微生物群落完成。首先,水解细菌通过向胞外分泌水解酶,将蛋白质、碳水化合物和脂类物质等大分子化合物分解为简单的有机化合物如葡萄糖、脂肪酸单体。随后发酵细菌将简单有机化合物转化为一些活跃的化学小分子物质,如脂肪酸、醇类、氨、二氧化碳、氢气和硫化氢等。最后产甲烷菌利用乙酸、氢气、二氧化碳和一碳化合物产生甲烷(图2)。传统的3种产甲烷代谢途径已被学术界广泛认可:H2/CO2还原型、乙酸发酵型和甲基营养型(图2)[9]。在 H2/CO2还原途径中,CO2首先被甲酰甲烷呋喃脱氢酶(Fdh)还原为甲酰基,随后甲酰基与甲基呋喃(MFR)结合形成甲酰基甲基呋喃(CHO-MFR),此时甲酰基转移到四氢甲烷蝶呤(H4MPT)上形成次甲基复合物,次甲基复合物再依次被还原为次甲基(≡CH)、亚甲基(=CH)和甲基(-CH3),随后甲基在CoM甲基转移酶(Mtr)作用下转移至还原态的辅酶M(HS-CoM)上,最后,在甲基辅酶M还原酶(MCR)催化下生成甲烷。绝大多数产甲烷菌均可以利用H2/CO2还原产生甲烷。乙酸发酵型途径是乙酸盐的碳——碳键被打开,裂解为甲基基团和羧基基团,随后羧基基团被氧化成二氧化碳并产生电子供体H2,甲基基团被H2还原为甲烷。目前为止只发现Methanosarcina和Methanosaeta这两个属的产甲烷菌可以利用乙酸产甲烷[9]。兼性营养型Methanosarcina利用范围比较广,除了利用乙酸盐外,CO2、H2、甲基都可以作为底物生成甲烷。Methanosaeta则是专性乙酸营养型产甲烷菌,只能利用乙酸盐作为底物生成甲烷。此外,Methanosaeta只能利用低浓度的乙酸,而Methanosarcina能够利用的乙酸浓度较高[18-19]。甲基营养型途径则是一种典型的歧化反应,以甲醇、含甲基的硫化物(甲硫醇和二甲基硫)、含甲基的胺类(一甲胺、二甲胺、三甲胺和四甲基胺)为底物。反应过程中,四份甲基化合物经过Mtr的激活,一份甲基化合物被氧化为CO2,这一过程产生的H2将甲基化合物中的甲基基团还原为甲烷[9]。自然界中,只有甲烷杆菌目的Methanosphaera以及甲烷八叠球菌目能够利用甲基营养途径产甲烷[9]。随着微生物组学的快速发展,新型产甲烷途径——H2还原甲基化合物产甲烷代谢途径和烷基型产甲烷代谢途径相继被发现。在H2还原甲基化合物产甲烷途径中,甲基化合物以外源H2作为电子供体,还原甲基化合物中的甲基基团产甲烷。该途径最先发现于甲烷杆菌目和甲烷微菌目,随后又相继在新型产甲烷菌马赛球菌目(Methanomassiliicoccales),Methanofastidiosa,深古菌门(Bathyarchaeota)和韦斯特古菌门(Verstraetearchaeota)中被发现[20]。最近,研究人员在油藏的培养物中发现了一种新型产甲烷古菌Ca.Methanoliparum,并证实其可直接氧化长链烷基烃,并通过β-氧化、伍德-永达尔(Wood-Ljungdahl)途径进入产甲烷代谢,使得产甲烷作用不再通过多种细菌和古菌互营代谢来完成[21]。这种产甲烷途径的发现突破了产甲烷古菌只能利用简单化合物进行生长的传统认知,拓展了对产甲烷古菌碳代谢途径的认识,完善了碳素循环的生物地球化学过程,同时为开发绿色可持续的低碳技术提供了新的路径选择。

图2 海洋沉积物中低分子化合物的生成和产甲烷途径 [22]Fig.2 The generation of low-molecular-weight substrates and methanogenic pathways in marine sediments [22]
硫酸根含量丰富的海洋生境中,硫酸盐还原菌(Sulfate-reducing bacteria, SRB)在与产甲烷菌竞争共同底物乙酸盐和H2上占优势,因此传统上认为,甲烷的合成只能发生在SO42-被“耗竭”的产甲烷带。然而,近几年越来越多的研究表明,在硫酸盐丰富的浅层沉积物中产甲烷作用也可以发生,这是因为产甲烷菌能够利用硫酸盐无法利用的甲胺类、甲硫醇类和甲醇等一碳化合物生成甲烷[23-25]。这些非竞争性基质在海洋环境中普遍存在,来源于甜菜碱、胆碱、木质素、果胶和肌酸等物质的降解或细菌还原三甲胺氧化物[25-26]。Li等[27]在对南海福尔摩沙冷泉的研究中发现甘氨酸甜菜碱是甲烷生成的主要前体,细菌和产甲烷菌在甘氨酸甜菜碱还原产生甲烷途径中发挥着协同作用,细菌Oceanirhabdus将甜菜碱还原成三甲胺,随后产甲烷菌Methanococcoides利用三甲胺产生甲烷。此外,通过种间氢转移,产甲烷菌与SRB可能发生互养共生,从而使得硫酸盐还原区也能产生甲烷[28-29]。Xiao等[24]利用放射性同位素14C标记法对来自丹麦Aarhus Bay沉积物中甲烷产生速率进行测定表明,表层沉积物中产甲烷速率最高(>200 pmol·cm-3·d-1),甲基营养型产甲烷作用是沉积物中甲烷产生的主要贡献方式,这暗示着在硫酸盐丰富的表层沉积物中存在一个长期被忽略的“隐形甲烷循环”。Zhuang等[25]评估了西地中海表层和次表层沉积物中不同产甲烷底物和产甲烷途径对甲烷生成的贡献,表明表层沉积物中98%的甲烷来源于甲醇的代谢,而在硫酸根“耗竭”的深层沉积物中,H2/CO2还原型是主要的产甲烷途径,占甲烷总产生速率的67%~98%。Chen等[30]发现,向厌氧培养的南黄海沉积物中添加三甲胺会引起大量的甲烷产生,并导致甲基营养型产甲烷菌Methanococcoide迅速增加。由此可见,甲基营养型和甲基营养型微生物在SO42-含量高的海洋沉积物中发挥着重要作用。
2 甲烷好氧氧化菌及好氧氧化过程
根据细胞结构功能和系统进化关系的不同,甲烷好氧氧化菌(aerobic methane-oxidizing bacteria,MOB)可分为Type Ⅰ型和Type Ⅱ型2类,分别属于变形杆菌纲(Proteobacteria)的γ亚纲和α亚纲。Type Ⅰ型MOB利用核酮糖单磷酸(RuMP)途径同化甲醛,主要含16-C磷脂脂肪酸,胞内膜呈束状分布;Type Ⅱ型MOB则通过丝氨酸(Serine)途径同化甲醇,其占优势的磷脂脂肪酸为18-C脂肪酸,胞内膜沿着细胞质膜排列。Ⅹ型甲烷氧化菌同时具有Ⅰ型和Ⅱ型的一些特征,代谢途径既有丝氨酸途径也具有核酮糖单磷酸途径,偶尔也存在1,5-二磷酸磷核酮糖途径,磷脂脂酸碳的长度为16个碳,生长温度往往高于Ⅰ型和Ⅱ型甲烷氧化菌[31]。在分子氧存在的情况下,甲烷首先在甲烷单加氧酶(methane monooxygenase, MMO)的作用下氧化成甲醇(CH3OH),甲醇在甲醇脱氢酶(methanol dehydrogenase, MDH)的作用下生成甲醛(HCHO),甲醛通过丝氨酸(Serine)途径或核酮糖单磷酸(RuMP)途径进入碳同化途径,同时甲醛(HCHO)在甲醛脱氢酶(formaldehyde dehydrogenase, FADH)的作用下生成甲酸(HCOOH),甲酸在甲酸脱氢酶(formate dehydrogenase, FDH)的作用下产生二氧化碳和水[26]。图3为AeOM的代谢途径。其中,甲烷单加氧酶是参与AeOM的关键酶,可分为2类:一种是游离在细胞质中的可溶性甲烷单加氧酶(soluble methane monooxygenase, sMMO),存在于部分MOB中;另一种是与细胞膜结合,颗粒性的甲烷单加氧酶(particulate methane monooxygenase, pMMO),存在于除Methylocella、Methyloferula以外的所有已发现的MOB中[32-33]。

图3 MOB的代谢途径Fig.3 The metabolic pathway of aerobic methane-oxidizing bacteria
海洋生境中MOB的研究主要集中在深海中的冷泉系统和富含天然气水合物的上层水体和沉积物中。区别于传统的MOB类型,研究者利用pmoA和16S rRNA基因对海洋环境中MOB多样性进行研究,发现新型MOB OPU1、OPU3和Group-X是深海水体和沉积物中占主导地位的MOB[34-36],其中OPU1、OPU3与Ⅰ型MOB(Methylocladum和Methylococcus)亲缘关系较近[34-36],而Group-X与I型和II型MOB亲缘关系较远。
3 甲烷厌氧氧化古菌
3.1 硫酸盐依赖型甲烷厌氧氧化(sulphatedependent anaerobic methane oxidation,S-AOM)
从热力学角度出发,SO42-、Mn4+、Fe3+、NO3-都能作为电子受体将甲烷氧化(表1),其中S-AOM是海洋沉积物中甲烷消耗的主要途径。海洋水体中含有大量的硫酸盐,通过扩散作用,使海底浅层沉积物也富含SO42-。甲烷在海底深处形成,当甲烷向上迁移至厌氧层时,与向下扩散的SO42-相遇,在ANME古菌和SRB的共同作用下,发生S-AOM。参与S-AOM反应的微生物包括ANME和SRB,为尽可能减少能量的流失,这两类微生物通常以聚集体的形式存在[37]。ANME古菌属于广古菌门,基于16S rRNA基因进化分析,可分为3个类群:ANME-1、ANME-2和ANME-3(图4)。ANME-1分为ANME-1a、ANME-1b 2个亚群,与甲烷八叠球菌目(Methanosarcinales)和甲烷微菌目(Methanomicrobiales)有较远的亲缘关系[38]。ANME-2划分为ANME-2a、ANME-2b、ANME-2c和 ANME-2d 4个亚群,其中ANME-2a、-2b、-2c属于甲烷八叠球菌目,ANME-2d隶属于一个新的类群Methanoperedenaceae[39]。ANME-3则与拟甲烷球菌属(Methanococcoides)亲缘关系较近。3种类型的ANME古菌类群的16S rRNA基因序列差异较大,其基因同源性约为75%~92%[40]。在ANME-2中,亚群ANME-2a和ANME-2b来自一个连贯的进化枝,并与ANME-2c进化距离较远,因此,常将ANME-2a和ANME-2b合并归为ANME-2a/b[41]。除了ANME古菌以外,研究人员在南海神狐海域A27和SH1站位沉积物中发现Bathyarchaeota一些类群和产甲烷菌也可能参与了AOM反应[42]。此外,ANME古菌的新功能不断被发现。如上海交通大学张宇团队发现在深海沉积物中,ANME(ANME-2a)在氧化CH4产生无机碳的同时产生乙酸,为生态系统中的异养微生物提供碳源[43]。Metcalfe等[44]则发现参与深海沉积物中AOM作用的ANME古菌(ANME-2b)和SRB细菌(SEEP-SRB1g)共生聚集体还具有固氮的能力。

图4 基于mcrA序列的ANME古菌系统发育树 [40]Fig.4 The phylogeny of mcrA gene in anaerobic methanotrophic archaea[40]

表1 不同电子受体类型甲烷氧化反应的吉布斯自由能[45-46]Table 1 Standard Gibbs free energies with different electron acceptors for methane oxidation [45-46]
海底冷泉是指富含甲烷及其他富碳氢化合物的低温流体从海底表面喷溢的区域。其中,由ANME古菌和SRB介导的AOM过程,为化能合成生物群落繁衍提供了碳源和能量,成为冷泉生态系统的初级生产者。ANME各个亚群在不同地化环境的沉积物中具有不同的分布特征。其中ANME-1和ANME-2广泛分布于各种天然冷泉环境中,而ANME-3分布在有大量甲烷释放的冷泉区,如水合物脊(Hydrate Ridge)、Sonara Margin冷泉、Haakon Mosby泥火山[49]。垂向分布上,ANME-1在缺氧、富含甲烷和硫酸盐含量低的深层沉积物中占优势主导地位,相比之下,ANME-2a和ANME-3则出现在硫酸盐浓度较高而溶解硫化物和甲烷浓度较低的浅层沉积物中[47-48]。ANME-1a与ANME-1b的生态位分化仍存在疑问,我们在对冲绳海槽冷泉沉积物ANME古菌群落的研究中发现,ANME-1a在垂向上的分布受Fe2+的影响[49]。ANME古菌亚群生态位的分化,意味着其代谢和功能的多样性[50]。在一项最新的研究中,研究者以连续培养十余年的深海泥火山ANME-2a为富集物,运用流动高压培养系统模拟冷泉系统,探究冷泉的喷发对有机碳循环和微生物群落结构的影响。研究表明,在喷发状态下,ANME古菌和SRB含量降低,产甲烷古菌Methanolobus取代ANME-2a成为优势古菌类群,甲基营养型细菌Pseudomonas、Halomonas和Methylobacter取代SRB转变为优势细菌类群[51]。同时,在喷发条件下,有机物的转化途径以及群落的代谢网络变得更加复杂[51]。
甲烷的厌氧氧化过程普遍被认为是产甲烷反应的逆反应过程。1994年,Hoehler等[52]正式提出了甲烷氧化的逆甲烷生成途径:甲烷经ANME的作用通过甲烷生成的逆反应途径最终生成CO2,在这个过程中产生的电子传递给SRB,将硫酸盐还原。2004年,Hallam等[53]应用全基因组鸟枪测序和基因组文库,发现ANME-1基因组中除了缺少参与甲基和亚甲基氧化还原反应的Mer基因外,包含了几乎所有甲烷产生途径所需的基因,从而支持了逆甲烷生成途径的推测。陈颖[54]对仅由古菌ANME-2a构成的细胞团进行了高通量测序和序列组装分析,发现ANME-2a的基因组中包含有一套经典的完整七步甲烷产生途径所需的基因,并且转录组分析显示这些基因都是活跃表达的,这其中包括了两套先前报道在ANME-1中缺失的Mer基因和亚甲基氧化还原反应的mer基因,这一研究支持了前人关于ANME氧化甲烷可能采用逆向甲烷产生途径的假说,还表明不同的甲烷氧化古菌(ANME-1,ANME-2)采用了不同的甲烷氧化代谢途径。除了逆甲烷生成途径外,S-AOM发生的途径还存在Valentine和Reeburgh[55]提出的乙酸化理论模型和Moran[56]提出的甲基化理论模型。其中乙酰生成途径有2种方式,一种是甲烷被水氧化生成乙酸和氢气,生成的氢气将硫酸盐还原(反应式(1)-(3));第二种途径是CO2和甲烷在ANME的作用下产生乙酸,SRB利用乙酸将硫酸盐还原成HS-,同时生成 CO2(反应式(4)和(5))。甲基生成途径是甲烷和HS-通过ANME古菌生成甲硫醚,CH3SH被SRB 利用,生成 HS-和 HCO3-(反应式(6))。
乙酰生成途径第1种方式:
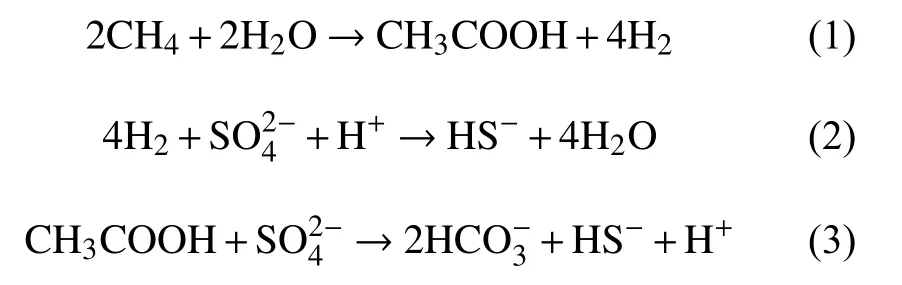
乙酰生成途径第2种方式:
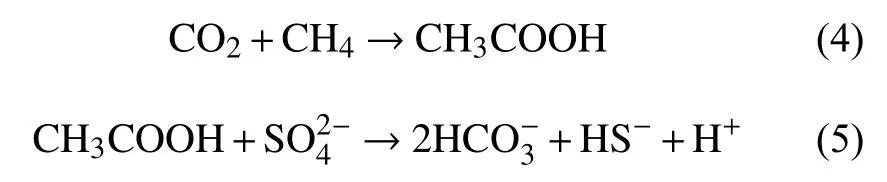
甲基生成途径:

3.2 反硝化型甲烷厌氧氧化(denitrifying anaerobic methane oxidation, D-AOM)
从热力学的角度推断,NO3-/NO2-比SO42-更适合成为甲烷厌氧氧化的电子受体(表1)。直至2004年,Islas-Lima等[6]首次在反硝化污泥中证明了D-AOM过程的存在,但并未对其参与的功能微生物菌群进行分析。2006年Raghoebarsing等[57]应用同位素标记研究发现D-AOM过程是由古菌和细菌共同作用完成,16S rRNA的系统发育表明细菌属于NC10门,Ettwig等[46]将此类新发现的微生物命名为Candidatus Methylomirabilis oxyfera(M.oxyfera);而古菌属于ANME古菌,随后由Haroon等[39]证实其隶属于ANME-2d,将其命名为“Candidatus Methanoperedens nitroreducens(M.Nitroreducens)”。Ettwig等[58]研究发现,以NO2-为氮源的培养基继续培养后,随着富集时间的推移,ANME古菌数量不断减少直至完全消失,推测DAMO过程可由M.oxyfera细菌独立承担完成,而ANME-2d则在以NO3-为基质的DAMO过程中起关键作用。
海洋环境中普遍存在的AOM是与硫酸盐相耦联的,也是海洋沉积物中甲烷消耗的主要途径,对其研究比较深入。但是对海洋中的N-AOM的研究起步较晚,Chen等[59]在南海表层和次表层沉积物样品中检测到了D-AOM细菌的16S rRNA和pmoA基因序列,这是首次在海洋生境中发现了D-AOM细菌,进而推测海洋沉积物中可能发生D-AOM反应。Padilla等[60]在墨西哥北部和哥斯达黎加以外低氧区(OMZ)发现了隶属于NC10门的细菌,并且具有转录活性,其丰度在亚硝酸盐和甲烷浓度升高的区域达到了最高值。表明NC10门的细菌对于OMZ地区的氮、氧、甲烷的循环发挥着重要的作用。
D-AOM反应机理包括M.oxyfera细菌通过内部产氧机制耦合亚硝酸盐还原与甲烷的厌氧氧化,以及M.Nitroreducens古菌通过逆向产甲烷途径耦合硝酸盐还原与甲烷的厌氧氧化[61]。Ettwig等[46]利用宏基因组揭示了M.oxyfera的内部产氧DAOM途径,即NO2-在亚硝酸盐还原酶(Nir)作用下生成NO,生成的NO被未知的NO歧化酶分解为N2和O2,生成的O2一部分用于催化AeOM途径,最终生成CO2,剩余O2用于正常的呼吸作用(图5)。Haroon等[39]运用宏基因组学、单细胞基因组学和宏转录组学等分子技术结合13C、15N的同位素标记,证实参与D-AOM的ANME-2d古菌通过反向产甲烷途径氧化甲烷,获得的电子用于硝酸盐的部分反硝化。在M.nitroreducens基因组中包含了所有编码甲基辅酶M还原酶的基因(mcrABCDG)和编码辅酶F420型甲基辅酶M转移酶的基因(mer)。与此同时,在其基因组中也发现了NO3-还原酶编码基因,但是并未在M.nitroreducens细胞内检测到参与反硝化后续步骤的相关编码基因。因此M.nitroreducens只能完成将NO3-还原成NO2-的部分反硝化[39]。
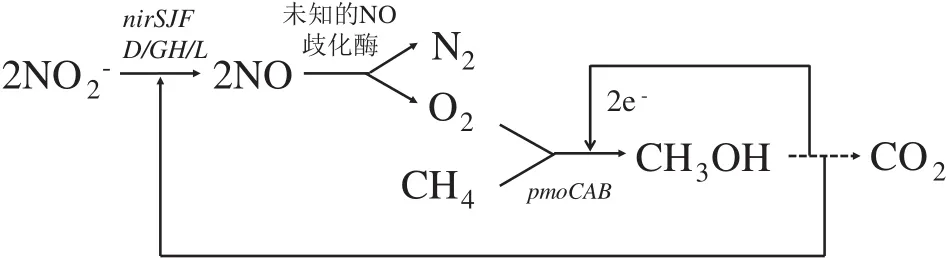
图5 Methylomirabilis oxyfera 的DAMO理论途径[46]Fig.5 Theoretical approach of DAMO in Methylomirabilis oxyfera[46]
3.3 铁锰依赖型甲烷厌氧氧化(manganese-and iron-dependent anaerobic methane oxidation, Metal-AOM)
Metal-AOM是发现相对较晚的一种AOM类型。研究发现在一些海洋沉积物SMTZ底部或产甲烷带(methane zone, MZ)中,尽管硫酸盐、氧气、NO3-/NO2-等电子受体被耗尽,甲烷仍然以相当快的速度进行氧化[62-65]。此外,在一些AOM与硫酸盐还原(Sulfate reduction,SR)共存的环境样品中,AOM的反应活性明显高于SR反应活性,表明体系中AOM很可能部分依赖于其他可用的电子受体[66-67]。Beal等[7]对加利福尼亚Eel River盆地甲烷渗漏区进行了长时间的富集培养实验,发现沉积物中的微生物在缺乏硫酸盐的条件下,能够利用锰(水钠锰矿)和铁(水铁矿)进行甲烷氧化,这是首次通过实验室培养微生物的方法证实海洋环境中AOM的发生可以以直接或间接的方式和金属化合物相耦联。已有的研究表明,与甲烷代谢相关的微生物如ANME-1、ANME-2a、ANME-2c、ANME-3、ANME-2d、Candidatus Methanoperedens ferrireducens、产甲烷古菌(Methanosarcina acetivorans,Methanobacterium)和MOB均有可能直接或间接参与了Fe-AOM过程[7,68-74]。此外,某些细菌如脱硫单胞菌属(Desulfuromonas)、脱硫弧菌(Desulfovibrio)、拟杆菌属(Bacteroides)、疣微菌(Verrucomicrobia)、酸杆菌(Acidobacteria)、纤维单胞菌属(Cellulomonas)、暗杆菌属(Pelobacter)、放线纤丝菌属(Actinotalea)等微生物可能作为它们的合作伙伴,对金属还原起重要作用[7,73]。但是,环境样品的复杂性使得介导Metal-AOM发生的功能微生物类群尚未获得一致的认识,需要进一步开展研究进行探索。
Metal-AOM反应的具体机制尚不明确,目前根据研究所得可能的机制有3种[75](图6):第1种是ANME 古菌(如ANME-2a、2c、2d)单独负责Metal-AOM的整个过程[68-69];第2种反应机制类似于硫酸盐还原作用耦合甲烷厌氧氧化机制,首先ANME氧化甲烷,并将产生的电子直接传递至金属还原微生物(Metal-reducing microorganism, MRM),进而将金属氧化物进行还原,是两种微生物合作进行Metal-AOM的模式[76];第3种是以硫化物存在为前提形成零价硫,以FeS为例的反应方程为:Fe(OH)3+FeS+6H+→3Fe2++S0+6H2O。零价硫通过一个隐藏的硫循环过程反应生成负二价硫和硫酸盐,产生的硫酸盐可以与甲烷发生S-AOM,进而氧化甲烷,这种AOM的发生是以间接的方式和金属化合物相耦联[77]。

图6 微生物介导Metal-AOM的不同反应机制[76]a.ANME单独负责Metal-AOM, b.ANME与合作伙伴MRM的合作进行Metal-AOM, c.金属氧化物促进S-DAOM的Metal-AOM。Fig.6 Different mechanisms of microbe-mediated metal-AOMa.metal-AOM by ANME alone, b.metal-AOM by cooperation between ANME and partner MRM, c.apparent metal-AOM by the stimulation of metal oxides on sulfate-AOM.
Metal-AOM(以Fe-AOM为例)可能是海洋生态系统中普遍存在的过程,在调节深海沉积物甲烷通量方面发挥着重要作用[78]。此外,Fe-AOM过程的产物Fe2+和CO2影响着硫和磷的地球化学循环以及自生矿物的形成[78]。因此,Fe-AOM过程对全球碳、硫、磷以及金属元素的循环发挥着重要的作用[78]。
4 展望
(1)深海属于极端环境,理化环境的特点是高压、黑暗、缺氧、不同环境温度差异大,在这种环境下海底深部生物圈容纳了类型多样、生物量巨大并且代谢独特的微生物。以深海不同环境中的微生物为研究对象,利用同位素标记对功能微生物进行室内富集培养,同时结合单细胞测序、宏基因组、宏转录组和宏蛋白组等分子研究手段,将会极大促进对参与甲烷代谢过程新型菌种及新代谢途径的认识。
(2)Metal-AOM在近几年越来越吸引学者的注意,这不仅由于Metal-AOM可以消耗沉积物中的甲烷,而且Metal-AOM在生物地球化学循环和地质演化中具有重要作用。虽然不断有地球化学与分子证据显示海洋沉积物中存在微生物参与的Metal-AOM,但对有关该过程的微生物作用机制和所涉及的微生物群落成员还应进行进一步的探索。
(3)产甲烷和甲烷氧化联系着海洋中的碳、氮、硫、金属等循环过程,如硫酸盐的还原过程与AOM相结合,形成S-AOM反应;硝酸盐的还原过程与AeOM相结合,形成N-AOM反应;金属的还原过程与AOM相结合,形成Metal-AOM反应,但是这些过程中涉及的微生物之间的相互作用以及其中的生命代谢过程还不够明晰,揭示这些元素循环过程与甲烷代谢过程的耦合效应,是将来海洋生境生物地球化学循环的重要研究方向。

