全能的小分子膦
——第54届国际化学奥林匹克试题第6题解析
贺峥杰
南开大学化学学院,天津 300071
1 出题依据
在2000年之前,当人们谈及催化时通常仅指酶催化和金属催化;而在2000年之后,催化则不仅包括酶催化和金属催化,还包括有机催化或有机小分子催化。有机催化这一概念最早可以追溯到1932年,德国化学家沃尔夫冈·朗根贝克(Wolfgang Langenbeck)首次提出了有机催化剂(Organic Catalysts)这一概念,并于1949年出版了《Organic Catalysts and Their Relation to the Enzymes》(有机催化剂及其与酶的关系)学术专著。半个世纪之后的1999年,法国化学家亨利·卡根(Henry B. Kagan)在其著作《Comprehensive Asymmetric Catalysis》(不对称催化全书)中将非金属催化归属为有机催化(Organic Catalysis)。2000年美国化学家戴维·麦克米伦(David W. C. MacMillan)教授进一步定义了有机催化(Organocatalysis)这一概念,至此有机小分子催化正式成为第三类催化方式[1]。
用作催化剂的有机小分子通常具有特殊分子结构或官能团,拥有多样的催化机制和自禀的特征。与酶相比,有机催化剂结构简单,合成更容易,也更稳定,使用方便;与金属催化剂相比,有机催化剂价格低廉,使用条件温和,对环境友好,同时可以避免金属催化在药物合成中的金属残留问题。因此,作为一类新的催化剂,有机催化剂在过去二十多年中受到了人们的广泛关注,相关领域也得到了快速发展,涌现了大量基于有机催化的高效、高立体选择性的有机合成反应,极大地丰富了有机合成的手段[2,3]。正因为如此,2021年诺贝尔化学奖授予了德国化学家本杰明·李斯特(Benjamin List)和美国化学家戴维·麦克米伦,以表彰他们在有机小分子不对称催化领域所做出的开创性贡献[4,5]。
叔膦作为一类具有较强亲核性的有机路易斯碱,长期以来广泛用作过渡金属催化剂的配体。1995年,我国化学家陆熙炎院士首次报道在亲核性叔膦催化下,缺电子联烯酸酯与丙烯酸酯可顺利地发生(3+2)环加成反应,生成环戊烯衍生物[6]。这一工作不仅发展了一种合成五元碳环的高效方法,而且揭示了亲核性叔膦本身也可以作为高效的有机催化剂促进反应的发生,并由此开创了亲核膦有机催化的先例。经过最近二十多年的快速发展,亲核有机膦催化已成为有机小分子催化领域的一个重要研究方向,同时,也实现了大量具有重要合成意义的膦催化有机反应,由此,有机膦催化已发展成为有机合成的重要工具[7-9]。
第54届国际化学奥林匹克试题中的第6题以有机催化这一最具活力的研究领域为科学背景,以我国化学家陆熙炎院士发展的陆氏(3+2)环加成反应为题材,围绕陆氏反应的发生、反应机理、不对称反应,以及在有机合成中的应用等内容进行设问,以便综合考查考生的有机化学基础理论知识、学习能力和逻辑推理能力,同时也向考生展示了有机小分子催化这一新的化学领域。
2 题目及解析
2.1 题目[10]
膦是胺的结构类似物,磷原子上也带有一对孤对电子,因而膦同样表现出路易斯碱性或亲核性。但与叔胺不同,磷原子上带有三个不同取代基的手性膦如P1能够以单一对映异构体分离得到。手性膦常常作为手性配体应用于过渡金属催化。
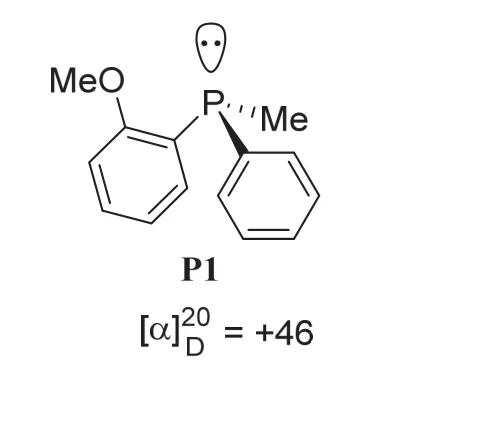
6-1 (3分) 请判断手性膦P1的绝对构型,用R/S符号表示。
在过去的二十年中,随着有机小分子催化的快速发展,涌现了大量亲核膦催化的有机合成反应。在这些反应中,最著名的膦催化反应当属陆氏(3+2)环加成反应,该反应由中国科学家陆熙炎教授首次实现。例如,在三苯基膦催化下,联烯酸乙酯1与丙烯酸甲酯2顺利反应,生成两环戊烯衍生物3 (主要产物)和4 (次要产物)。
陆氏(3+2)环加成反应:
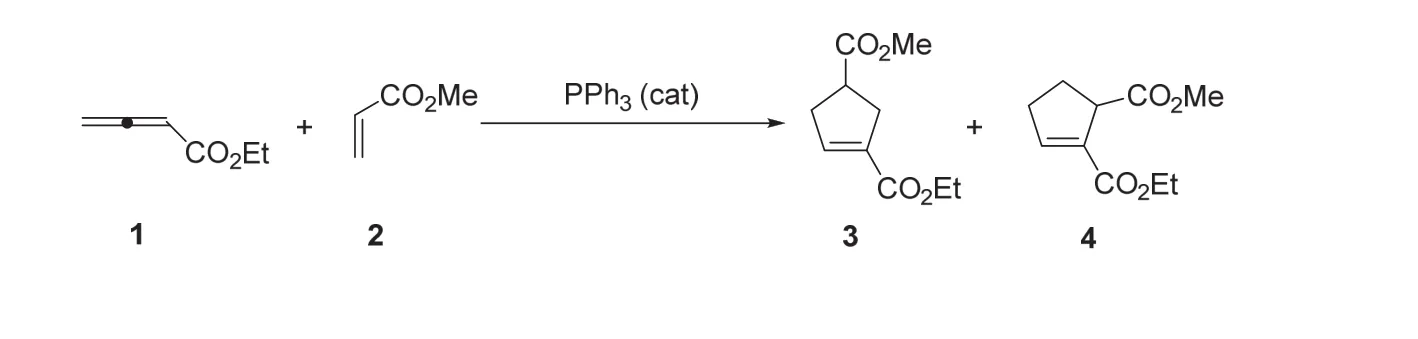
根据普遍认可的反应机理,陆氏(3+2)反应仍属于一个形式上的环加成反应。首先,催化剂三苯基膦与联烯酸乙酯1发生亲核加成反应,产生内盐中间体A,然后该中间体经两条途径与丙烯酸甲酯2进行关环。在形成化合物3的关环途径中,原位生成的磷叶立德中间体B经可逆的质子转移步骤转变成中间体C;中间体C通过消除反应生成主要产物3,同时释放出膦催化剂。在形成化合物4的关环路径中,生成的磷叶立德中间体B’同样经质子转移步骤可逆地转变成中间体C’;中间体C’经消除反应生成次要产物4,并再生膦催化剂。
机理:

6-2 (6分) 请画出共振杂化体A所包含的两个主要共振结构式(不考虑酯基参与共振的情形,且不要求立体化学)。
6-3 (8分) 请画出中间体B’和C’的结构式(不要求立体化学)。
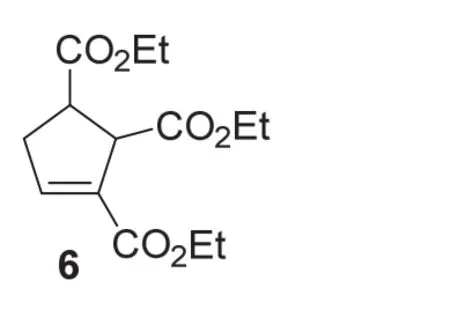
在类似的条件下,联烯酸乙酯1与富马酸二乙酯5反应,顺利地生成相应的环加成产物6。
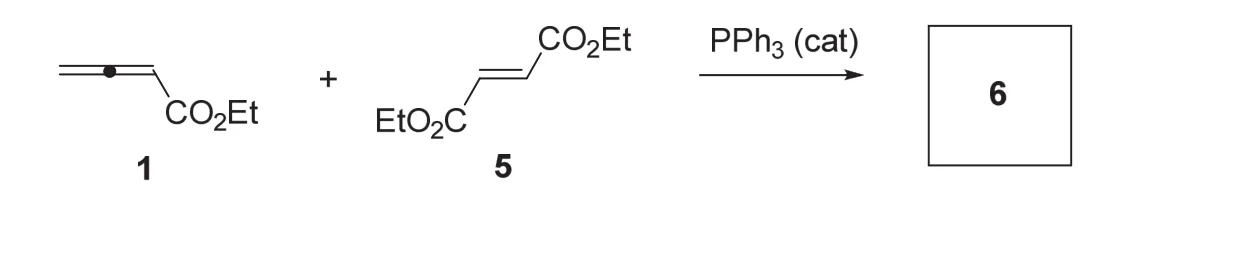
6-4 (5分) 请画出化合物6的结构式(不要求立体化学)。
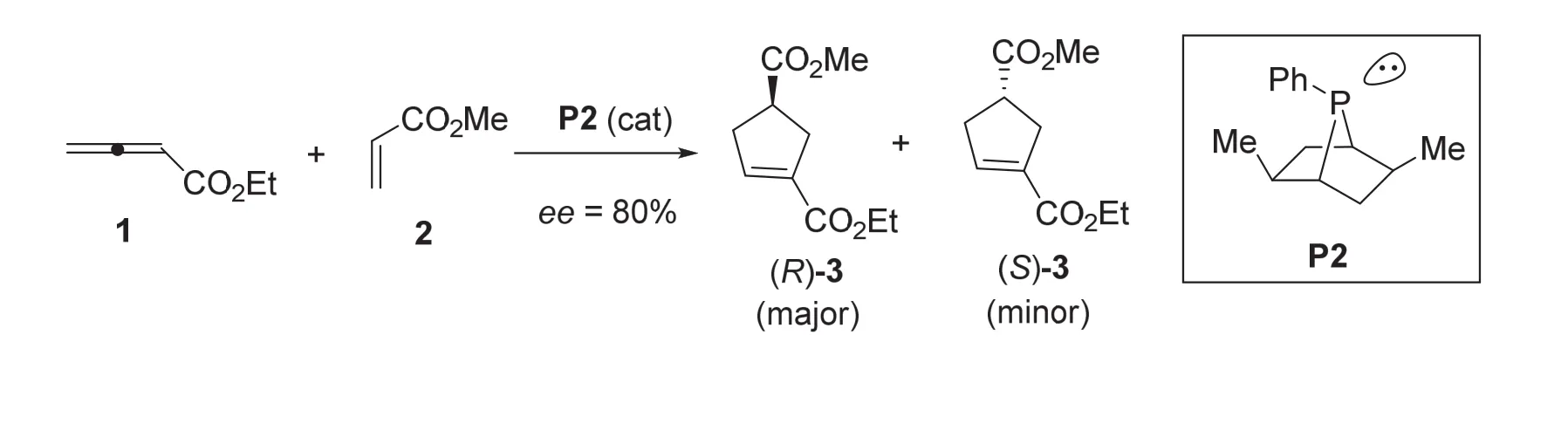
通过选用手性膦催化剂,可以顺利地实现不对称陆氏(3+2)环加成反应。例如,在手性双环膦P2的催化下,联烯酸乙酯1与丙烯酸甲酯2顺利地发生不对称环加成反应,以80% ee值生成对映体富集的产物3。
不对称陆氏(3+2)环加成反应:

ee值计算公式:
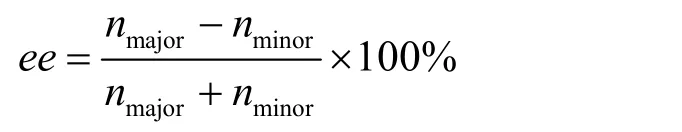
nmajor= 产物中主要对映体的量;nminor= 产物中次要对映体的量。
6-5 (6分) 请用星号(*)标出手性膦P2中的手性中心。(注意:每标错一个将扣除一定的分数,直至本小题得0分为止。)
6-6 (3分) 请给出产物3中nmajor/nminor的值。
陆氏(3+2)环加成反应在有机合成中具有广泛的用途。例如,它成功应用于合成(-)-茅苍术醇(hinesol),该化合物是中草药苍术(Chang Zhu) (Atractylodes lancea var Chinensis)的重要成分。在三苯基膦催化下,手性环己酮7与联烯酸叔丁酯8发生关环反应,生成主要产物9及三个次要产物10、11和12。次要产物10-12均是产物9的同分异构体。从化合物9出发,经过一个多步合成过程,可顺利实现(-)-茅苍术醇的合成。
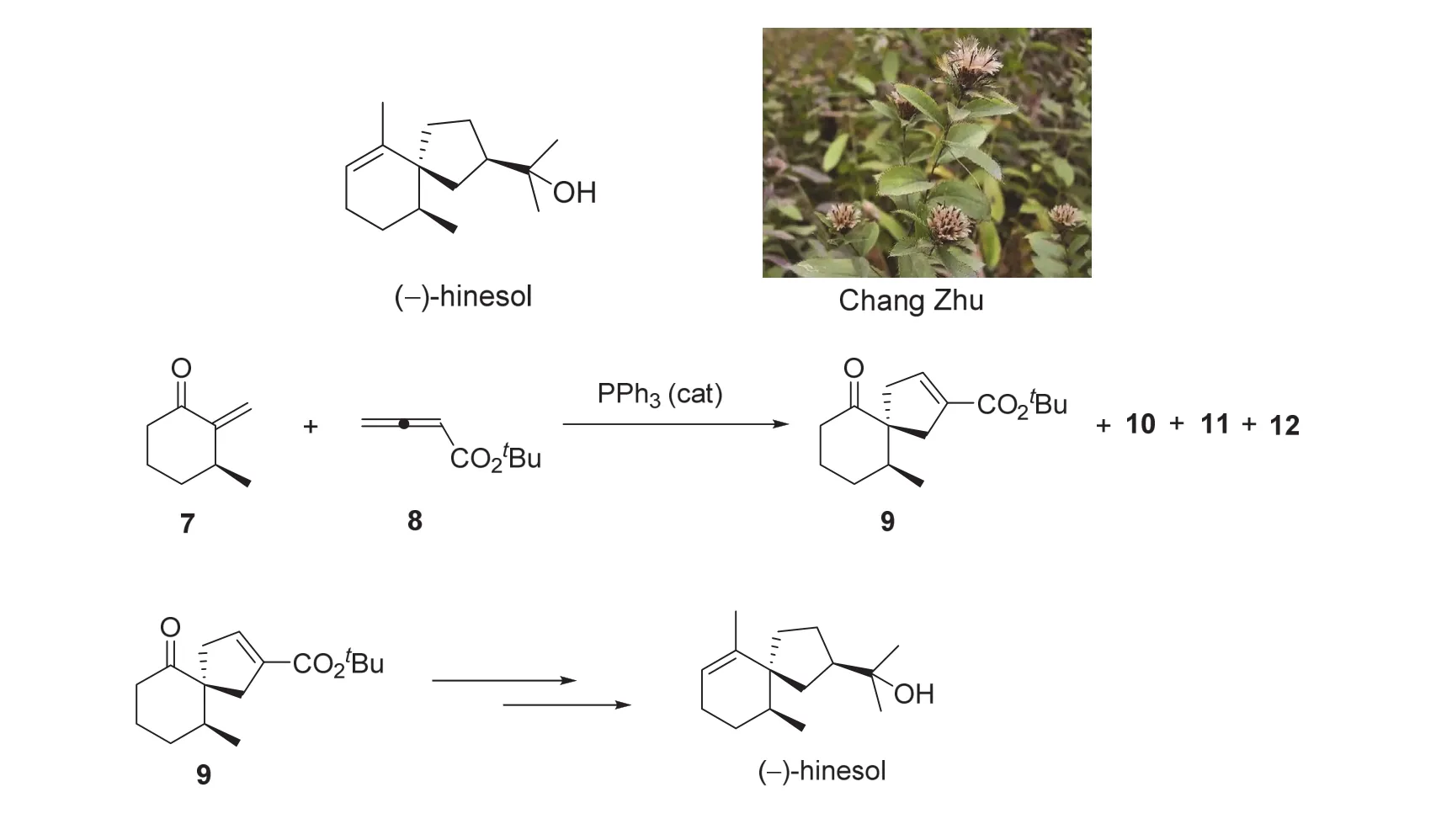
6-7 (5分)在下列化合物中,请指出哪一个不属于次要产物10-12。
2.2 答案与解析
6-1小题属基础题,考查考生关于中心手性构型的标注规则。对于不含手性碳的中心手性分子,如具有四面体形状的手性季铵盐或硅烷类分子,以及具有三角锥形状的手性膦或亚砜类化合物,其手性中心构型的标注遵循手性碳构型的标注规则,即按照手性中心原子上连接的原子或基团在立体化学次序规则(Cahn-Ingold-Prelog Rules)中的优先次序进行排序。在本小题中,手性膦P1具有三角锥形状,手性中心磷原子上所连接的三个基团的优先次序为:邻甲氧基苯基>苯基>甲基;将磷原子上的孤对电子(可以看成优先次序最小的原子或基团)摆在远离观察者的方向,磷原子上其他三个基团指向观察者,此时我们可以看到,手性膦P1分子上的三个基团按照立体化学优先次序呈顺时针方向排列,因此,P1分子的绝对构型为R构型。6-1小题的答案为R。此小题虽为基础题,但在实际竞赛中仍有不少学生在此小题上失分。

6-2小题和6-3小题以陆氏(3+2)环加成反应的机理设问。试题先解释了陆氏(3+2)环加成反应中主要产物3的形成机制,从而让学生了解膦催化的作用机制,并根据这一现学的新知识,推测次要产物4的形成机制。
6-2小题以陆氏反应中产生的内盐中间体A进行设问,内盐中间体A以烯丙基碳负离子的共振杂化体形式表示,考查考生的共振理论知识。为降低试题的难度,试题中特别强调只写出共振杂化体A所包含的两个主要共振结构式,同时不考虑酯基参与共振的情形及共振结构式的立体化学。由共振杂化体A代表了烯丙基碳负离子鏻盐可知,其所包含的两个主要共振结构式为负电荷分别定域在α-和γ-位的烯丙基碳负离子鏻盐A和A’。由于不要求立体化学,写出A’的另一个立体异构体也是正确答案。
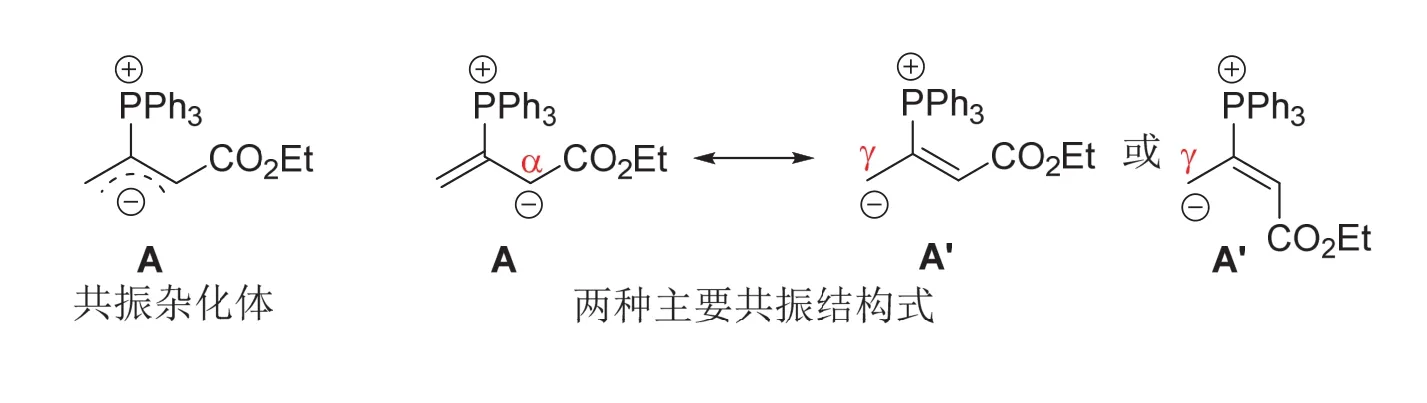
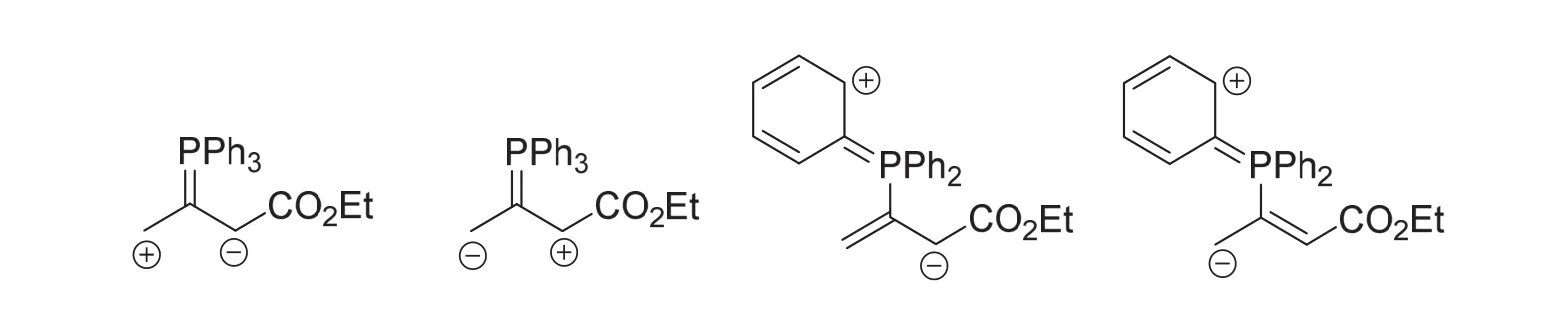
如果进一步移动双键,可写出如下含有P=C双键的共振结构式。由于P=C双键只能理解为磷叶立德结构才是合理的,因此含有P=C双键的共振结构式均不是共振杂化体A的主要贡献者,这类答案在实际竞赛中并没有得分,也不是正确的答案。6-2小题的正确答案为A和A’。
6-3小题主要考查考生的学习能力和逻辑推理能力。根据陆氏(3+2)反应方程式,产物3和4为区域选择性异构体产物;同时,根据主要产物3的形成机制以及对产物4形成机制的叙述,中间体B’应该是具有与中间体B相似结构的磷叶立德,其差别仅在五元环上酯基的相对位置不同,因此中间体B’应该具有如下的结构:

而中间体C’是由中间体B’经可逆的质子转移过程而产生,因此,C’具有与B’相同的分子骨架;同时参照中间体B到C的可逆质子转移过程,可以推断出C’具有如下结构:
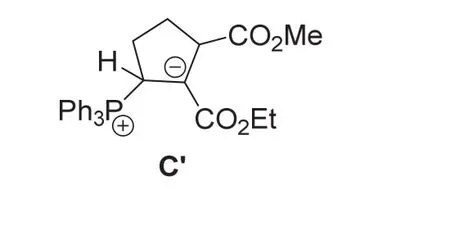
虽然中间体B’和C’之间存在可逆的平衡,但根据陆氏反应机理,中间体B’应该先形成,因此,在实际竞赛中,如果考生将B’和C’的结构互换了,则不得分。
6-4小题进一步考查了考生对陆氏(3+2)环加成反应的理解,同时将反应底物范围扩展到丙烯酸酯以外的缺电子烯。与丙烯酸甲酯2相比,富马酸二乙酯5是对称的双取代烯烃,因此在其与联烯酸乙酯1的陆氏(3+2)环加成反应中只生成唯一产物6,没有区域选择性异构体产物的产生。其反应过程如下:

关于联烯酸酯与富马酸酯的陆氏(3+2)环加成反应,研究结果揭示该反应具有优秀的立体选择性,产物中来自富马酸酯的两个酯基处于反式位置[6]。在第6题中并未介绍陆氏(3+2)环加成反应的立体化学,因此对产物6的立体化学未作要求。6-4小题答案如下:
不对称陆氏(3+2)环加成反应首次由张绪穆教授采用手性双环膦P2作催化剂而实现,并取得了较高的对映选择性[11]。6-5小题和6-6小题以如下类似的结果为题材,分别考查了考生对手性膦P2分子中手性中心的判断以及ee值计算公式的理解。
对于6-5小题,要求考生判断P2分子中存在的手性中心。碳环上的碳手性中心相对容易判别,很明显存在4个碳手性中心;而对于磷原子是否是手性中心则并不能轻易做出判断,这是本小题的难点。判断P2分子中磷原子是否为手性中心,可以按照如下简易方法来进行甄别:首先将磷原子构型进行翻转,得到P2’分子;然后将P2’分子绕纵轴方向旋转180°,发现P2’分子与P2属同一分子。由此可知磷原子构型翻转并不能改变P2分子的结构,磷原子不是手性中心。

因此,6-5小题的答案如下:

6-6小题是一个容易题。直接将80% ee值代入ee值计算公式,即可以计算出产物3中nmajor/nminor的值为90 : 10。进一步将此比值简化为9 : 1或者9,或者写成90/10或者9/1,均算正确答案。
6-7小题的题材仍旧选自陆熙炎院士课题组的工作,该工作演示了陆氏(3+2)环加成反应在天然产物全合成上的应用[12]。从手性环己酮7出发,利用膦催化的(3+2)环加成反应,成功实现了中草药成分茅苍术醇(-)-hinesol的全合成。在合成中,手性环己酮7与联烯酸叔丁酯8的膦催化环加成反应提供了合成茅苍术醇的关键中间体9。除产物9外,该反应还生成了立体异构体产物10-12。6-7小题正是基于该反应结果进行设问,进一步考查考生对陆氏(3+2)环加成反应的理解和掌握。为调节试题难度,该小题采用选择题的形式。
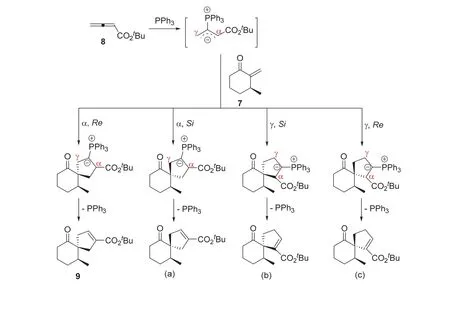
根据陆氏(3+2)环加成反应的机理分析,环己酮7与联烯酸酯8的环加成反应属底物控制的不对称反应;产物中不等量的立体异构体产生于该反应的区域选择性和立体选择性。如上图所示,在反应中,联烯酸酯8首先与催化剂PPh3作用,生成反应活性中间体内盐。该内盐中间体可分别采用α-位碳负离子或γ-位碳负离子形式与手性环己酮7进行共轭加成,并完成后续的关环步骤。当内盐中间体采用α-位碳负离子形式分别从环己酮7的碳碳双键Re面和Si面进行共轭加成并关环,则生成产物9和6-7小题(a)选项产物;同样,当内盐中间体以γ-位碳负离子形式分别从碳碳双键Si面和Re面进行共轭加成并完成关环,则分别生成选项(b)和(c)对应的产物。因此,6-7小题(a)、(b)、(c)选项对应的化合物均属于次要产物10-12;而(d)选项化合物则不是。由此,6-7小题的答案为d。
3 结语
第6题以有机小分子催化为科学背景,以我国科学家陆熙炎院士首次实现的陆氏(3+2)环加成反应为题材,从反应的发现、机理、不对称催化,以及在天然产物全合成中的应用等方面,完整地向考生介绍了陆氏反应的相关知识及魅力,同时恰当地加入了中草药等富有中国特色的元素,不仅将考生带入当今化学世界最具活力的有机小分子催化新领域,而且向全世界考生展示了我国科学家所做的杰出贡献。试题以多种形式考查了考生的有机理论基础知识、学习能力及逻辑推理能力;试题难易程度掌握恰当,在实际竞赛中表现出了较好的区分度。

