聚三嗪亚胺的合成及从水溶液中吸附铀
刘 灿
(南华大学 化学化工学院,湖南 衡阳 421001)
0 引 言
近年来,处理铀污染废水常用的方法主要有吸附法、光催化还原法、电化学法、膜分离法和沉淀法等。其中吸附法由于具有高选择性、条件温和性和环境敏感性等从而被认为是一种合理有效的方法。吸附铀常用的吸附材料有生物材料、共价有机骨架、金属有机骨架等。而这些材料大多制备成本高或者是难于制备,聚三嗪亚胺(PTI)作为一种制备成本低、方法简单、高结晶度的非金属材料可以解决这一问题[1]。在现有文献中,PTI作为光催化剂被用来光解水制氢[2]及降解染料[3]等,还未研究PTI吸附性能,因此,可探究PTI的吸附性能。
本文首先用熔融盐法以三聚氰胺为前体合成了聚三嗪亚胺(PTI)[4],并对PTI吸附U(VI)进行了结构表征,测试了PTI在水介质中对U(VI)的吸附能力。分析了吸附动力学和吸附等温线模型,并计算了模型的相关参数。
1 实验
1.1 材料的制备
三聚氰胺、氯化锂(LiCl)、氯化钾(KCl)、盐酸(HCl)、氢氧化钠(NaOH)、乙酸双氧铀、偶氮胂(Ⅲ),所有分析级试剂都按原样使用,未经任何纯化,所用的溶剂来自于去离子水。
本实验采用熔盐法制备PTI,具体步骤如下:将5 g三聚氰胺装入带盖的氧化铝坩埚中,并加入13.70 g KCl和11.32 g LiCl,充分混合均匀后放入箱式电阻炉中,以12 ℃/min的升温速率加热至550 ℃,保温4 h后,自然冷却至室温。然后用蒸馏水洗涤数次用以除去残余的盐,最后将产物于80 ℃下干燥24 h,所得即PTI。
1.2 实验仪器
材料的比表面积采用Micromeritics Tristar 3020比表面仪测量;分析材料的表面形貌所用的扫描电镜是场发射扫描电镜(日本日立公司);物相分析采用的X射线衍射仪是荷兰帕纳科公司生产的X″pert PRO型;分析材料的元素组成是以Al靶Kα射线为源,型号为Thermo ESCALAB 250的X射线光电子能谱。
1.3 吸附实验
吸附动力学:取用20 mg吸附材料,加入50 mL铀浓度为20 mg/L的溶液,持续搅拌下恒温25 ℃进行吸附实验,定时取样显色分析,用0.45 μm的滤头滤取1 mL溶液,加入0.5 mL盐酸和0.1%偶氮胂-Ⅲ试剂,用水稀释至5 mL,在分光光度计上测定652 nm处的吸光度,由标准工作曲线求算铀浓度。
由动力学实验确定吸附的平衡时间,采用准一级与准二级动力学模型,分析吸附动力学[5]。
准一级动力学方程:
ln(qe-qt)=lnqe-k1t
(1)
准二级动力学方程:
(2)
式中:qt为t时刻铀的吸附量,mg/g;qe为t时刻铀的平衡吸附量,mg/g;k1为准一级吸附模型中的速率常数,min-1;k2为准二级吸附模型中的速率常数,g/(mg·min)。
吸附热力学:取用20 mg吸附材料,加入50 mL铀浓度为2~70 mg/L的溶液持续搅拌,于25 ℃下进行吸附实验,吸附平衡后取样,以偶氮胂-Ⅲ为显色剂分析铀浓度。采用式(3)求算铀的平衡吸附量qe:
(3)
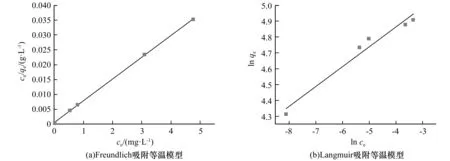
式中:c0为铀离子的初始时刻质量浓度,mg/L;ct为铀离子的t时刻质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。采用Freundlich和Langmuir等温吸附关系式,进行吸附模型分析[6]。
式中:q0和qe分别为不同浓度下的最大吸附容量和平衡吸附容量,mg/g;b为朗缪尔吸附常数,L/mg;ce为吸附平衡时的溶液浓度mg/L;k和n分别为与吸附容量(mg/g)和吸附强度相关的Freundlich常数。
2 结果与讨论
2.1 形貌织构特征
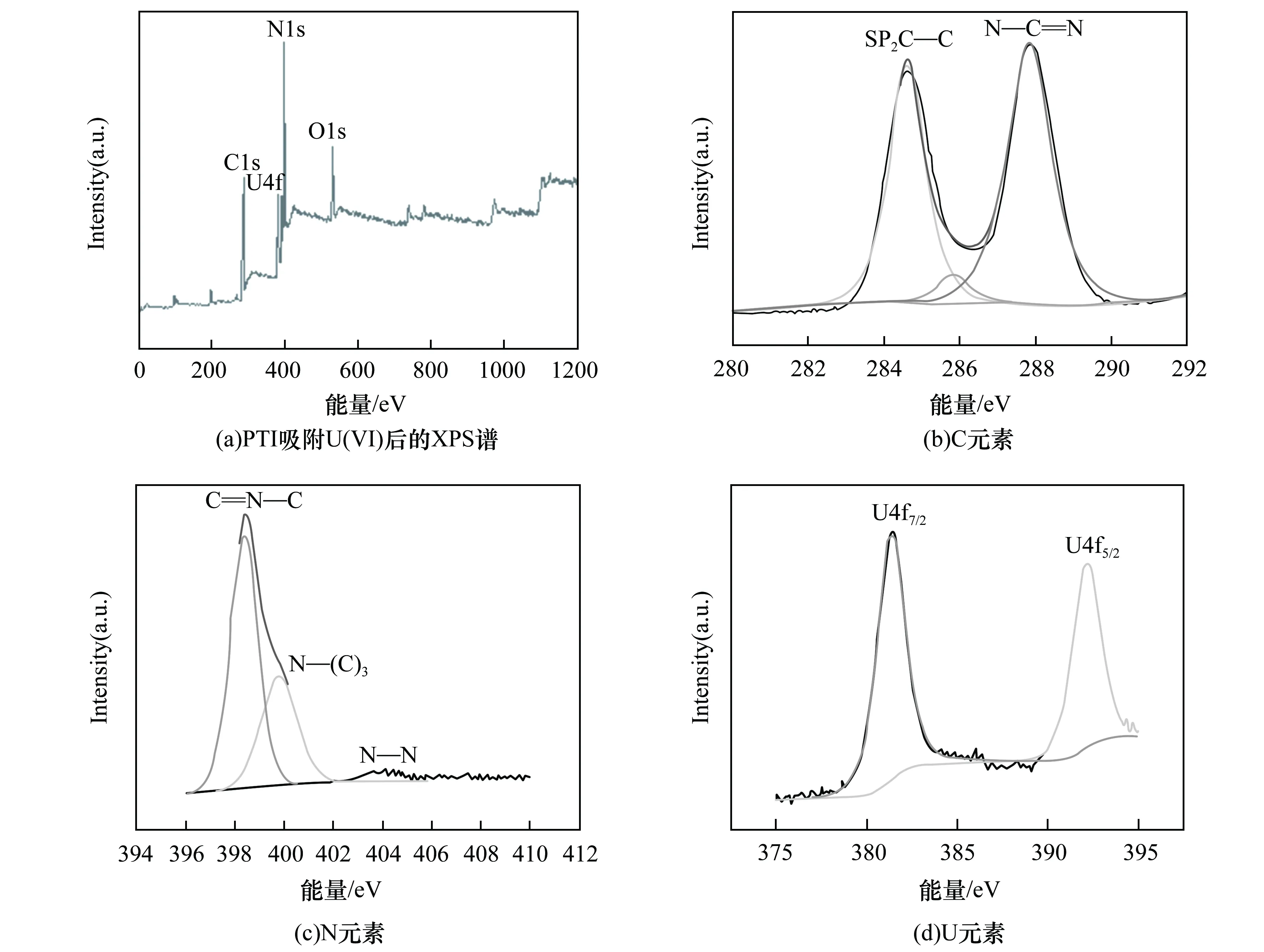
图1显示了PTI在吸附铀酰前后的扫描电子显微镜图像,从图1可以看出,与g-C3N4典型的层状结构不同的是,PTI是由一些直径不足100 nm的颗粒组成的蓬松状物质,比g-C3N4的尺寸要小得多,这可能会暴露出更多有效的吸附位点[7]。进行吸附之后,从图1(b)可以看出在这些颗粒表面产生明显的附着物,在这里可以推测附着物为U(VI)。g-C3N4和PTI的比表面积分别为:g-C3N4(28.6 m2/g) 图1 PTI和PTI吸附U(VI)后的SEM图Fig.1 SEM images after PTI and PTI-adsorbed U(VI) 为了探究PTI是否合成以及吸附铀酰后材料的结构是否会发生变化,采用了XRD分析。如图2所示,合成的PTI具有较高结晶度,其XRD衍射与以往文献中XRD衍射图谱相似,证明PTI成功合成[8]。吸附后PTI的整体衍射峰变化不大,说明吸附对PTI的晶体结构没有明显影响。从图2中可以看出,PTI在吸附铀之后吸收峰的强度有所增强,从标准卡可知,这些增强峰对应于铀(JCPDS No 50-1601)的吸收,证明铀成功吸附在PTI上。通过红外和XRD分析表明,铀吸附在PTI上,铀酰的吸附不会引起PTI结构的变化,证明了PTI结构的稳定性。 图2 g-C3N4与PTI及PTI吸附U(VI)后的XRD图Fig.2 XRD patterns of g-C3N4 and PTI and PTI after U(VI) adsorption PTI吸附U(VI)的动力学实验结果(图4(a))表明,随着吸附时间延长,吸附量逐渐增大,60 min后达到吸附平衡。依准一级动力学、准二级动力学方程,分析绘制的图线分别示于图4(b)和4(c),所得参数列于表1。 根据表1中的动力学参数,U(VI)吸附到PTI上更符合的动力学模型为准一级动力学模型。表明PTI吸附U(VI)属于物理吸附,吸附速率常数k1与溶质初始浓度呈线性关系,U(VI)的吸附与PTI表面的空位直接相关[11]。 图3 PTI吸附U(VI)后的XPS高分辨率光谱Fig.3 High-resolution XPS spectra of U(VI) adsorbed on PTI 图4 U(VI)的吸附曲线和吸附动力学分析Fig.4 Adsorption curve and adsorption kinetics analysis of U(VI) 表1 PTI吸附U(VI)的动力学相关参数Table 1 Kinetic-related parameters of PTI adsorption of U(VI) 图5 PTI对U(VI)的吸附等温线分析Fig.5 Adsorption isotherm analysis of PTI for U(VI) 表2 Langmuir和Freundlich吸附等温模型及相关参数Table 2 Langmuir and Freundlich adsorption isotherm equations and related parameters 在实验条件相同的情况下对比了PTI与g-C3N4对U(VI)的吸附性能,实验结果如图6所示,从g-C3N4与PTI吸附得到的实验数据中能明显看出,在室温(25 ℃)下PTI对U(VI)的最大饱和吸附量达到了135.5 mg/g,与g-C3N4(2.5 mg/g)相比,是g-C3N4饱和吸附量的54.2倍。 图6 g-C3N4与PTI吸附U(VI)曲线图Fig.6 U(VI) adsorption curve of g-C3N4 and PTI 本文主要研究了PTI对水溶液中U(VI)的吸附。研究了U(VI)在PTI上的吸附动力学和吸附等温线模型,另外还与g-C3N4吸附U(VI)做了比较。在研究动力学时,确定了用准一级动力学模型来解释U(VI)的吸附。在等温线模型中,Langmuir等温线更能解释铀在PTI上的吸附,证明U(VI)在PTI上呈现单层的物理吸附。通过与g-C3N4吸附U(VI)进行对比,发现在相同条件下PTI吸附U(VI)的最大吸附量是g-C3N4吸附U(VI)最大吸附量的54.2倍,从实用性角度来说,PTI要优于g-C3N4,且与其他MOF和COF材料相比,PTI制备简单,造价低,具有良好的经济性与实用性。因此,PTI被认为是一种能从水溶液中去除U(VI)的高效吸附剂。
2.2 XRD物相分析
2.3 元素状态的XPS分析


2.4 吸附动力学
2.5 PTI等温吸附模型分析
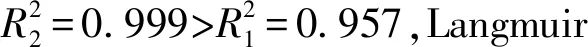

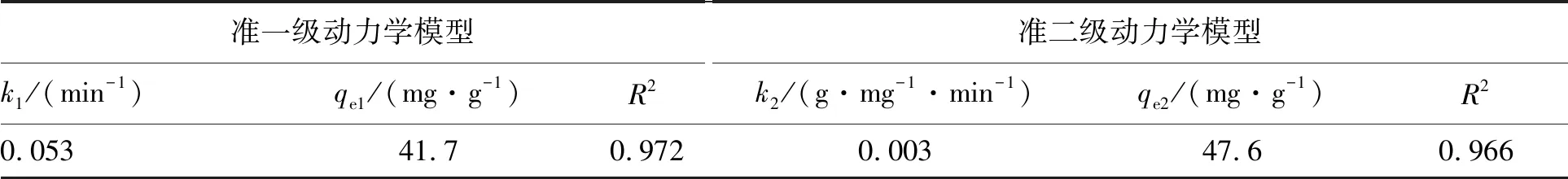

2.6 PTI与g-C3N4吸附U(VI)的比较

3 结 论

