瑞替加滨预处理对犬急性心肌缺血后室性心律失常发生的影响*
徐辽 周明敏 彭锦强 李棣文 谢轲 何燕 刘育
基础和临床研究证实,交感神经过度激活导致心脏自主神经系统失平衡是缺血性室性心律失常发生的重要机制[1]。左侧星状神经节(left stellate ganglion,LSG)是交感神经调控心脏功能的关键枢纽,急性心肌缺血(acute myocardial ischemia,AMI)后LSG 功能显著增强,促进室性心律失常发生[2]。M 型钾离子通道介导的M 电流是首次在牛蛙颈上交感神经节中发现的一种电压依赖性钾电流,由于最初发现其能被毒蕈碱型胆碱能受体(M受体)激活后强烈抑制而得名,在包括LSG 在内的众多类型神经元中广泛分布[3]。M 电流作为唯一在神经阈电位附近激活而不失活的钾电流,对神经元的兴奋性具有重要调节作用。研究发现,抑制M电流可提高神经元兴奋性,而激活M 电流则降低神经元兴奋性[4]。瑞替加滨(Retigabine,RTG)是一种M 型钾离子通道激动剂,可降低LSG 神经元兴奋性[3]。笔者拟观察LSG 内注射RTG 对犬AMI后室性心律失常发生的影响,探索预防AMI后室性心律失常的新靶点。
1 材料与方法
1.1 实验动物及准备 健康成年雄性比格犬(体重8~10 kg)购自北京玛斯生物技术有限公司,饲养于武汉大学人民医院动物中心。所有犬术前均常规禁食10~12 h,禁水8 h,通过前肢静脉注射3%戊巴比妥钠诱导麻醉,气管插管,接大动物呼吸机(中国Mindary公司)行正压机械通气,以0.6%~1.5%的异氟烷维持麻醉。犬充分麻醉后穿刺右侧股动脉,置入6F 动脉鞘管,尾端连接压力换能器持续监测血压。于犬肢体(右上肢,左下肢,右下肢)末端备皮后贴心电电极片,持续监测肢体Ⅱ导联心电图。本研究通过武汉大学人民医院伦理委员会许可。
1.2 实验分组 采用随机数字表法将24只犬随机分为3组:对照组(n=8)、AMI组(n=8)和RTG组(n=8)。所有动物于左侧第四肋间逐层开胸,剪开心包,充分暴露心脏。将实验犬经上述准备后,经第4肋开胸,并使用2-0丝线牵引分离心包膜做成心包吊床,AMI组和RTG 组通过结扎冠状动脉左前降支构建AMI模型,以肢体Ⅱ导联心电图ST 段抬高以及心室变苍白来作为模型建立成功的评判标准,对照组在同一位置下穿线但不结扎冠状动脉。RTG (购自美国Sigma 公司)溶于二甲基亚砜(DMSO)制成母液(20 mmol/L),分装后储存于-20℃冰箱中,使用前解冻并加入生理盐水稀释至50 μmol/L(含0.25% DMSO)。所有犬于左侧第二肋间开胸,于第二肋与颈长肌交界处定位LSG。RTG组在结扎冠状动脉前30 min 于LSG 内局部注射RTG,对照组和AMI组在相同时间点以同样方式于LSG 内注射含0.25%DMSO 的生理盐水。
1.3 心率(HR)和HRV频率指标分析 冠状动脉结扎后15 min,通过心电图记录HR,并使用Power Lab多导生理记录仪配套的LabChart 8.1 软件内置的HRV分析插件计算5 min心电图记录条带的HRV功率谱,分析以下频域指标:HF 成分(0.15~0.40 Hz)、LF成分(0.04~0.15 Hz),以及LF/HF比值。
1.4 心室有效不应期(ERP)和动作电位复极90%的时间(APD90)的测定 冠状动脉结扎后60 min,分别在左室心尖部(对应缺血区),心底部(对应正常区)和二者之间的心中部(位于第一对角支附近,对应缺血周边区)缝制3根自制电极,由Lead-7000多道生理记录仪发放S1S2期前电刺激并记录局部电图,期前刺激由8个连续的起搏周长为300 ms的S1S1刺激外加1个S2刺激组成,S1S2配对间期从250 ms开始,以10 ms的递减幅度反扫,当S2不能夺获心室时,从上一个S1S2配对间期起始以2 ms递减反扫,直至出现不能夺获心室即是所测定的ERP。ERP定义为未能达到夺获心室的最长S1S2配对间期。测量上述3个部位的ERP并计算其变异系数(CV:ERP 标准差/ERP 均数)以评估心室ERP离散度。
在左心耳处缝制1 根自制刺激电极,由Lead-7000多道生理记录仪发放固定起搏周长为300 ms的S1S1起搏,并使用自制不锈钢涂层的钨丝电极记录上述三个部位的动作电位,使用Power Lab生理记录仪配套的LabChart软件内置的Peak-Analysis插件计算上述三个部位的APD90,并计算其变异系数(CV:APD90标准差/APD90均数)以评估心室APD90离散度。
1.5 LSG 电刺激后收缩压变化的观察 心脏电生理检查结束后,将连接于Grass-s88 刺激仪(美国Astromed公司)的直径0.1 mm 银丝插入LSG,使用不同电压强度的刺激(从2.5 V 开始,以2.5 V 逐步递增至12.5 V,刺激持续时间30 s),记录刺激LSG 引起的最大收缩压(MSBP)以及其变化百分比(MSBP%)以此来评价LSG 功能,其中MSBP%=(BP最大/BP基础-1)×100%。
1.6 室性心律失常发生情况 连续心电图记录AMI后60 min内室性心律失常的发生情况,包括室性早搏(简称室早)和室性心动过速(简称室速)发生次数、室速持续时间。
1.7 统计学分析 所有计量资料均采用均数±标准差进行处理,3组间比较采用单因素方差分析以及Bonferroni或Tamhane′s T2 的事后检验;计数资料以分数表示,室颤发生率的组间比较采用Fisher确切概率法。采用SPSS 23.0软件进行统计学分析,双侧P<0.05为差异有统计学意义。
2 结果
AMI组和RTG 组各有3只和1只犬死于冠状动脉结扎后心室颤动,后分别补充3只和1只犬完成所有实验。
2.1 三组犬HR 和HRV 频率指标的比较 与对照组相比,AMI组HR、LF 和LF/HF 显著增加,HF显著降低(P<0.05),表1。与AMI组相比,RTG 组HR、LF 和LF/HF 明 显 降 低,HF 显 著 升高(P<0.05),表1。
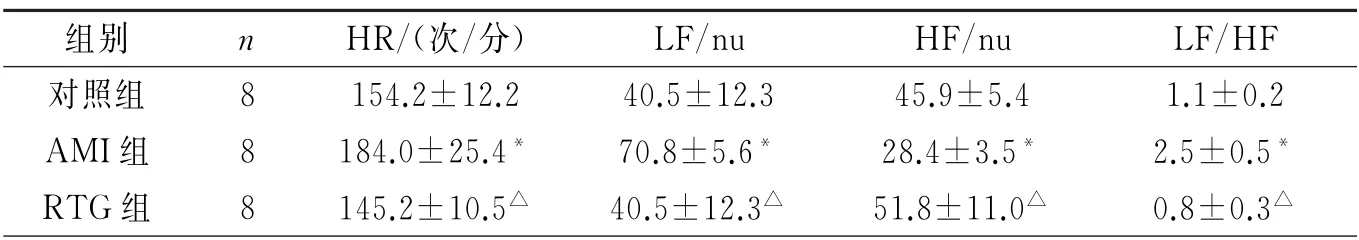
表1 三组犬HRV 频域指标的比较
2.2 三组犬心室ERP和APD90及其离散度的比较
与对照组相比,AMI 组左室缺血区ERP 和APD90均显著缩短,ERP 离散度和APD90离散度显著升高(P<0.05),表2;与AMI组比较,RTG 组左室缺血区ERP 和APD90均显著增加,ERP 离散度和APD90离散度显著降低(P<0.05),图1、表2。2.3 三组犬MSBP%的比较 与对照组相比,AMI组LSG 在相同电压刺激后MSBP%显著升高(P<0.05),表3;与AMI组比较,RTG 组MSBP%增加(P<0.05),图2、表3。2.4 三组犬室性心律失常发生的比较 连续心电图监测显示,与AMI组相比,RTG 组室早和室速发作次数明显减少,室速持续时间明显缩短(P<0.05),图3、表4。

图1 三组犬AMI后缺血区心室肌动作电位记录的代表性图片

表2 三组犬心室ERP和APD90的比较/ms

图2 三组犬AMI后LSG 电刺激引起收缩压变化的代表性图片

表3 三组犬LSG 刺激引起的最大收缩压变化百分比的比较

图3 三组犬AMI后心电图记录的代表性图片

表4 三组犬室性心律失常发生情况的比较
3 讨论
本实验观察LSG 内注射M 型钾离子通道激动剂RTG 对犬AMI后室性心律失常发生的影响,发现RTG 可显著改善AMI所致的自主神经系统失衡和心脏电活动不稳定,抑制AMI后室性心律失常的发生。因此,LSG 神经元M 通道可能成为预防AMI患者室性心律失常和心脏性猝死的新靶点。
心脏交感神经和迷走神经张力的平衡失调与心律失常的发生密切相关。大量的基础和临床研究显示,AMI后交感神经系统的过度激活是引发室性心律失常及心脏性猝死的重要机制。AMI后恶性心律失常发生前常出现交感神经活性的急剧升高[5]。AMI时交感神经系统激活,释放儿茶酚胺等神经递质,导致心电活动不稳定和室性心律失常发生。研究显示,刺激交感神经显著降低缺血心脏的心室颤动阈值,增加室性心律失常的易感性[6]。LSG是交感神经通向心脏的重要通路,研究表明消融或损毁LSG 可显著抑制心肌缺血后心脏交感神经过度激活,降低室性心律失常发生[2,7]。然而,这些方法具有损伤LSG神经元细胞、非可逆性调节LSG 功能等弊端,在一定程度上限制了其在临床实践中的广泛应用。
神经元的兴奋性由细胞膜上离子通道调控。既往研究发现,阻断LSG 神经元Nav1.8 钠通道或N型钙通道显著抑制急性心肌缺血或心力衰竭后室性心律失常的发生[8-9]。不同于Nav1.8 钠通道或N型钙通道电流,M 电流是唯一在神经阈电位附近激活而不失活的钾电流,在调节神经元兴奋状态、冲动发放、突触可塑性和神经递质释放等神经活动中发挥重要作用。研究显示,自发性高血压大鼠LSG 神经元M 电流下降,引起神经元异常放电,促进高血压的发生[3]。本实验中,笔者发现LSG内注射RTG 明显改善了AMI后心脏自主神经系统失衡。首先,AMI后犬LSG 功能显著增强,而RTG 明显抑制了AMI后LSG过度激活;其次,RTG 干预明显抑制了AMI后心率增加,而心率也与自主神经活动变化有关;最后,HRV频域分析提示AMI后代表交感神经张力的组分(LF和LF/HF)明显升高,反映迷走神经张力的组分(HF)下降,而RTG 干预明显改善了AMI后以上HRV 指标的变化。因此,本实验结果提示,LSG内注射M 型钾离子通道激动剂RTG 主要通过抑制AMI后心脏交感神经的过度激活来发挥抑制室性心律失常发生的保护效应。
AMI后心室肌电生理特性发生改变,主要表现为缺血区心肌ERP 和APD 缩短,且左室ERP 和APD 的离散程度增加,进而增加室性心律失常易感性[10]。既往研究显示,交感神经刺激可缩短心室肌ERP和APD[11-12]。本实验中,我们发现LSG 内注射M 型钾离子通道激动剂RTG 可显著延长AMI后心室缺血区的ERP和APD90,提示RTG 可能通过抑制AMI后心脏交感神经过度激活来改善心室电生理稳定性。此外,ERP 和APD 的离散程度增加可引起折返活动的形成,促进室性心律失常的发生。既往研究显示,降低ERP和APD 的离散度对室性心律失常具有保护效应[13]。本实验中,RTG显著降低了AMI后左室ERP 和APD90的离散程度,进一步提示RTG 通过稳定心室肌的电活动,降低缺血相关室性心律失常的发生率。
本研究也存在一些局限性。第一,利用HRV反映心脏自主神经系统的活性和均衡性,但仅分析了短时频率变量,未对相关时域变量进行分析;第二,LSG 功能通过电刺激LSG 引起血压的变化来间接评价,未直接记录LSG 神经活性;第三,本实验未检测LSG 神经元M 电流和兴奋性,未观察RTG对AMI后LSG 神经元的直接作用效应。

