短时强光对绿萝快速叶绿素荧光诱导动力学特性的影响
胡雪华,闫霄枫,胡文海
短时强光对绿萝快速叶绿素荧光诱导动力学特性的影响
胡雪华,闫霄枫,*胡文海
(井冈山大学生命科学学院,江西,吉安 343009)
本研究以室内培养的阴生植物绿萝()为实验材料,将绿萝于7月晴天上午8:30-9:30置于室外全光照环境下(光照度21000~34500 lux)处理1.0 h,然后移入室内弱光(最大光照度3600 lux)恢复48 h。于处理不同时期对绿萝叶片进行快速叶绿素荧光诱导动力学曲线的测定,通过比较叶片快速叶绿素荧光诱导动力学特性的变化,以探索绿萝叶片光合机构对短时强光胁迫的响应特征。结果表明:短时强光胁迫导致绿萝叶片光抑制(Fv/Fm)发生,并引起叶片光合性能指数(PIABS)下降,室内弱光有利于Fv/Fm和PIABS的恢复,但PIABS恢复慢于Fv/Fm。短时强光胁迫并未对PSII供体侧放氧复合体(OEC)和PSI反应中心产生影响,但造成PSII反应中心不可逆失活。短时强光使得叶片单位面积内有活性的PSII反应中心数量(RC/CS)下降,从而降低了叶片单位面积吸收的光能(ABS/CS)、捕获的光能(TRo/CS)和进行电子传递的能量(ETo/CS),且其影响在短时间内难以恢复。短时强光虽然降低了捕获光能用于电子传递的量子产额(φEo),但诱导了PSII受体侧PQ库容量(Sm)的增大,这有利于维持光合电子传递,是绿萝对短时强光的应急适应性反应。
绿萝;短时强光;快速叶绿素荧光诱导动力学曲线;光抑制
随着人们生活水平的提高,室内植物装饰越来越受到欢迎,室内观叶植物不仅可以美化环境,还能净化空气[1]。由于室内大部分区域的光环境是散射光,因此室内观叶植物大多选择耐阴植物,其光合作用的研究也主要关注植物对弱光环境的适应性[2-6],而较少考虑短时强光对植物光合机构的影响。事实上,种植在靠近窗户等处的室内观叶植物仍会遭遇短时强光照射,而强光胁迫是植物最常见的非生物胁迫之一。因此,探讨室内植物对短时强光的适应性及其机制具有重要意义。
光合作用是由光化学反应和碳同化反应两部分组成[7]。光是驱动植物光合作用的能量来源,叶片将捕获的光能通过光化学反应转化为同化力(NADPH和ATP)提供给碳同化。然而,在强光胁迫下由于叶片吸收的光能超出碳同化所需,这将导致叶绿体内还原性物质NADPH的积累并引起光合电子传递链的过度还原,如果过剩激发能不能够及时耗散,则会造成植物叶片光抑制甚至光合机构的破坏[8-9]。例如,阴生植物玉簪(spp.)由弱光转入强光后其光合速率和最大光化学效率急剧下降,PSII发生不可逆失活,且受体侧受到的伤害较供体侧更严重[10]。比利时杜鹃()由长期阴生环境转入全光照后降低了叶片的光化学反应和热耗散能力,导致PSII反应中心过量激发能积累,造成叶片光抑制甚至光破坏[11]。与此同时,植物在长期的进化过程中也形成了一系列的光抑制防御机制,植物可通过叶片和叶绿体运动来减少对光能的吸收[10],以及通过热耗散、光呼吸、围绕PSI的环式电子传递等多种能量耗散途径防御光抑制的发生[9,12-13]。短时强光胁迫导致吊兰()叶片活性氧的积累和光抑制的发生,但诱导了热耗散的增强,并且弱光处理有利于光抑制恢复[14]。长期遮荫条件下生长的羊踯躅()转移到全光照下处理5 d,虽然叶片对光能的利用能力和热耗散能力下降了,但促进了围绕PSI的环式电子传递的增强[15]。而蒙古栎()和紫椴()幼苗由弱光下转换到强光下生长时均可通过大量增加热耗散能力、类胡萝卜素和叶绿素比例以耗散过剩光能,并且降低单位鲜重叶叶绿素含量以减少光能吸收,从而避免强光对光合机构的破坏[16]。虽然阴生植物的强光光抑制已有研究,但相关研究主要集中于长时间全光照对阴生植物的光抑制伤害[17-19]。而对于长期生长于室内弱光环境下的观叶植物,当其短时暴露于强光并随后又处于弱光下生长的情况,短时强光对其光合机构的伤害以及随后弱光对其光合机构的恢复有何影响并不清楚。
绿萝()作为一种常见的室内观叶植物,喜散射光,而不耐阳光直射,是典型的阴生植物[20]。研究表明,75%遮荫处理有利于绿萝叶片叶绿素含量的增加以更有效地吸收光能,但其光饱和点为530.4 μmol·m-2·s-1,其最大光合速率也只有4.02 μmol·m-2·s-1[2]。郭家轩等的研究也表明,光照强度仅为室外光强2%的室内培养导致绿萝的光饱和点仅为90 μmol·m-2·s-1,并且室外全光照培养导致绿萝叶片失绿,这意味着强光致使绿萝叶片光氧化伤害,但是全光照也会诱导绿萝叶片抗氧化酶SOD和CAT活性的升高以抵抗强光伤害[3]。快速叶绿素荧光诱导动力学分析是以生物膜能量流动为基础建立的分析方法,其参数反映了植物叶片PSII反应中心光能吸收、转换和电子传递体氧化还原状态对环境条件的响应[21]。为此,采用绿萝为材料,利用快速叶绿素荧光诱导动力学技术,通过分析短时强光和随后弱光恢复对绿萝PSII反应中心和电子传递链的影响,以探索短时强光对室内观叶植物的伤害机制及随后弱光对光抑制的恢复作用。
1 材料与方法
1.1 材料与处理
实验于2019年7月在井冈山大学进行,选取长势良好且一致,在室内培养时间超过1年的5盆生长一致的绿萝为材料,于上午8:30 - 9:30置于室外阳光直射处(实验过程中太阳辐射光照度范围为21000 ~ 34500 lux,1.0 h),然后将植株移入室内恢复(实验过程中最大光照度为3600 lux,48 h)。分别于处理前(T0 h)和强光处理1.0 h(T1.0 h),及室内弱光恢复1.0 h(R1.0 h)、8 h(R8 h)、24 h(R24 h)、48 h(R48 h)时选择成熟功能叶进行快速叶绿素荧光诱导动力学曲线(OJIP)的测定,5个重复。
1.2 指标测定及计算
光合作用实验采用便携式植物效率仪Handy-PEA(Hansatech,英国)测定叶片OJIP曲线。叶片充分暗适应30 min后测定,OJIP曲线由2000 μmol.m-2.s-1红光诱导,测定时间为2 s。
根据李鹏民等[21]和van Heerden等[22]方法计算以下JIP-test参数。K点的相对可变荧光:WK=(FK-Fo)/(FJ-Fo);最大光化学效率:Fv/Fm=(Fm-Fo)/Fm;以吸收光能为基础的性能指数:PIABS=(RC/ABS)·[φPo/(1-φPo)]·[ψo/(1-ψo)];OJIP荧光诱导曲线的初始斜率:Mo≡(F300μs-Fo)/(Fm-Fo);标准化后的OJIP荧光诱导曲线及y轴围成的面积:Sm≡(Area)/(Fm-Fo);捕获的激子将电子传递到电子传递链中超过QA的其它电子受体的概率:ψo≡ETo/TRo=(1-VJ);用于电子传递的量子产额:φEo≡ETo/ABS=[1-(Fo/Fm)]·ψo;用于热耗散的量子比率:φDo≡(Fo/Fm);用于还原PSII受体侧末端电子受体的量子产额:φRo=(TRo/ABS)·(1-VI);单位面积吸收的光能:ABS/CS≈Fm;单位面积捕获的光能:TRo/CS=φPo·(ABS/CS);单位面积电子传递的量子产额:ETo/CS=φEo·(ABS/CS);单位面积的热耗散:DIo/CS=(ABS/CS)-(TRo/CS);单位面积有活性的反应中心的数量:RC/CS=φPo·(VJ/Mo)·(ABS/CS);单位反应中心吸收的光能:ABS/RC= Mo·(1/VJ)·(1/φPo);单位反应中心捕获的用于还原QA的能量:TRo/RC = Mo·(1/VJ);单位反应中心捕获的用于电子传递的能量计算公式:ETo/ RC =Mo·(1/VJ)·ψo;单位反应中心耗散掉的能量:DIo/RC= (ABS/RC)-(TRo/RC)。
1.3 数据分析
利用SPSS11.5数据分析软件进行实验数据的统计检验。采用one-way ANVOA最小显著性差异(LSD)检验,在< 0.05水平上进行分析。用Origin8.5软件作图,文中数据均为平均值±标准差,图表中不同字母表示在5%水平上具有显著性差异。
2 结果与分析
2.1 短时强光及随后弱光处理对绿萝叶片快速荧光动力学曲线的影响
由图1、2可知,T1.0 h导致绿萝叶片OJIP曲线明显偏离T0 h线型,且Fm大幅下降。室内弱光有利于OJIP曲线的恢复,OJIP曲线和Fm均随着恢复时间的延长而向T0 h恢复,R48 h时OJIP曲线已非常接近T0 h,Fm也恢复至T0 h水平。但强光处理及随后弱光恢复并未对Fo造成影响。这表明短时强光照射对绿萝叶片光合机构造成了显著影响,而室内弱光环境有利于光合机构功能的恢复。
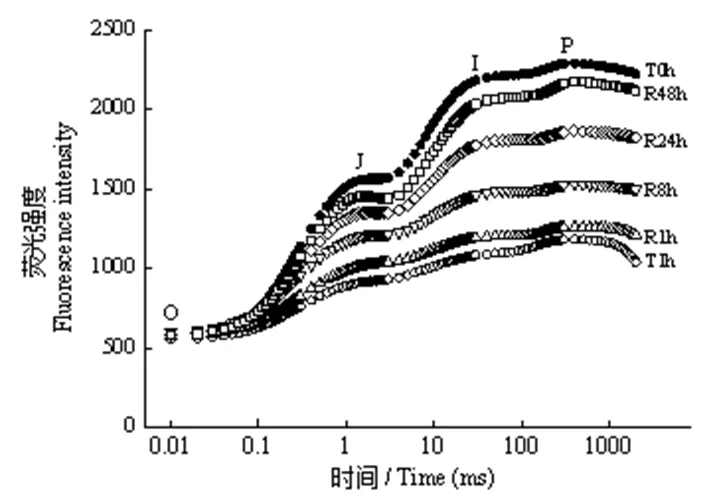
图1 强光处理1h及随后弱光恢复下绿萝叶片OJIP曲线的变化

图2 强光处理1h及随后弱光恢复下绿萝叶片初始荧光和最大荧光的变化
柱状图上不同字母表示在0.05水平差异显著
2.2 短时强光及随后弱光处理对绿萝叶片光合性能指数及PSII供体侧的影响
由表1可知,与T0 h相比,T1.0 h导致叶片Fv/Fm和PIABS显著下降。R1.0 h并未引起各参数的恢复,随着弱光处理时间的延长Fv/Fm和PIABS得以逐渐恢复;其中Fv/Fm在R8h开始有明显上升,并于R24 h时恢复至T0 h水平;而PIABS则在R24 h才有明显缓解,R48 h时才恢复至T0 h水平。但短时强光处理和随后的弱光恢复未对绿萝叶片WK产生影响。
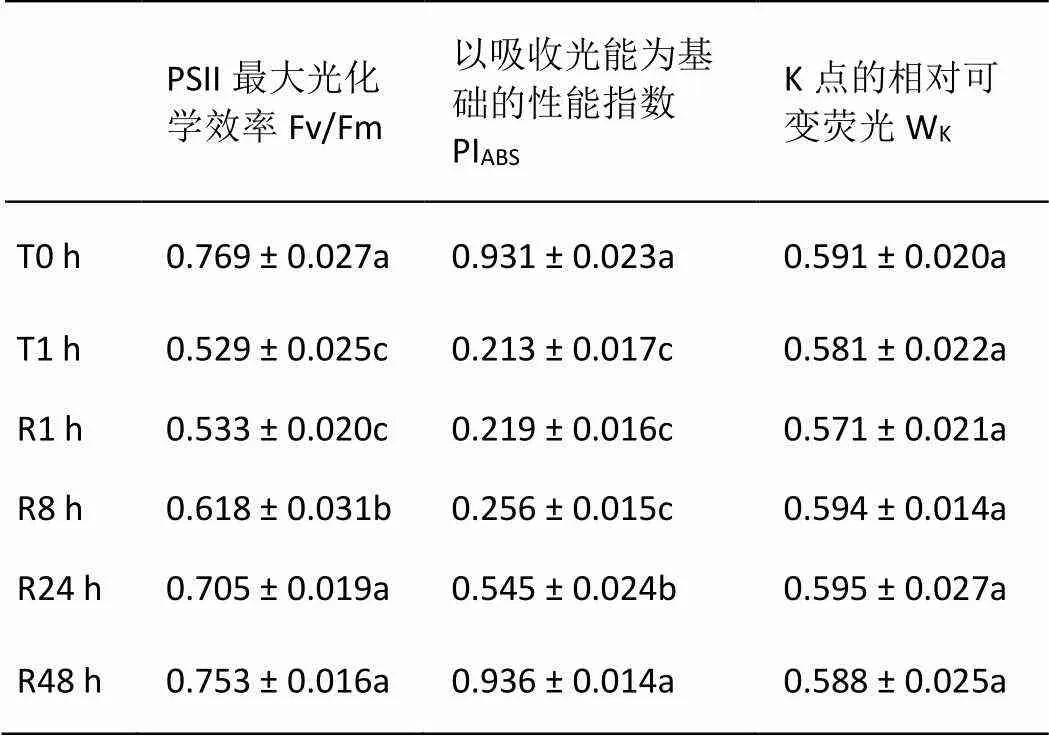
表1 强光处理1h及随后弱光恢复下绿萝叶片光合性能及PSII供体侧的变化
同列不同字母表示在0.05水平差异显著,下同。
2.3 短时强光及随后弱光处理对绿萝叶片PSII受体侧的影响
由表2可知,与T0 h相比,T1.0 h处理并未影响ψo和Mo,但降低了φEo,并诱导了Sm、φDo和φRo的增大。与T1.0 h相比,R1.0 h反而促进了Mo的上升和ψo的下降。随着弱光恢复时间的延长,Mo、Sm、φEo、φDo、φRo和ψo均可恢复至T0 h水平,但各参数的恢复速率并不一样。R1.0 h时,φRo即恢复至T0 h水平,Sm也有明显下降;φDo则在R8 h时开始有明显下降;而Mo、ψo和φEo恢复速率最慢,直至R24 h时才有明显恢复。
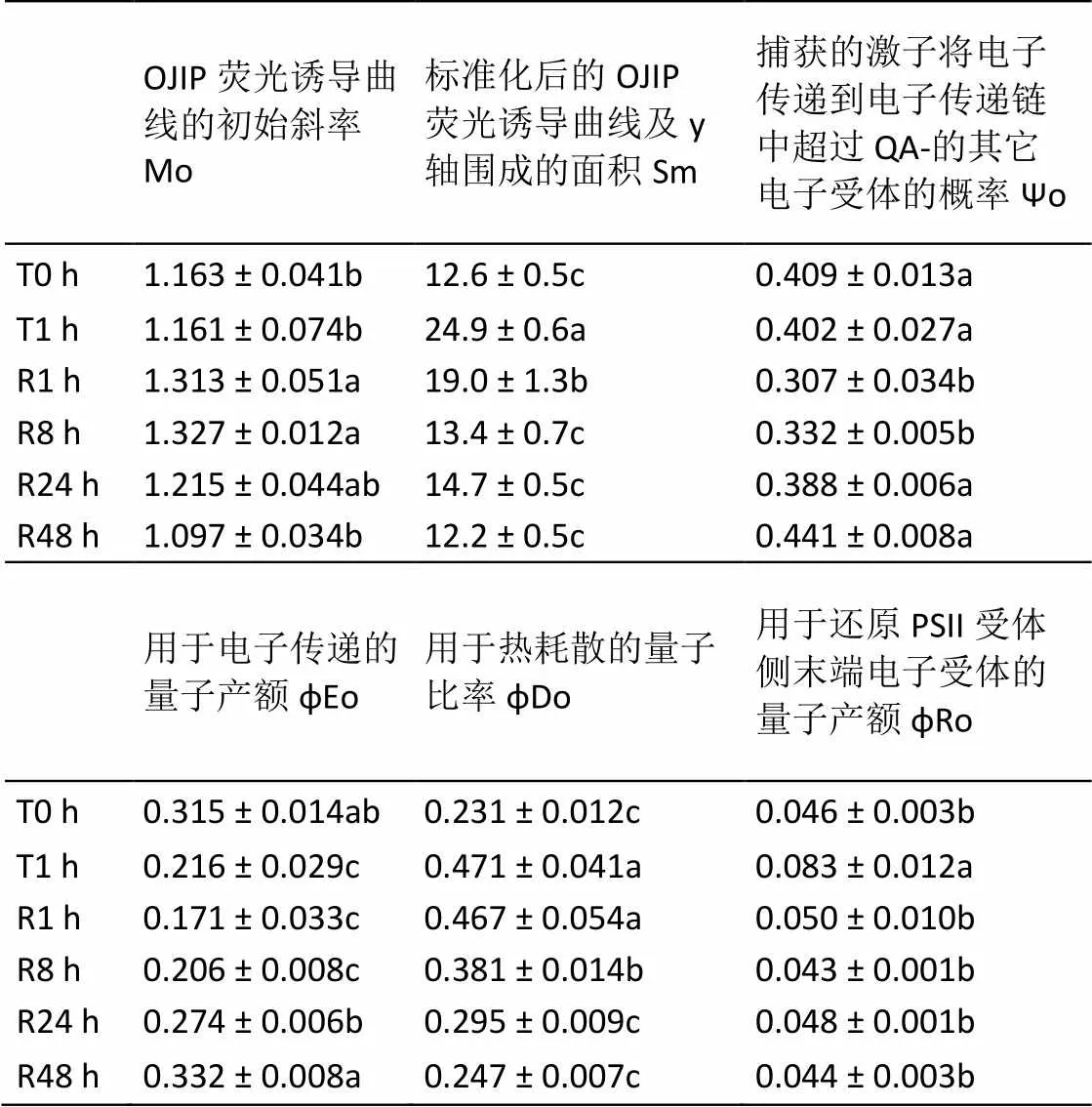
表2 强光处理1h及随后弱光恢复下绿萝叶片PSII受体侧的变化
2.4 短时强光及随后弱光处理对绿萝叶片PSII反应中心的影响
由表3可知,与T0 h相比,T1 h处理显著降低了RC/CS、ABS/CS、TRo/CS和ETo/CS,并且移入室内R48 h时才恢复至T0 h水平;但DIo/RC在强光处理和室内弱光恢复各时期均维持不变。T1 h处理则增加了ABS/RC和DIo/RC,并未引起TRo/RC和ETo/RC的变化;但室内弱光R1 h处理反而导致ETo/RC下降,并在R24 h时可恢复至T0 h水平;ABS/RC和DIo/RC则分别在R24 h和R8 h时恢复至T0 h水平;而TRo/RC在各处理时期均无显著差异。
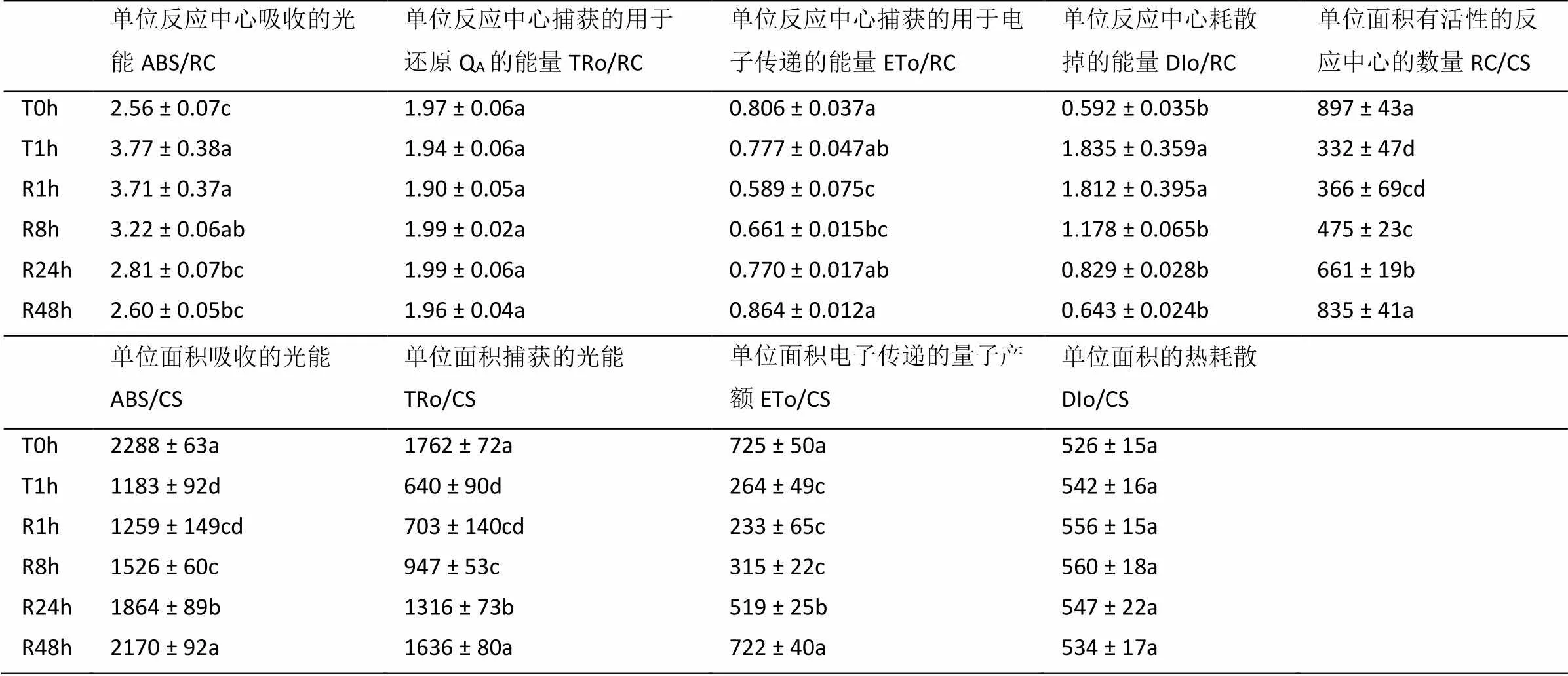
表3 强光处理1h及随后弱光恢复下绿萝叶片PSII反应中心的变化
3 讨论
强光对植物光合作用具有抑制和破坏作用,植物叶片光能吸收与利用之间的失衡是引起光抑制的直接原因[23-24]。Fv/Fm为PSII的最大光化学效率,其值的下降表示植物受到光抑制[25]。光合性能指数(PIABS)则包含了光能的吸收、捕获和电子传递三方面,其对环境的敏感性远大于Fv/Fm,能够综合反映胁迫对光合机构的影响[21-22]。本实验中,短时强光胁迫(直射光照射1h)导致Fv/Fm和PIABS分别下降了31.2%和77.1%;并且,室内弱光恢复24 h时Fv/Fm即可恢复到处理前水平,而PIABS在室内弱光恢复48 h时才恢复至处理前水平。这表明短时强光胁迫导致绿萝叶片光抑制的发生,对光合机构造成了严重影响,使得光合性能指数显著下降;弱光处理能够改善光抑制伤害,有利于光合机构的恢复,但光合机构性能的恢复慢于光抑制。我们的实验结果还表明,Fv/Fm的下降主要是由于短时强光处理导致Fm显著下降所致,而Fo并未变化,这意味着短时强光处理并未对绿萝叶片PSII反应中心产生影响,但对PSII受体侧造成伤害,导致电子传递能力明显下降[26-27]。
快速叶绿素荧光诱导动力学曲线(OJIP曲线)包含了大量关于PSII反应中心原初光化学反应信息,通过对曲线的分析可以了解PSII反应中心、供体侧和受体侧的活性,以及电子传递的变化[21,26,28]。PSII供体侧的放氧复合体(OEC)通过光解水向PSII提供电子,维持光合电子传递链的正常运行[29]。WK参数被作为PSII供体侧放氧复合体(OEC)受到伤害的重要指标[30-31]。我们的研究表明,实验过程中绿萝叶片WK未发生变化,这说明短时强光胁迫未对绿萝叶片PSII供体侧放氧复合体造成影响。
然而,强光导致了PSII受体侧电子传递和电子传递体的变化。ψo代表了有活性的PSII反应中心开放程度,Mo则反映了QA被还原的最大速率,体现了从QA-往下游的电子传递电子[21]。绿萝叶片ψo和Mo在强光处理1 h(T1h)后并未变化,但在室内弱光恢复1 h(R1h)反而使得Mo上升和ψo下降,这意味着短时强光胁迫对PSII反应中心开放程度和QA-往下游传递电子的抑制作用具有延迟性。φEo表示用于电子传递的量子产额,Sm反映了PSII反应中心受体侧PQ库的大小[21],φRo是用于还原PSI受体侧末端电子受体的量子产额[26]。本实验中,强光处理1 h导致φEo的显著下降,而Sm和φRo明显上升,说明短时强光胁迫导致光合电子传递受到抑制,但诱导了PSII受体侧PQ库容量的增大,并对PSI未造成伤害。而随后的室内弱光恢复期,各参数恢复至处理前水平的时间并不一样,首先是φRo(R1 h),其次是Sm(R8 h),最后是Mo、ψo和φEo (R24 h)。对此,我们认为短时强光胁迫对PSII反应中心的影响大于PSI,并且强光诱导了PSII受体侧电子传递体的增加,这可能是绿萝遭遇强光时维持光合电子传递,减轻强光伤害的一种应急适应性反应,而当植株移入室内弱光恢复时,PQ库容量也随之下降恢复至正常水平。然而,强光对光合机构的伤害已造成影响,因此,ψo、Mo和φEo在室内弱光恢复初期反而下降,并且直到弱光恢复24 h时才恢复至处理前水平,明显落后于φRo和Sm。
PSII位于类囊体膜内侧,是光抑制的原初部位及主要部位。本实验中,短时强光胁迫导致单位叶面积中有活性的PSII反应中心数量(RC/CS)显著下降,并且直至室内弱光恢复48 h时才恢复至处理前水平。这表明短时强光胁迫已造成绿萝叶片大部分PSII反应中心不可逆失活。研究表明全光照导致阴生植物毛瓣金花茶()叶片PSII反应中心受到严重伤害,发生光氧化[18]。进一步分析有活性的PSII反应中心的比活性可知,短时强光处理促进了单位有活性反应中心吸收的光能(ABS/RC)和热耗散的光能(DIo/RC)显著增加,而捕获的光能(TRo/RC)和用于电子传递的能量(ETo/RC)并没有明显变化。这表明作为补偿反应,剩余的有活性的PSII反应中心对光能的吸收增强[21,32],但所增加的吸收光能并未被反应中心所捕获并用于电子传递,而是通过热耗散进行消耗。有研究表明,逆境胁迫在降低植物RC/CS的同时,会导致ABS/RC和DIo/RC的增加,这表明逆境胁迫导致叶片单位面积部分反应中心失活后,使得剩余的有活性的反应中心负担加重,迫使其效率提高以更好地耗散电子传递链中的能量[21,33]。短时强光胁迫导致φEo的下降和φDo的上升也进一步说明了短时强光胁迫下绿萝叶片单位反应中心吸收的光能用于电子传递的光能减少,用于热耗散的光能增加[26]。而强光胁迫对绿萝叶片中有活性的PSII反应中心的不可逆伤害,减少了天线色素对光能的捕获[34],从而使得单位叶面积对光能的吸收(ABS/CS)、传递(TRo/CS)和用于电子传递(ETo/CS)明显下降,并且其在室内弱光下的恢复与RC/CS同步,均在R48 h时才恢复至处理前水平。在本实验中,强光诱导了φDo和DIo/RC的增加,由于OJIP分析中热耗散没有区分保护性和伤害性的热耗散,根据我们实验中强光胁迫对绿萝叶片PSII反应中心造成了不可逆伤害这一结果,可以认为强光胁迫下绿萝叶片热耗散的增加更多的是非保护性热耗散部分。
4 小结
短期强光胁迫导致室内观叶植物绿萝叶片光抑制的发生和光合性能的下降,室内弱光有利于光抑制和光合性能的恢复。短时强光胁迫并未对PSII供体侧放氧复合体和PSI反应中心产生影响,但造成PSII反应中心的不可逆失活,并抑制了光合电子传递的进行。但强光诱导了PSII受体侧PQ库容量增大,这有利于维持光合电子传递以防御强光对绿萝叶片的过度伤害。
[1] Deng L J, Deng Q H. The basic roles of indoor plants in human health and comfort[J]. Environmental Science and Pollution Research,2018,25: 36087-36101.
[2] 侯芳梅,李月华,王红利,等. 遮光对3种室内植物生长及光合特性影响初探[J].北京农学院学报,2001,16(4): 49-51.
[3] 郭家轩,夏奕婷,贺建,等.两种观赏植物对光照与遮荫的生理响应[J].广东农业科学,2010,37(12):67-70,74.
[4] 陆銮眉,林金水,陈金河.7种观叶小盆栽植物的光合特性与耐阴性研究[J].热带作物学报, 2013, 34(4):732-737.
[5] 刘燕, 赵许朋,杨旭,等.天南星科小型室内盆栽植物光合速率研究[J].内蒙古农业大学学报:自然科学版, 2016,37 (1):23-29.
[6] 张永帅,李海梅.3种室内观叶植物光合特性研究[J].中国农学通报, 2010,26(3):222-225.
[7] Raghavendra A S, Padmasree K. Beneficial interactions of mitochondrial metabolism with photosynthetic carbon assimilation[J]. Trends of Plant Science, 2003, 8: 546-553.
[8] Demmig-Adams B, Adams WW III. Photoprotection and other responses of plants to high light stress[J]. Annual Review of Plant Biology, 1992, 43: 599-626.
[9] 魏爱丽,王志敏.高等植物PSII的光抑制与光破坏研究进展[J].西北植物学报, 2004,24(7):1342-1347.
[10] 李志真,刘东焕,赵世伟,等.环境强光诱导玉簪叶片光抑制的机制[J].植物生态学报,2014,38(7):720-728.
[11] 胡文海,张斯斯,肖宜安,等.两种杜鹃花属植物对长期遮阴后全光照环境的生理响应及其光保护机制[J].植物生态学报, 2015,39(11):1093-1100.
[12] Müller P, Li X P, Niyogi K K. Non-photochemical quenching: a response to excess light energy[J]. Plant Physiology, 2001,125:1558-1566.
[13] Takahashi S, Badger M. Photoprotection in plants: a new light on photosystem II damage[J]. Trends in Plant Science, 2011,16:53-60.
[14] 董立花,韩巧红,杨勇,等.短时强光处理对金心吊兰光合特性的影响[J].草业学报[J], 2015, 24(12):245-252.
[15] 胡文海,张斯斯,闫小红,等. 长期遮荫后全光照对羊踯躅叶片光抑制及光保护机制的影响[J].井冈山大学学报:自然科学版, 2014,35(5):42-46.
[16] 陈婕,毛子军,马立祥,等. 蒙古栎和紫椴幼苗对光环境转变的光合作用响应[J].植物研究, 2008,28(4):471-476.
[17] 敖金成,苏文华,张光飞,等.对马耳蕨光合作用对生境光强增加的响应[J].西北植物学报,2010,30(11): 2265-2271.
[18] 柴胜丰,庄雪影,韦霄,等.光照强度对濒危植物毛瓣金花茶光合生理特性的影响[J].西北植物学报,2013, 33(3):547-554.
[19] 尚三娟,王义婧,王楠,等.光照强度对紫斑牡丹生理及生长特性的影响[J].生态学杂志,2012, 37(1):27-29.
[20] 陈燕玲,吴柳泳,柯沛强.不同光照处理对绿萝生长发育的影响[J].四川林业科技,2015,36(1):102-103
[21] 李鹏民, 高辉远, Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理学与分子生物学学报, 2005, 31(6):559-566.
[22] van Heerden PDR, Strasser R J, Kürger GHJ.Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics[J]. Physiologia Plantarum, 2004,121(2):239-249.
[23] Telfer A.Singlet oxygen production by PSII under light stress: mechanism, detection and the protective role of β–carotene[J]. Plant & Cell Physiology, 2014,55(7): 1216-1223.
[24] Zhang S R, Apel K, Kim C.Singlet oxygen-mediated and executer-dependent signaling and acclimation ofexposed to light stress[J]. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2014,369(1640): 20130227.
[25] 熊冬兰,李静,徐胜,等.臭氧胁迫对梓树光合生理特性的影响[J].生态学杂志, 2017,36(4):944-950.
[26] 苏晓琼,王美月,束胜,等. 外源亚精胺对高温胁迫下番茄幼苗快速叶绿素荧光诱导动力学特性的影响[J].园艺学报, 2013, 40(12):2409-2418.
[27] 胡文海,肖宜安,龙婉婉,等.夜间低温后日间光照对海桐和榕树叶片的光抑制以及光系统 II功能的影响[J].植物生理学通讯, 2005, 41(4):467-470.
[28] 原佳乐,马超,冯雅岚,等.不同抗旱性小麦快速叶绿素荧光诱导动力学曲线对干旱及复水的响应[J].植物生理学报, 2018,54(6):1119-1129.
[29] 金立桥,车兴凯,张子山,等.高温、强光下黄瓜叶片PSII供体侧和受体侧和伤害程度与快速荧光参数WK变化的关[J]系.植物生理学报, 2015,51(6):969-976.
[30] Strasser B J. Donor side capacity of photosystem II probed by chlorophyll a fluorescence transient[J]. Photosynthesis Research, 1997, 52:147-155.
[31] 田明爽,宋美珍,范术丽,等.棉花早熟芽黄突变体叶绿素荧光动力学特性研究[J]棉花学报, 2011,23(5):414-421.
[32] 赵和丽,杨再强,王明田,等.高温高湿胁迫及恢复对番茄快速荧光诱导动力学的影响[J].生态学杂志, 2019, 38(8):2405-2413.
[33] 胡文海,胡雪华,闫小红,等. 低温胁迫及恢复对番茄快速叶绿素荧光诱导动力学特征的影响[J].中国农业气象, 2021,42(10):859-859.
[34] 黄俊玲,王妍.干热河谷乡土树种叶绿素荧光特征对水分胁迫的响应[J].西北植物学报,2015,35(12): 2505-2512.
EFFECTS OF SHORT-TERM STRONG LIGHT ON THE CHLOROPHYLL FLUORESCENCE TRANSIENT IN LEAVES OF
HU Xue-hua, YAN Xiao-feng,*HU Wen-hai
(School of Life Sciences, Jingganshan University, Ji’an, Jiangxi 343009, China)
In this study,cultivated in the room was used as the research material. On a sunny day in July,was placed outdoor under the natural sunlight environment (illumination: 21000~34500 lux) for 1h from 8:30-9:30 and then moved indoors and recovered under weak light (the maximum illumination: 3600 lux) for 48h. In order to explore the response of photosynthetic apparatus ofto short-term strong light stress, chlorophyll fluorescence transient curve (OJIP) in leaves ofwere compared at different stages of the treatments. The results showed that short-term strong light caused photoinhibition (Fv/Fm) and reduced performance index (PIABS), which would be optimized by weak light during the recovery period, however, the recovery of PIABSwas slower than that of Fv/Fm. Short-term strong light did not affect the PSII donor side oxygen-evolving complex (OEC) and PSI reaction centers, but caused irreversible inactivation of PSII reaction centers. Short-term strong light decreased the number of active PSII reaction centers per unit area (RC/CS), thus reduced the specific energy fluxes per unit area for absorption (ABS/CS), trapping (TRo/CS) and electron transport (ETo/CS), which were not recovered in short time. Short-term strong light also reduced quantum yield for electron transport (φEo), but induced the increase of PQ pool capacity (Sm), which were the emergency adaptive response for short-term strong light to maintain photosynthetic electron transfer.
; short-term strong light; chlorophyll fluorescence transient; photoinhibition
Q945.11
A
10.3969/j.issn.1674-8085.2022.06.006
1674-8085(2022)06-0033-07
2021-11-08;
2022-01-06
江西省重点研发计划项目(2018ACF60009);江西省教育厅科技计划项目(GJJ12724,GJJ150776)
胡雪华(1977-),女,江西峡江人,高级实验师,硕士,主要从事植物生理生态学研究(E-mail: 164130341@jgsu.edu.cn);
*胡文海(1973-),男,江西吉安人,教授,博士,主要从事园艺植物生理生态学研究(E-mail: huwenhai@jgsu.edu.cn ).

