盘状结构域受体1 通过诱导上皮间质转化促进胰腺癌细胞迁移和侵袭
杨佳纯,欧茜文,张文静,方根强,杨玲
上海交通大学医学院附属新华医院老年医学科,上海 200092
研究显示[1],胰腺癌在中国的发病率及死亡人数逐年升高,确诊患者的中位年龄为70岁,54岁以下的患者仅占11%。 随着致病机制及治疗方案的研究不断深入,其他胃肠道恶性肿瘤的生存率不断增加,而胰腺癌患者的生存率没有明显改变,导致这一结果的重要原因是胰腺癌发病隐匿,具有极高的侵袭性[2]。
因此,研究胰腺癌转移侵袭的发生机制对改善患者预后和延长生存时间至关重要[3-4]。 在癌细胞中,盘状结构域受体 1(discoidin domain receptor 1,DDR1)通过扰乱细胞与基质之间的正常联系,启动癌细胞迁移与侵袭[5]。 研究发现DDR1 在胰腺癌组织中高表达,提示其可能与胰腺癌的发生发展有关[6]。 本研究旨在探讨过表达DDR1 对胰腺癌细胞迁移侵袭和降解细胞外基质能力的影响,明确DDR1 对胰腺癌细胞迁移侵袭的调控作用,为胰腺癌的诊治提供新的思路。
1 材料与方法
1.1 细胞系人胰腺癌细胞系 PANC-1、 AsPC-1、BxPC-3、 SW1990 由海军军医大学第一附属医院消化内科赠送,人正常胰腺导管上皮细胞H6C7 由上海交通大学医学院附属瑞金医院普外科提供。
1.2试剂DMEM 高糖培养基、RPMI 1640 培养基、Opti-MEM 培养基、胎牛血清(fetal calf serum, FBS)、0.25%胰蛋白酶-EDTA(美国Gibco 公司,货号分别为11995065、 11875085、 31985070、 10099141、 25200056);PMSF、 RIPA 裂解液、 SDS-PAGE 凝胶配制试剂盒、Tubulin 抗体(上海碧云天生物技术有限公司,货号分别为 ST506、 P0013B、 P0012A、 AT819); LipofectamineTM2000 转染试剂(美国 Invitrogen 公司,货号11668); qRT-PCR 试剂盒(中国 Takara 公司,货号RR037A); Transwell 小室(美国 Corning 公司,货号3414); Matrigel 基质胶(美国 BD 公司,货号354234);DDR1 抗体(美国 CST 公司,货号 5583T);抗 α-SMA抗体(美国 Sigma 公司,货号 SAB5500002); E-cadherin 抗体、 Vimentin 抗体(美国 Santa Cruz 公司,货号分别为 sc-7870、 sc-5565)。 载体为 pcDNA3.1 的DDR1表达质粒,构建于上海吉凯基因化学技术公司。
1.3 仪器CO2培养箱、高速离心机(美国Thermo Scientific 公司); Western Blot 电泳仪、转膜装置及化学发光图像分析系统(上海Tanon 有限公司); IX73荧光显微镜(日本 Olympus 有限公司); LightCycler®480 实时荧光定量PCR 系统(瑞典Roche 公司)。
1.4 胰腺癌细胞培养PANC-1 细胞使用DMEM 高糖培养基, AsPC-1、 BxPC-3、 SW1990 和 H6C7 细胞使用RPMI 1640 培养基。 所有细胞均放置于条件为37 ℃、5%CO2的培养箱中常规培养,每48 h 更换1 次培养基,当细胞密度培养至80%~90%时进行传代。
1.5 胰腺癌细胞DDR1 质粒转染转染前,每孔加入 1.5 mL Opti-MEM 培养基。 在 2 个 EP 管中分别加入2 μg 质粒 + 250 μL Opti-MEM 以及 8 μL LipofectamineTM2 000 +250 μL Opti-MEM,静置5 min。 将2 个EP 管中的溶液混合静置20 min 后,逐滴加入6 孔板中。 6 h 后更换新鲜常规培养基,转染72 h 后提取对照组 pcDNA3. 1( + )-vector 及实验组 pcDNA3. 1( +)-DDR1 的蛋白进行检测,明确转染效果。
1.6 蛋白质印迹法检测蛋白表达使用含有PMSF 的裂解液裂解细胞, BCA 法进行蛋白浓度测定。 通过SDS-PAGE 凝胶样品槽电泳120 min,电转印至PVDF膜,转膜条件为300 mA、100 min。 室温下5%脱脂牛奶封闭 2 h,分别置于 E-cadherin(1 ∶1 000)、 Vimentin(1∶1 000)、 α-SMA(1∶1 000)、DDR1(1∶1 000)及 Tubulin(1∶1 000)抗体孵育液中, 4oC 孵育过夜。 TBST 洗膜 3次,分别加入对应二抗(1∶2 000),室温下孵育2 h。 TBST洗膜,发光剂显色,并于发光成像系统中分析蛋白表达。
1.7 细胞划痕实验以记号笔在6 孔板背后画平行横线做好定位标记,将对照组和实验组的PANC-1 细胞分别接种于6 孔板中,每孔5 ×105个细胞。 转染后用移液枪对6 孔板底面进行十字划痕, PBS 洗去脱离细胞。 更新培养基,常规培养0、24、 48、 72 h 后,在显微镜下进行拍照, Image J 软件测得划痕面积,划痕愈合率 = (1~24、 48、 72 h 空白区域面积/0 h 空白区域面积) ×100%。
1.8 Transwell 检测细胞迁移及侵袭收集对照组和实验组的PANC-1 细胞后,用不含FBS 的相应细胞培养基调整细胞浓度为2 ×105个/mL。 在6 孔板中放入Transwell 小室,上室加入100 μL 细胞悬液,下室加入600 μL 含 2%FBS 的培养基。 孵育 36 h 后取出小室,DPBS 清洗,然后甲醇固定30 min,使用结晶紫染色10 min。 在显微镜下观察,选取8 个视野,计算穿膜细胞,测定细胞迁移情况。
将Transwell 上室包被 Matrigel 基质胶, 37 ℃孵育 4 h。 在上、下室均加入 500 μL 不含 FBS 的培养基,4 ℃孵育过夜,其余步骤与迁移实验相同,测定细胞侵袭情况。
1.9 qRT-PCR 检测转录因子表达用TRIzol 法提取PANC-1 细胞总 RNA,根据说明书逆转录合成cDNA。以GAPDH作为内参,通过 2-ΔΔCT进行半定量分析。 见表1。

表1 引物序列
1.10 原位明胶酶谱法在盖玻片上涂异硫氰酸荧光素明胶,37 ℃、DMEM 高糖培养基中培养2 h。 将细胞接种于处理好的盖玻片上,孵育过夜后进行染色。 每个样本随机选取8 个区域拍摄图像, Image J 定量分析明胶降解水平,以平均降解百分比表示明胶降解指数。
1.11 统计学分析应用SPSS 19.0 统计软件进行统计分析。 符合正态分布的计量资料以均数± 标准差()表示,组间比较使用t检验和单因素方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 各细胞DDR1 mRNA 表达及DDR1 表达质粒转染胰腺癌细胞与 H6C7 细胞(1. 04 ± 0. 05)DDR1 mRNA 比 较,胰腺 癌细胞 SW1990 (2. 15 ± 0. 14)、PANC-1(2.28 ± 0.11)、 AsPC-1(3.24 ± 0.10)和 Bx-PC-3(3.46 ±0.37)的DDR1 mRNA 表达升高,差异有统计学意义(P<0.05)。
将DDR1 表达质粒瞬时转染胰腺癌细胞PANC-1,72 h 后进行 Western blot 检测,对照组 pcDNA3.1( + )-vector 的蛋白表达为(1.01 ±0.42),实验组 pcDNA3.1( +)-DDR1 的蛋白表达为(3.51 ±0.48)。 见图1。

图1 各细胞株DDR1 mRNA 表达及PANC-1 细胞转染后DDR1 蛋白表达情况
2.2 过表达DDR1 上调胰腺癌细胞迁移和侵袭与对照组比较,划痕24、 48 h 后实验组的细胞愈合率升高,72 h 后实验组划痕已完全愈合,转染DDR1 的胰腺癌细胞迁移能力增强,细胞迁移数增加,差异有统计学意义(P<0.05)。 与对照组比较,过表达DDR1后,胰腺癌细胞侵袭数增多,差异有统计学意义(P<0.05)。 见表 2 和图 2。

表2 过表达DDR1 后的细胞划痕愈合率(%)
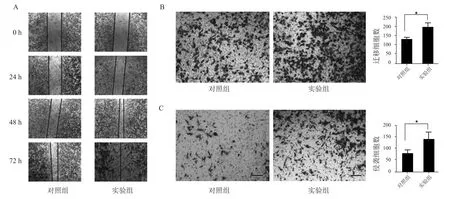
图2 过表达DDR1 对PANC-1 细胞迁移和侵袭的影响
2. 3DDR1 促进细胞外基质降解与对照组(0.75 ±0.14)比较,过表达DDR1 使 PANC-1 细胞中的明胶基质降解指数(1.14 ±0.20)升高(P<0.05)。见图3。
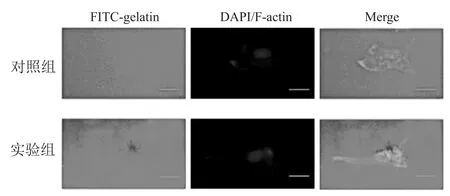
图3 过表达DDR1 促进细胞外基质降解
2.4DDR1 通过上调Snail2 和Twist的表达促进EMT 的发生与对照组比较,过表达DDR1 后Vimentin、 α-SMA 蛋白表达水平升高,但 E-cadherin 蛋白表达水平下降。Snail2 和Twist的表达上调,可能与上皮间质转化(epithelial-mesenchymal transition, EMT)相关。 见图 4。

图4 DDR1 对EMT 的调节作用
3 讨论
研究证明,对经过评估后选择的老年胰腺癌患者进行新辅助或转化化疗可获得一定治疗效果,但在药物的选择和剂量方面需要更为精准,以减少化疗的不良反应[7-8]。DDR1 是一种受体酪氨酸激酶,在多种恶性肿瘤中表达异常。 其通过多种途径参与肿瘤细胞的增殖、分化、迁移和侵袭,还可以使细胞外基质高度有序,在肿瘤周围包裹形成屏障,妨碍免疫细胞浸润及杀伤肿瘤细胞,促进肿瘤进展[9-12]。 本研究表明,胰腺癌细胞中DDR1 mRNA 表达水平高于正常人胰腺导管上皮细胞。 通过划痕、迁移侵袭试验和原位明胶酶谱法证实,过表达DDR1 的胰腺癌细胞迁移侵袭和细胞外基质降解能力明显增加。 因此,本研究预测在胰腺癌中,DDR1 可以作为治疗靶点进行抗肿瘤治疗,但其作用机制需要进一步明确。
EMT 是肿瘤转移的重要过程,细胞失去上皮细胞特性而转化为间质表型,获得侵袭和降解细胞外基质的能力。 主要特征为细胞黏附分子,如E-cadherin,表达减少,具有间质特征的N-cadherin、 Vimentin 等表达升高,并由Snail1、Snail2、Twist、Zeb1 和Zeb2 等 EMT活化转录因子介导[13-15]。 本研究对 PANC-1 细胞中DDR1 与EMT 的发生及相关分子进行了检测。 与对照组比较,过表达DDR1 的PANC-1 细胞中,上皮标志物E-cadherin 蛋白表达下降,间质标记物α-SMA、 Vimentin 蛋白表达水平升高,转录因子Snail2 和Twist的mRNA 表达水平上调。 近年来,围绕EMT 对胰腺癌发展过程中的作用存在争议,有学者认为Snail并非胰腺癌 EMT 发生的必要因素[14]。 Hotz 等[15]报道Snail2 在正常胰腺组织中无表达,在胰腺癌组织中表达率为50%,特别是在发生浸润转移的胰腺癌组织中表达明显,干扰Snail2 表达可抑制胰腺癌转移。 因此,Snail2是胰腺癌发生发展的重要靶点。 综上所述,DDR1 高表达于胰腺癌细胞,可能通过转录因子Snail2 和Twist诱导胰腺癌细胞EMT 的发生,增强其转移及侵袭能力。然而,DDR1 促进胰腺癌侵袭转移机制复杂,今后拟通过其抑制剂和基因沉默干扰技术进行体内实验,从而更好地了解DDR1 在胰腺癌发生发展过程中的调控机制。

