内镜黏膜下剥离术治疗消化道早癌发生术后感染的危险因素分析
郭新月,刘进,赵刚容,姜政
(重庆医科大学附属第一医院 消化内科,重庆 400016)
消化道早癌是指癌细胞尚未突破黏膜下层浸润黏膜肌层,不论其是否侵犯局部淋巴结,包括:早期食管癌、早期胃癌和早期结直肠癌。有研究[1]显示,我国死亡人数前五的癌症中,消化道肿瘤占据4项,分别为肝癌、胃癌、食管癌和结直肠癌,占所有癌症死亡人数的32.0%,标准化发病率与死亡率均高于世界水平。定期筛查是消化道癌症患者的二级预防措施,也可以有效减轻我国的癌症负担。与传统外科手术相比,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)对于消化道早癌的治疗效果较好,并具有可完整剥离病变组织、创伤小、不改变消化道正常结构和并发症少等优势[2-4]。但ESD 存在以下劣势,如:手术时间较长,对操作者技术要求较高,术中及术后穿孔、出血及术后感染等并发症发生率较高[5-6]。本研究通过统计学方法筛选术后感染的危险因素,并建立术后感染风险模型,旨在为今后临床工作中早期发现危险因素并及时预防ESD术后感染提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2018 年11 月-2021 年11 月83例于重庆市医科大学附属第一医院实施ESD治疗的消化道早癌患者的临床资料。其中,男57 例,女26 例;年龄46~79 岁,平均(64.69±8.09)岁;病变最大径1.0~6.0 cm,平均(3.05±1.24)cm;病变位于食管56例,胃16例,结肠1例,直肠10例。
纳入标准:胃肠镜活检组织病理学证实为消化道早癌;不论癌细胞是否侵犯局部淋巴结;完善相关检查后,符合实施ESD的适应证。排除标准:存在凝血功能障碍性疾病,或近期服用抗血小板,或抗凝血药物者;对手术不能耐受者;对本研究药物过敏者;临床资料不完整者。
1.2 相关定义
1.2.1 术后出血 手术全程中未发生出血,术后30 d内发生出血,具体表现如下:①患者术后出现呕血、黑便和血便等情况;②需要输血纠正贫血或内镜下止血或外科手术处理者;③术后复查血常规,发现血红蛋白较术前下降超过20 g/L者。满足以上任意一项即为术后出血。
1.2.2 术后迟发性穿孔 术中或手术结束时,内镜下未发现穿孔且无相关症状及体征,术后出现皮下捻发感或经影像学检查提示穿孔。
1.2.3 术后感染 术前白细胞、中性粒细胞和体温均在正常范围,术后出现体温>37.3℃、白细胞总数>10×109/L、中性粒细胞百分比>70%或病原学检查阳性。
1.3 手术方法
1.3.1 ESD 术 Dual 刀在食道病变周围0.5~1.0 cm处标记,黏膜下注射使病变充分隆起后,用Dual 刀或IT 刀在黏膜下进行剥离,取出剥离组织。术中创面出血,予以止血药物冲洗、电凝和止血钳止血,必要时采用金属钛夹夹闭创面,若出现术中穿孔,则在内镜下进行夹闭。创面处理后,观察有无气泡溢出及活动性出血。术者均为具有内镜操作经验5年以上的消化内科医生。
1.3.2 术后治疗 术后常规禁饮禁食1 d,予以抑酸、抗感染、止血和补液等常规对症治疗。有出血、穿孔等患者,可适当延长禁饮禁食时间,逐步过渡到正常饮食。23 例ESD 术后出现感染的患者,适当延长抗生素使用时间和胃肠减压时间,及时添加肠外营养制剂,必要时抗感染方案升阶梯治疗。
1.4 资料收集
1.4.1 一般资料 性别、年龄、合并基础疾病情况(高血压和糖尿病等)、吸烟史和饮酒史等。
1.4.2 病理资料 病灶最大直径、病变部位、病理类型和切缘情况等。
1.4.3 操作相关情况 术前预防性抗生素使用情况、术中出血或穿孔、术后出血、迟发性穿孔和感染等并发症。
1.4.4 预后情况 术后住院时间、抗生素使用时间、胃肠减压时间和肠外营养时间。
1.5 统计学方法
应用SPSS 26.0 软件进行统计学分析,运用χ2检验或Fisher确切概率法对ESD术后发生感染的可能影响因素进行单因素分析,双侧P<0.05为差异有统计学意义。将危险因素纳入多因素Logistic 回归分析以此构建模型,结果采用O值与95%CI 表示,双侧P<0.05 为差异有统计学意义。针对该模型进行Hosmer-Lemeshow 拟合优度检验,P>0.05 说明模型效能良好。
2 结果
2.1 术后感染情况
83 例消化道早癌中,发生术后感染23 例(27.7%),60例(72.3%)未发生术后感染。
2.2 两组患者一般资料比较
根据术后有无感染,将患者分为术后未感染组(n=60)和术后感染组(n=23)。两组患者年龄、性别、基础疾病、吸烟史、饮酒史和是否预防性使用抗生素等一资料比较,差异均无统计学意义(P>0.05)。见表1。
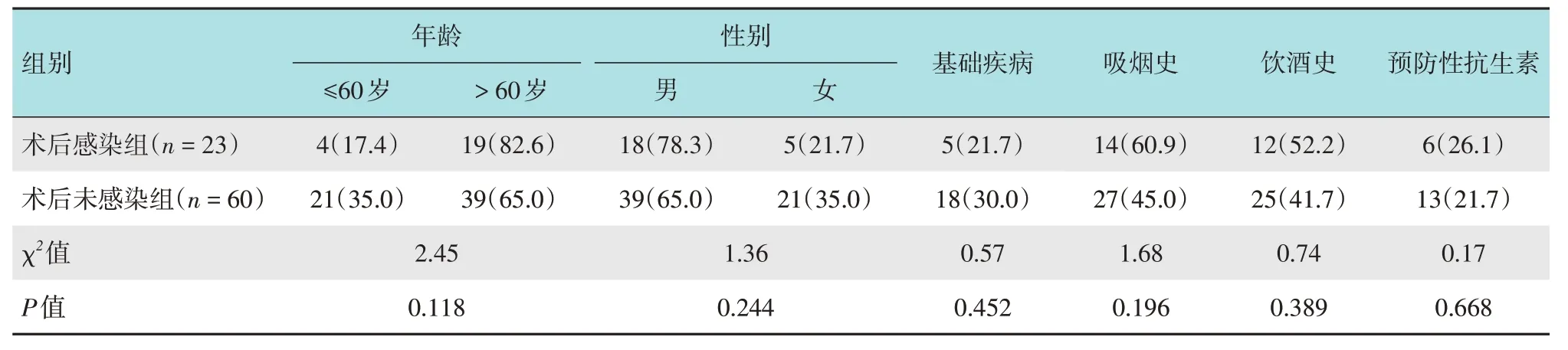
表1 两组患者一般资料比较 例(%)Table 1 Comparison of general data between the two groups n(%)
2.3 两组患者术中术后情况比较
术后感染组术中穿孔率明显高于术后未感染组,两组患者比较,差异有统计学意义(P<0.05)。其中,上消化道穿孔8 例,下消化道穿孔2 例,分别占上、下消化道手术患者的11.1%和18.1%;两组患者术中出血率和术后迟发性穿孔率比较,差异均无统计学意义(P>0.05)。见表2。
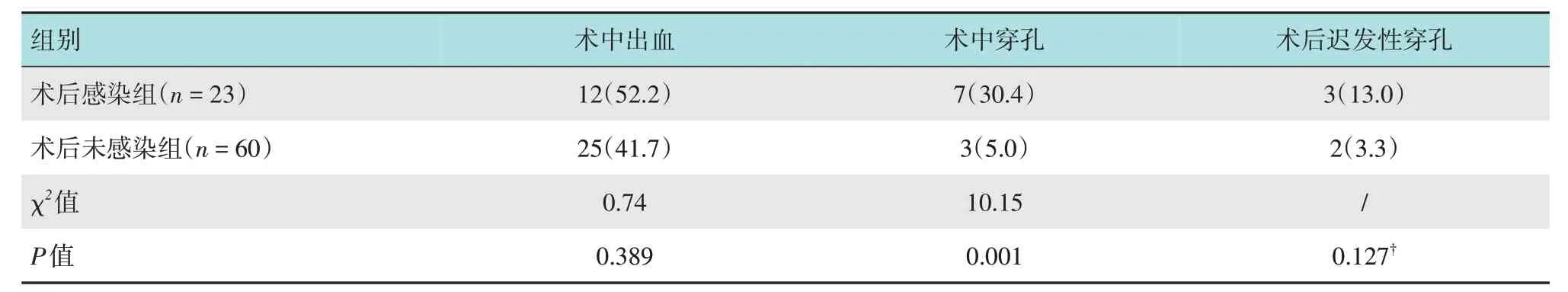
表2 两组患者术中术后情况比较 例(%)Table 2 Comparison of intraoperative and postoperative conditions between the two groups n(%)
2.4 两组患者病理资料比较
术后感染组与术后未感染组相比,两者在病灶部位、病理类型、病变组织切除情况和病灶大小等病理特征等方面,差异均无统计学意义(P>0.05)。见表3。
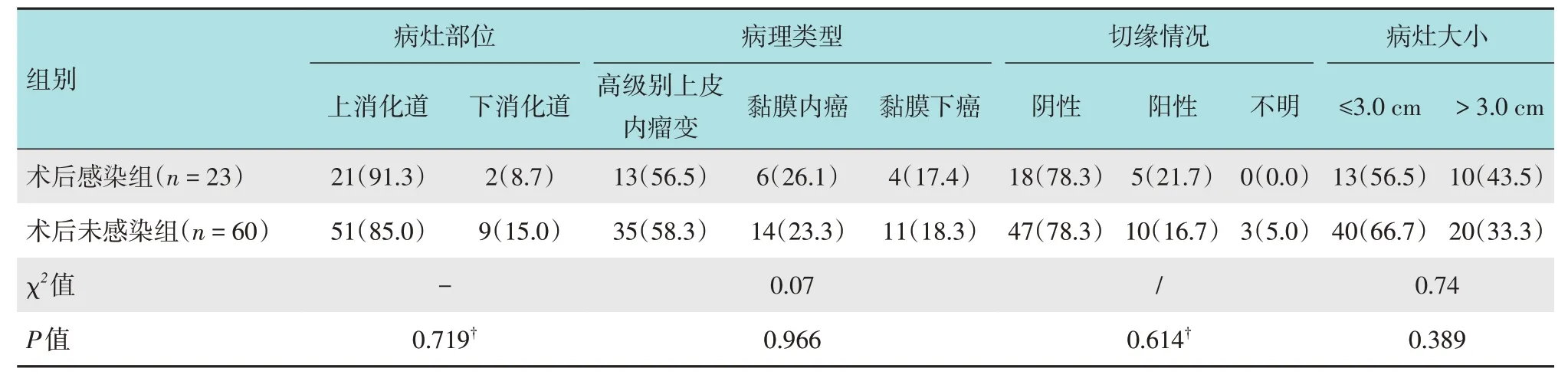
表3 两组患者病理资料比较 例(%)Table 3 Comparison of pathological data between the two groups n(%)
2.5 影响术后感染的多因素Logistic回归分析
以术后是否发生感染作为因变量,纳入单因素分析中差异有统计学意义的参数,并结合临床可能影响患者术后感染的临床基线资料、病理类型和术后迟发性穿孔等因素作为自变量,行多因素Logistic 回归分析。结果显示,年龄和术中穿孔是消化道早癌患者ESD术后发生感染的危险因素。见表4。
2.6 预测模型构建
结合表4 的结果,年龄(P=0.035)和术中穿孔(P=0.004)是ESD 术后感染的危险因素,并且术中穿孔(O=11.147)对术后感染的影响最大。以术后是否发生感染为因变量,年龄和术中穿孔为自变量,建立回归方程:Logit(P)=-3.286+1.536(年龄)+2.411(术中穿孔),将分类变量的自变量赋值为0或1。使用Predict Pre 1 命令将回归方程拟合为变量Predicting,Predicting=-3.286+1.536(年龄)+2.411(术中穿孔)。该模型拟合优度检验的结果为χ2=4.95,P=0.763(P>0.05)。接受者操作特征曲线(receiver operator characteristic curve,ROC curve)分析显示,该预测模型的曲线下面积(area under the curve,AUC)为 0.756(95%CI:0.636~0.875,P=0.000),阳性预测率为62.2%,敏感度为69.6%,特异度为76.7%,临界值为0.303。见附图。
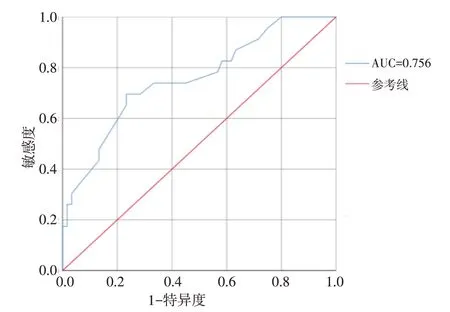
附图 回归方程预测ESD术后感染的ROC曲线Attached fig.The regression equation predicts the ROC curve of infection after ESD
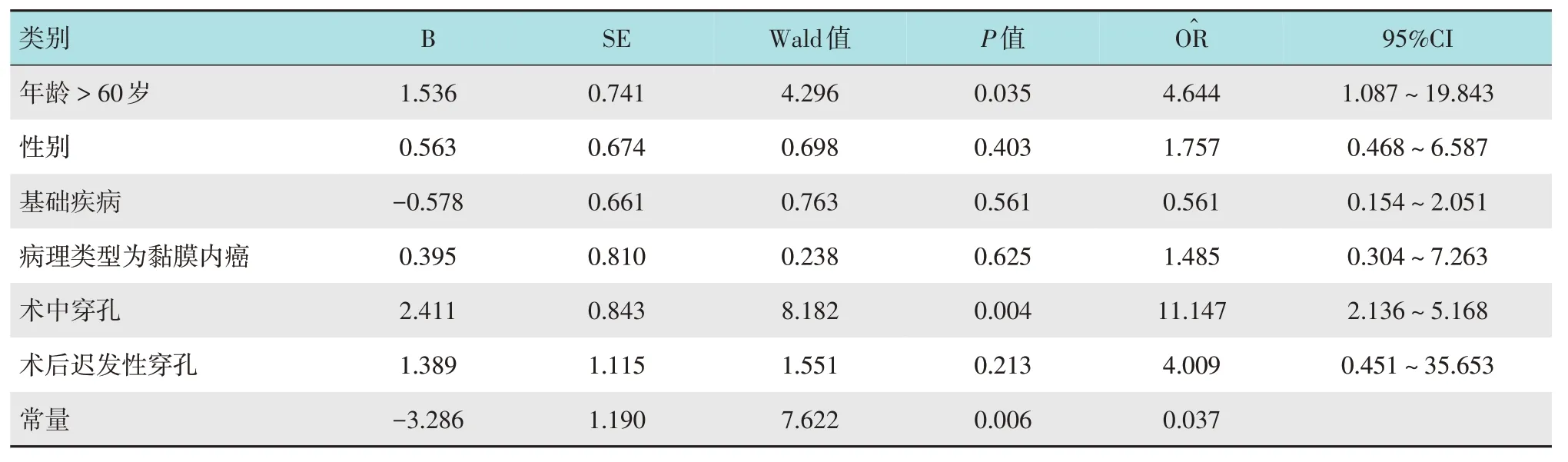
表4 影响ESD术后感染的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of infection after ESD
2.7 术后感染
本研究ESD 术后发生感染23 例(27.7%),对于以发热为主要表现的患者,当体温超过38℃时,抽取静脉血送检细菌及真菌培养;以咳嗽和咳痰为主要表现的患者,及时送检痰细菌及真菌培养。其中,仅1例患者痰培养铜绿假单胞菌阳性,对常用抗生素敏感。术后感染患者经过抗感染、胃肠减压和营养支持等治疗后,症状明显缓解,发热患者体温恢复正常。感染患者的临床表现多样,其术后住院时间、抗生素使用时间、胃肠减压时间和肠外营养时间比较,差异均无统计学意义(P>0.05)。见表5。
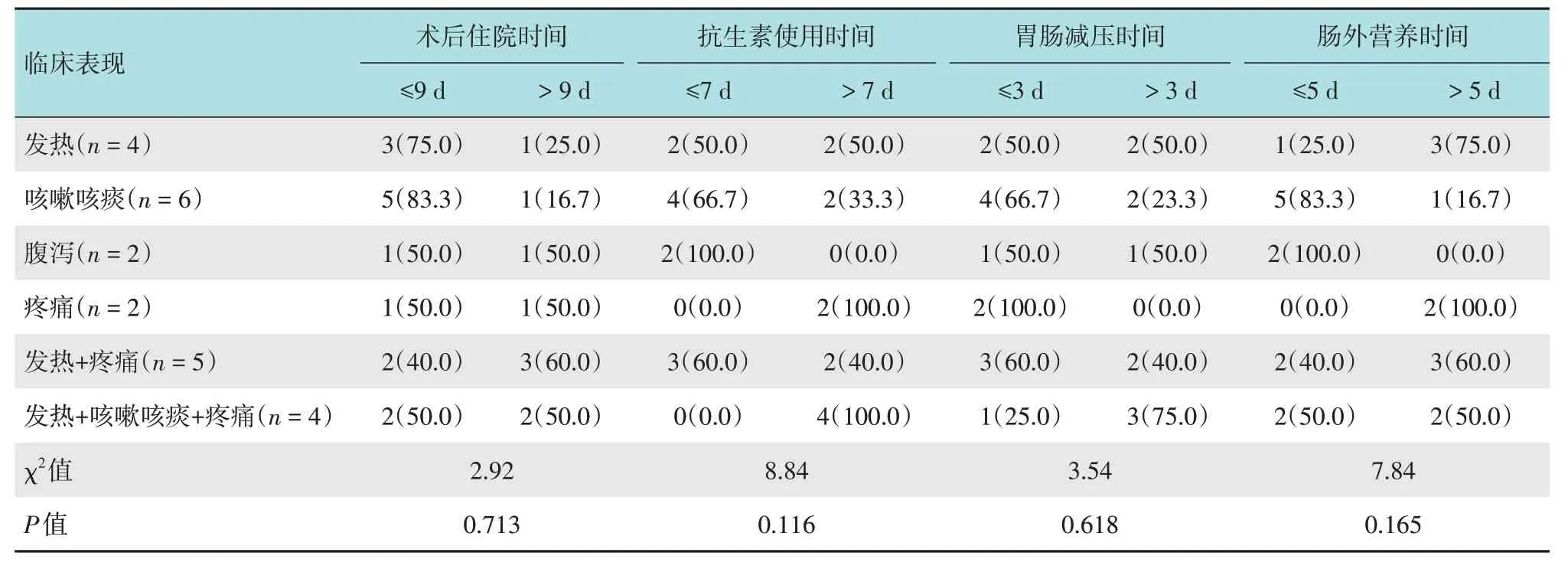
表5 术后感染者不同临床表现的预后指标比较 例(%)Table 5 Comparison of prognostic indexes of different clinical manifestations in postoperative infected patients n(%)
3 讨论
3.1 消化道早癌的治疗
随着现代人生活和饮食方式的改变,消化道早癌的发病率持续增长。随着医疗技术的发展,内镜手术在消化道早癌的治疗中逐渐崭露头角。ESD是内镜下黏膜切除术(endoscopic mucosal resection,EMR)的发展和延伸,与EMR 相比,ESD 具有整块切除范围更大、可一次性完整剥离、便于病理学切缘评估和局部复发率低等优势,但出血、穿孔和感染等常见并发症发生率相对较高[7-8]。出血和穿孔等通过内镜下规范操作及实施预防策略,往往可以获得良好的效果,而术后感染在手术成功后容易被忽略,但其又与患者预后密切相关。因此,筛选出术后感染的高危人群并及时进行干预,有助于缩短患者术后肠道功能恢复时间,提高患者术后生活质量,还能避免进一步对患者全身脏器功能的再次损害。
3.2 影响ESD术后发生感染的危险因素
3.2.1 年龄 与年轻人相比,老年患者大多合并基础疾病,机体组织器官在退行性改变的基础上,又受到进一步打击,均会导致机体免疫力下降,ESD虽然具有创伤小等优势,但是仍会增加老年患者的感染风险[9]。而本研究的单因素分析显示,是否合并基础病与发生术后感染之间差异并无统计学意义。翟祎等[10]对424 例行消化道内镜手术的患者进行回顾性分析,结果显示:实施消化道内镜手术的患者中,感染的发生与年龄≥65岁密切相关。本研究多因素Logistic回归分析显示,年龄>60 岁的患者,ESD 术后感染风险是年龄≤60岁的4.644倍,与上述文献[10]报道一致。
3.2.2 术中穿孔 ESD常见的术中并发症包括出血和穿孔等,创面出血,严重影响操作视野,而且内镜下盲目止血也会进一步增加穿孔率。据报道,ESD导致上消化道早癌术中穿孔率为6%~10%[11-12],下消化道早癌穿孔率为1.4%~4.7%[13-14]。本研究中,上、下消化道早癌穿孔率分别为11.1%和18.1%,与既往报道[11-14]存在一定差异,可能与本研究纳入样本量较小有关。针对穿孔患者,手术医生可使用钛夹封闭创面,术后予以禁食禁饮、抗感染及胃肠减压等对症支持治疗,可促进穿孔的自行愈合[15]。虽然术中穿孔大多能通过钛夹封闭和术后对症治疗处理,但穿孔仍可以导致一系列连锁反应发生。目前,针对穿孔与术后感染之间的关系尚无明确报道,本研究中,两者的单因素分析和多因素Logistic 回归分析,差异均有统计学意义。
3.3 风险模型
风险模型的构建有利于临床工作中早期识别术后感染的高危患者,从而更好地进行围手术期管理。吴江等[16]回顾性分析了560 例消化道早癌病例,经Logistic 回归发现,高血压、操作时间、病灶直径及病灶部位是ESD术后出血的独立危险因素,并构建出预测模型,结果显示:该模型对于消化道早癌ESD术后发生出血风险有良好的预测价值。吕修和等[17]回顾性研究了145 例接受ESD 治疗的食管黏膜病变患者,筛选出病变的环周范围(>3/4)是发生迟发性穿孔的独立危险因素。目前,有关消化道早癌患者实施ESD后并发感染的相关危险因素的研究较少。本研究显示,经多因素Logistic 回归分析,用筛选出的两项危险因素构建预测模型,经拟合优度检验,所得χ2值为4.95,自由度为8,对应P值为0.763(P>0.05),提示:该模型具有较好的校准度;通过ROC 曲线检验得出该模型的AUC为0.756(>0.75),提示:该模型具有较好的区分能力。参考临界值可以为临床中存在术后感染风险较高的个体,采取有效的干预措施提供指导。
综上所述,消化道早癌患者ESD术后感染与患者年龄和术中穿孔有关,该预测模型可有效预测个体ESD术后感染风险。对高感染风险患者提早干预,从而提高患者的生活质量,减少住院时间,也能避免进一步对全身脏器功能的再次打击。但本研究属于回顾性研究,所选患者均来自于同一所医院,可能具有选择偏倚以及样本量较小等不足,统计结果相对受限,仍需今后进行前瞻性、多中心和大样本研究予以验证。

