一株短小芽胞的分离鉴定及其对屠宰牛血液的降解功能研究
向 军, 马子豪, 余金凤, 马忠仁, 丁功涛,周雪雁,*, 张福梅, 默罕默德.索布瑞.塔克瑞夫
(1.西北民族大学生命科学与工程学院,甘肃兰州 730124;2.西北民族大学生物医学研究中心,甘肃兰州 730030;3.西北民族大学医学院,甘肃兰州 730030;4.马来西亚国立大学工程与建筑环境学院化工系,马来西亚雪兰莪州万宜43600)
随着社会的不断发展和人们对肉制品的需求增长,畜禽屠宰过程中所产生的废弃血液也随之增加,无论长时间存放还是消毒处理后排放,都会导致土壤环境和空气污染及资源浪费。目前对于屠宰血液主要被开发利用为高蛋白血饲料(王燕,2017;潘春梅,2015;Yao等,2012)的生产、血蛋白肽(赵静,2015;赫玉兰,2015)制备和血红素(贾志春,2016)提取。传统采用蒸煮干燥、膨化、微生物发酵和酸碱水解等处理方法(Ward等,2009)将血液蛋白制备成畜禽和水产饲料原料,但这种饲料的缺点是适口性差,消化吸收率低,在实际应用上受到很大限制。而血红素的提取或血蛋白肽制备利用程序复杂,要求配置高,对屠宰血液的再利用也非常有限,因此,急需发掘一种对屠宰血液有效处理和全面利用的新途径。相比之下,采用蛋白酶和微生物降解废弃血液生产含氨基酸水溶肥料,可在保护环境的同时实现资源的全面循环利用。研究表明,乳酸菌(Salum等,2017)、碱性蛋白酶和风味蛋白酶(刘元林等,2021)、地衣芽孢杆菌(周雪雁等,2020)、枯草芽孢杆菌 (Wang等,2015)、黑曲霉(Zheng等,2014)和米曲霉(Wang等,2007)都对屠宰牛血污有降解效果,但由于血液中血红蛋白和纤维蛋白空间结构复杂高级,单菌剂和单酶制剂很难完全将血液降解利用。因此,需要大量试验筛选出能够有效降解牛血液的多种微生物和酶类,采用菌-酶协同作用才能实现对血液蛋白的充分降解和全面的利用。本研究旨在从屠宰场血液污泥中筛选出一株高效降解牛血液的菌株,并初步探究该菌株对牛血液的降解效果和优化其降解的最佳参数,为后续的多菌剂和菌-酶协同作用降解血液提供可行性的试验方法,以及将降解后的产物制备成含氨基酸水溶肥的一种新型生态肥料。
1 材料与方法
1.1 分离基质 采集于甘肃省甘南藏族自治州玛曲县屠宰场下水污泥(N:34°31′4″,E:102°39′33″;海拔:3700 m左右)。
1.2 培养基
1.2.1 酪素培养基平板Na2HPO4·12H2O 1.3 g/L,KH2PO40.36 g/L,MgSO4·7H2O 0.5 g/L,ZnCl20.014 g/L,NaCl 0.1 g/L,CaCl2·2H2O 0.002 g/L,酪素4 g/L,胰蛋白酶0.05 g/L,琼脂18 g/L,pH 7.0。
1.2.2 哥伦比亚血琼脂平板 酪蛋白胰酶消化物、肉胃酶消化物、酵母浸出粉、心胰酶消化物、无菌脱纤维羊血、玉米淀粉、氯化钠、琼脂、纯化水。1.2.3 LB培养基 蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH 7.2。
1.3 主要试剂 革兰染色液试剂盒(北京陆桥),细菌生化试剂盒(杭州微生物试剂),细菌DNA提取试剂盒(TaKaRa),甲醛溶液(天津市百世化工),培养基中各试剂均为分析纯。
1.4 仪器与设备 恒温磁力搅拌器(IT-09A5,上海一恒科学仪器),pH仪(Seven2G0TM,上海梅特勒-托利多仪器),电泳仪(DYY-6D,北京市六一仪器厂),立体式蒸汽灭菌器(YXQ-LS,上海博讯医疗生物仪器),超净工作台(SW-CJ-1CU,苏州安泰空气技术),PCR扩增仪(846-X-070-280,德国Biometra公司),恒温培养箱(XMTD-8222,济南来宝器械),恒温振荡器(IS-ROV1,上海智城分析仪器制造),凯氏定氮仪(KjeltecTM 8200,上海展仪仪器设备),蛋白印迹免染检测分析系统(732BR1588,时代联想生物科技)。
1.5 试验方法
1.5.1 菌株分离筛选及形态学鉴定 将血液污泥基质用无菌水进行10-4~10-5梯度稀释,吸取200 μL稀释液均匀涂布于酪素培养基上37℃恒温培养24 h,选取具有透明水解圈的单个菌落,划线接种于哥伦比亚血琼脂平板上继续培养,再挑取有最大溶血环的单个菌落进一步接种于血琼脂平板上纯化,选取纯化后的单个菌落进行革兰氏染色,在光学显微镜下观察并记录菌落的形状、大小、颜色、排列、光泽、透明度、边缘、质地等,判断为纯培养菌株后用体积分数为20%的甘油保存,作为目标菌株。用固定液对目标菌株进行处理,结合扫描电子显微镜观察菌体的大小和形态结构。
1.5.2 生理生化鉴定 吸取适量冻存菌液接种于100 mL的LB培养基中,在37℃、180 r/min的摇床中培养12 h至对数生长期,分别接入50 μL种子液到各生化反应管中培养至指定时间,观察并记录反应结果,做三次平行试验,按照《常见细菌系统鉴定手册》作菌株鉴定(Holt等,1994)。
1.5.3 16S rDNA序列鉴定 将菌株接种于100 mL培养基中,在37℃、180 r/min摇床中培养12 h至对数生长期,吸取2 mL菌液至无菌离心管中,12000 r/min离心2 min后,弃去上清液,提取目标菌 株 的 总DNA。采 用 通 用 引 物27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’对所提DNA进行特异性PCR扩增。PCR反应管中7 μL ddH2O水、2 μL 27F引物、2 μL 1492R引物、12.5 μL 2×TaqMix、1.5 μL DNA模板,总反应体系为25 μL。采用94℃预变性4 min,94℃变性30 s,54℃退火30 s,72℃延伸2 min,30个循环后72℃延伸10 min,4℃冰箱保存,PCR产物委托生工生物工程(上海)股份有限公司进行DNA测序。利用GenBank数据库中Nucleotide BLAST比对功能进行分析(Bethesda等,2021),使用MEGA 7.0软件构建基于16S rDNA序列的Neighbor-Joining系统发育树。
1.5.4 降解血液效果试验
1.5.4.1 碳源、无机盐对降解血液效果的影响采用单因素试验,以20 mL牦牛血液作为氮源,分别在培养基中添加不同的碳源(10 g/L的葡萄糖、蔗糖、麦芽糖、麦麸、乳糖、小麦淀粉、玉米淀粉),按照2%的菌株添加量接种到培养基中,在37℃、180 r/min条件下发酵培养96 h,测定牛血液降解率。确定最优碳源后,优化其最佳浓度,碳源浓度选择0.5%、1%、2%、3%、4%、5%、6%。再对不同的无机盐(5 g/L的NaCl、CaCl2、KCl、MgCl2、ZnCl2、NH4Cl、NaH2PO4+Na2HPO4)进行探究。试验采用甲醛滴定法(杨文博等,2014)测定游离氨基酸的含量,凯氏定氮法(国家食品药品监督管理总局,2016)测定牛血液发酵前总氮含量,牛血液降解率计算公式如下:

1.5.4.2 降解血液发酵条件优化 确定培养基中最佳组分后,以20 mL牛血液作为培养基中氮源,加入80 mL无菌水,依次对不同降解温度、初始pH、接种量和发酵时间进行单因素试验,确定各最优单因素降解条件。降解温度选择20、25、30、35、37、40、45℃;初始pH选择5、6、7、8、9、10、11;接种量选择1%、2%、3%、4%、5%、6%;降解时间选择12、24、36、48、60、72、84、96 h。确定上述最佳培养条件后,对相对体积分数的牛血液进行优化,牛血液体积分数选择5%、10%、15%、20%、25%、30%。1.5.4.3 Plackett-Burman试验设计 以各单因素为试验基础,牛血液降解率(%)为响应值,利用minitab19软件对降解时间(h)、接种量(%)、麦麸浓度(g/L)、降解温度(℃)、初始pH和血液体积(%)6个影响因素进行n=12的Plackett-Burman试验设计(表1)。

表1 Plackett-Burman试验设计因素及水平
1.5.5 响应面Box-Behnken试验设计 根据Plackett-Burman试验设计结果分析,利用Design Expert 8.0软件对接种量、初始pH、降解温度和麦麸浓度4个因素进行4因素3水平的Box-Behnken试验设计(表2)。

表2 Box-Behnken试验设计因素及水平
2 结果与分析
2.1 菌株分离筛选及形态学鉴定 试验用酪素培养基和哥伦比亚血琼脂平板分离得到一株能够降解牛血液的菌株。将菌株置于37℃恒温培养箱中培养24 h后,观察到在血琼脂平板上的菌落形态为圆形、凸起、灰白色、表明光滑、黏稠、边缘整齐、不透明、有光泽,直径2.7~4.2 mm,溶血圈的大小约为10.0 mm,在酪素培养基平板上菌落形态为白色,菌落直径为1.0~1.4 mm,透明水解圈直径约为4.5 mm(图1)。选取单一菌落接于LB培养基中,置于37℃、180 r/min的摇床培养12 h,结合革兰氏染色镜检和扫描电子显微镜观察,菌体细胞呈蓝紫色,杆状,为革兰氏阳性菌,大小为0.4~0.6 μm×1.2~3.1 μm,两端钝圆,有芽孢,周生鞭毛,呈单个或两个排列(图2)。2.2生理生化鉴定 根据细菌生理生化鉴定试验,通过糖发酵、枸橼酸盐、硝酸盐还原、大分子水解等试验对菌株NWMCC0302进行生理生化特性测定(表3),结合《常见细菌系统鉴定手册》进行分类分析,鉴定该菌株为芽孢杆菌属。
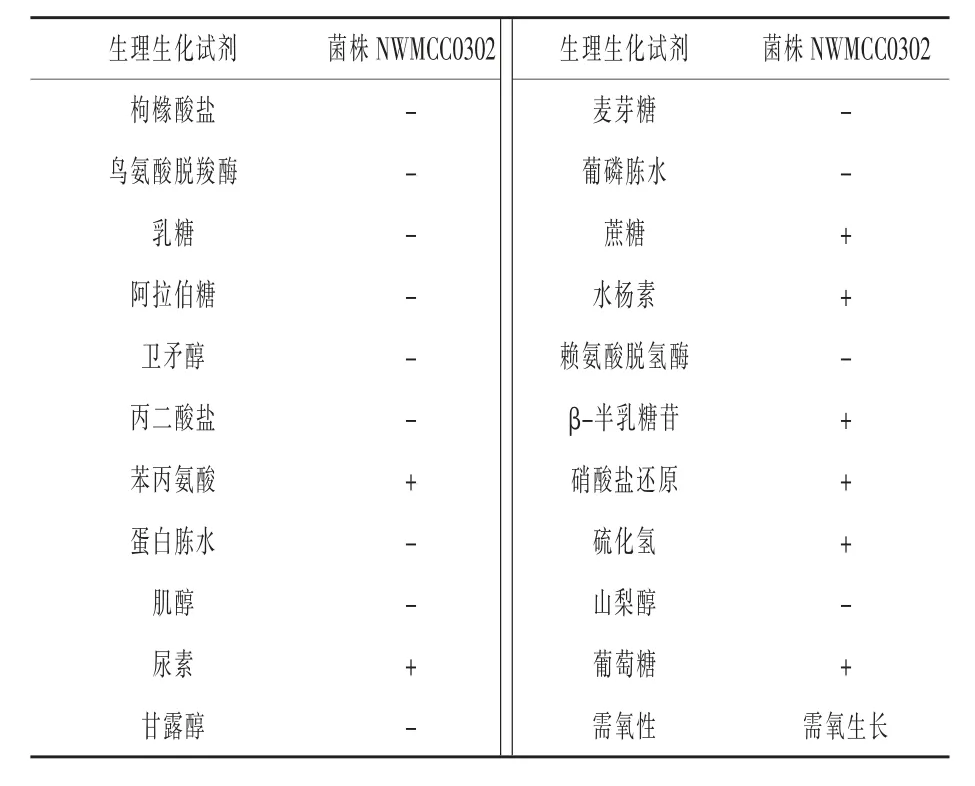
表3 菌株NWMCC0302生理生化反应试验结果

图1 菌株NWMCC0302在酪素培养基平板(上)与哥伦比亚血琼脂平板(下)上的菌落形态特征
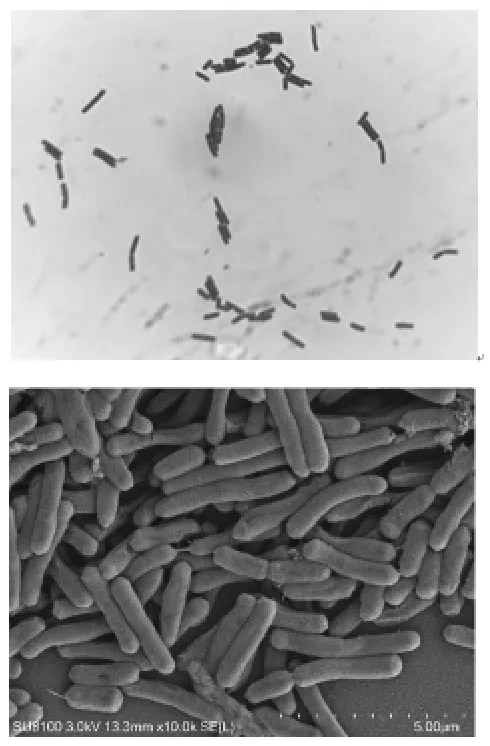
图2 菌株NWMCC0302革兰氏染色镜检(×1000倍)(上)与扫描电子显微镜结果(×10000倍)(下)
2.3 16S rDNA序列分析 将菌株NWMCC0302提取的总DNA进行特异性PCR扩增,扩增后产物大小约为1500 bp。利用NCBI中Nucleotide BLAST功能对测序的16S rDNA序列(1371 bp)进行同源性比对,结果显示与Bacillus pumilusstrain ATCC 7061相似性为99.93%,与Bacillus pumilusstrain NBRC 12092相似性为99.93%,结合该菌株的形态学特征及生理生化特性鉴定为短小芽胞。利用MEGA 7.0软件对数据进行多重比对分析并构建以16S rDNA基因序列为基础的Neighbor-Joining分子系统发育树(图3)。将菌株测序所得的16S rDNA序列提交至GenBank,准入编号为OL636364, 并 命 名 为Bacillus pumilusstrain NWMCC0302。
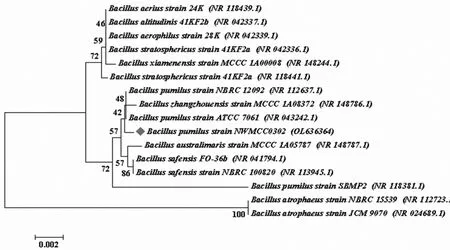
图3 以16S rDNA序列构建的Neighbor-Joining分子进化树
2.4 降解血液效果试验结果分析
2.4.1 碳源、无机盐对降解血液效果分析 如表4所示,在培养基中添加10 g/L浓度的不同碳源,得到以麦麸为碳源时的降解率最大(30.44%),其次是小麦淀粉和玉米淀粉的降解率分别为24.22%和24.37%,因此则选择麦麸作为降解血液菌株的最佳碳源。根据不同的碳氮比对麦麸进行浓度筛选,随着浓度的增大,降解效果先升高后下降,且当麦麸浓度为20 g/L时降解率最大,为22.47%。综合考量麦麸的经济价值,后续试验中选择麦麸为主要碳源。
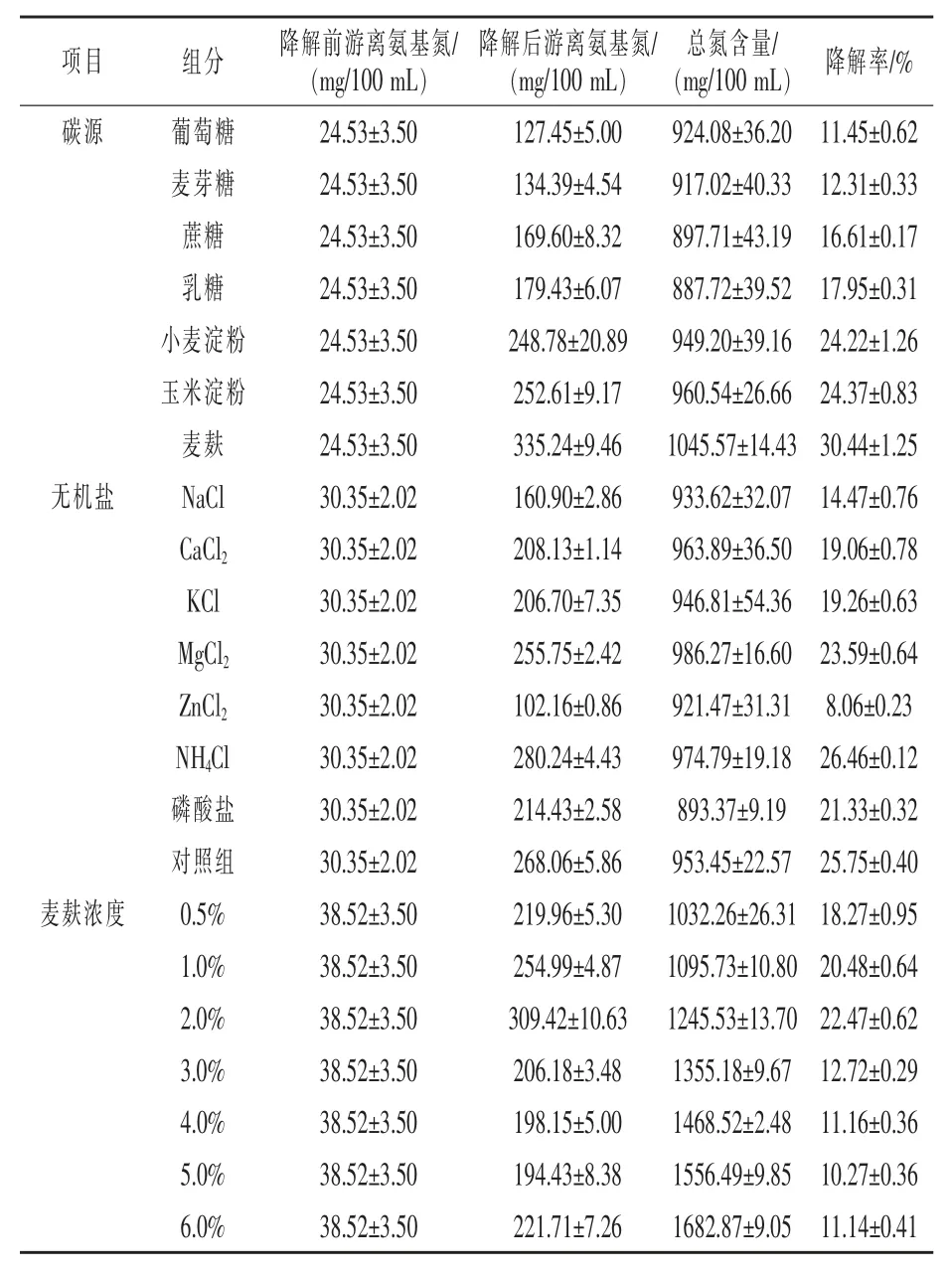
表4 不同培养条件下的牛血液降解结果
无机盐对血液降解的影响结果如表4所示,不同的无机盐对血液降解效果的影响有所不同,以NH4Cl为无机盐时降解效果最好,为26.46%,添加麦麸空白对照的降解效果为25.75%,以Zn-Cl2为无机盐时降解效果最差,为8.06%。根据试验分析,在一定浓度下,NH4+离子能够提高蛋白酶的活性,Zn2+离子对该菌株所产的蛋白酶具有一定的抑制作用。由于本试验中加入的NH4+离子中含有氮元素,对于测定血液降解率有一定的影响,基于后续工业化经济性以及考虑到牛血液中本身含有一定的无机盐离子,因此后续选择不添加无机盐进行试验优化。
2.4.2 降解血液发酵条件各单因素优化分析
2.4.2.1 发酵时间 发酵时间对血液降解的影响结果如图4A所示,随着发酵时间的增加,降解效果从12 h至96 h一直处于上升趋势,96 h时达到最大降解效果,最大降解率为21.61%,进而增加发酵时间,降解效果下降。因此,重复试验后选择96 h为最佳发酵时间。
2.4.2.2 接种量 结果如图4B所示,当菌株接种量为2%时,有最大降解效果且最大降解率为13.07%。随着菌液浓度的增加,菌株NWMCC0302对牛血液的降解效果明显下降,故根据试验结果分析最佳降解牛血液菌株接种量选择2%。
2.4.2.3 温度 不同温度对血液降解的结果如图4C所示,随着降解温度的升高,降解率也随之增大,在降解温度为37℃时,此时有最大降解率为20.02%。当温度到达45℃时,菌株对血液的降解效果降低至7.95%。因此,该菌株最适降解牛血液温度为37℃。
2.4.2.4 初始pH发酵的初始pH对血液降解的结果如图4D所示,当pH为7时,有最大降解效果且最大降解率为39.73%,随着初始pH的继续增加,降解效果逐渐降低。
2.4.2.5 牛血液体积浓度 结合各发酵条件,对不同添加牛血液体积浓度进行了探究,如图4E所示,随着培养基中牛血液体积浓度的增加,降解效果先增加后下降。当牛血液体积浓度为10%时,有最大降解效果(降解率为19.67%)。随着牛血液体积浓度继续增加,降解效果逐步下降。因此,多因素试验设计采用10%牛血液对降解效果进行探究。
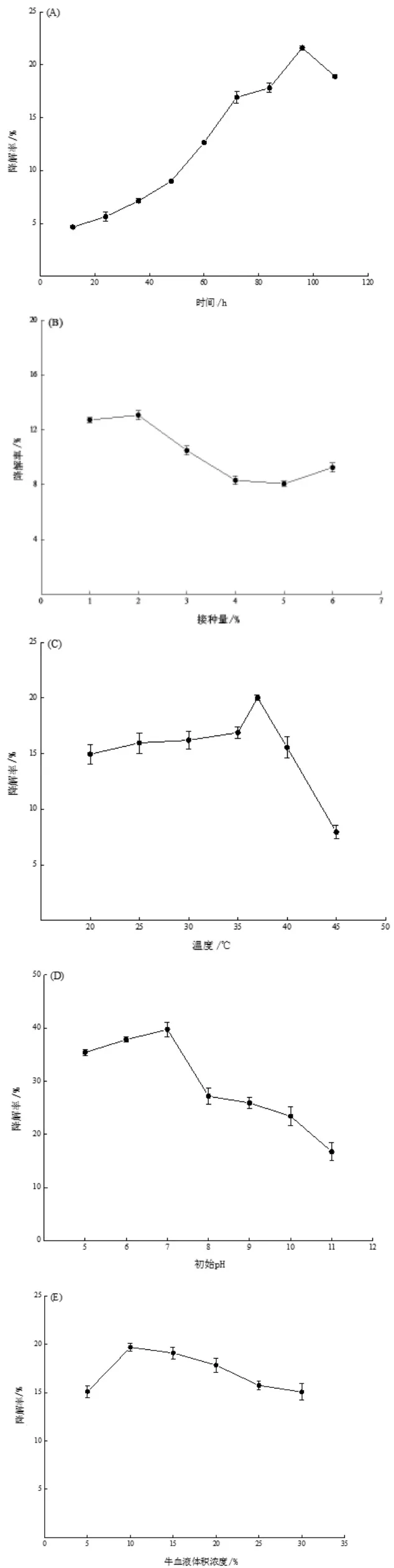
图4 降解时间(A)、菌株接种量(B)、降解温度(C)、初始pH(D)、牛血液体积浓度(E)对降解牛血液效果的影响
2.4.3 Plackett-Burman试验结果分析 利用Plackett-Burman试验设计对各最优单因素条件进行优化,采用软件Minitab 17对试验数据进行多元回归分析(表5),得到以血液降解效果为响应值的最优方程:Y=34.41-1.72X1+3.82X2-2.59X3+2.74X4-2.91X5+0.12X6。根据表6中方差分析结果表明,该模型显著(P=0.027<0.05),根据方差分析显著性大小可知影响降解血液效果的因素依次为:X2(接种量)>X5(初始pH)>X4(降解温度)>X3(麦麸浓度),而X1(降解时间)和X6(牛血液体积浓度)对降解血液效果不显著。因此,筛选出菌株接种量(P=0.012<0.05)、初始pH(P=0.033<0.05)、降解温度(P=0.041<0.05)以及麦麸浓度(P=0.049<0.05)这四个关键因素并结合单因素试验结果进一步做Box-Behnken试验设计和分析。
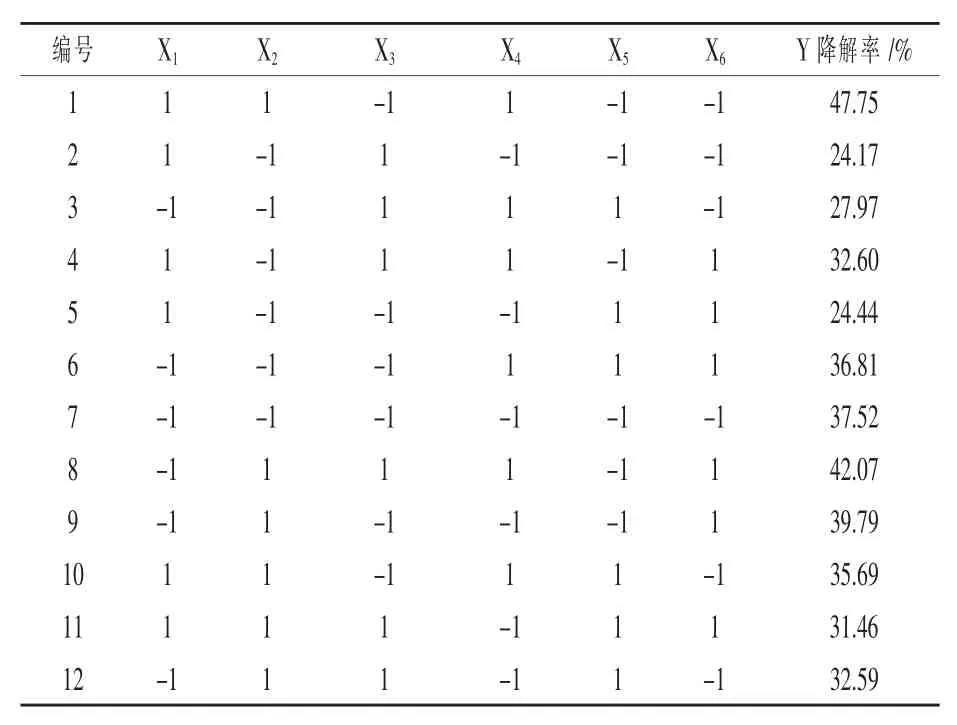
表5 Plackett-Burman试验设计及响应结果分析

表6 Plackett-Burman试验设计各影响因素方差分析
2.4.4 响应面Box-Behnken试验设计结果分析结合Plackett-Burman试验设计结果分析,采用软件Design-Expert.V8.0.6对试验数据进行多元回归拟合分析,各因素间交互作用的3D响应曲面如图5所示,并获得二元多次回归方程:Y1=48.87+2.25A+8.75B+2.09C+4.54D-0.73AB-0.19AC-1.32AD+1.11BC+2.19BD-0.06CD-5.96A2-6.40B2-2.63C2-11.57D2,Y1是降解效果,A是菌株接种量,B是初始pH,C是降解温度,D是麦麸浓度。
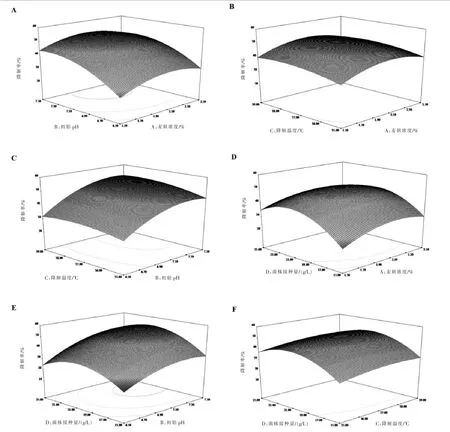
图5 各影响因素交互作用的响应曲面图
进一步对回归模型做方差分析,由表7所示,该回归模型极显著(P=0.0001<0.01),失拟项不显著(P=0.5618>0.05),模型相关系数R2=0.9461,校正相关系数R2Adj=0.8922,说明该模型拟合度良好,试验实际值与预测值具有高度的相关性,可用于预测该菌株对血液降解效果。试验模型中的一次项B(P=0.0001<0.01)、D(P=0.0002<0.01)与二次项A2(P=0.0002<0.01)、B2(P=0.0001<0.01)、D2(P=0.0001<0.01)对降解血液效果影响达到极显著水平,而一次项A(P=0.0249<0.05)、C(P=0.0348<0.05)与二次项C2(P=0.0489<0.05)则为显著水平,其他相关系数对降解血液效果影响不显著。

表7 Box-Behnken试验设计及响应结果分析
根据拟合模型优化分析,通过Design-Expert.V8.0.6软件预测该菌株对血液降解参数的最优条件为A=0.1、B=0.76、C=0.56、D=0.26,换算成实际理论值为菌株添加量2.05%、初始pH 7.39、降解温度38.11℃、麦麸浓度2.131%,预测的最高降解率为53.53%。根据得到的最佳条件,对该模型进行准确性验证,用优化后的降解条件对牛血液进行7次降解试验,测得牛血液降解率和总氮含量 分 别 为51.18%(696.27 mg/100 mL)、52.75%(688.69 mg/100 mL)、53.54%(672.84 mg/100 mL)、55.11%(651.89 mg/100 mL)、57.47%(646.55 mg/100 mL)、56.69%(646.19 mg/100 mL)、50.08%(698.38 mg/100 mL),对牛血液的平均降解率为53.83%,与预测结果基本一致,表明该优化模型能够较好的预测血液发酵结果。
3 讨论
目前对于屠宰废弃血液的生物降解较多采用蛋白酶水解法,蛋白酶能够有效地将血液蛋白水解,水解后的产物中含有小分子肽和游离氨基酸等物质,可用于动物饲料和有机肥制备,从而增加它们的使用价值。江霞等(2012)采用风味蛋白酶和胰蛋白酶对猪血蛋白进行水解试验,当降解温度为50.88℃、初始pH为8.15、复合酶配比为0.96:1、底物浓度为6%和降解时间为6 h时,水解率达到43.13%。刘成梅等(2010)结合中性蛋白酶和风味蛋白酶同步水解鸭血蛋白,当初始pH为7.1、降解温度为50.5℃、酶解时间为4.8 h时,对鸭血的水解率为25.75%。Raúl Pérez-Gálvez等(2011)利用碱性蛋白酶对猪血红蛋白进行酶解优化,当发酵pH为7.5、降解温度为59.8℃、酶与底物比例为10%时,有最大水解度为30.29%。由于血红蛋白和血纤维蛋白的空间结构复杂,蛋白酶水解过程单一,酶效应有限,因此未能获得对血液蛋白的完全水解。
许多微生物菌株在发酵过程中产生胞外蛋白酶能够将大分子蛋白质分解成小分子多肽和氨基酸类水解物。例如,Zheng等(2014)通过对枯草芽孢杆菌进行紫外线诱变产生中性蛋白酶,在最佳条件温度33.8℃,降解时间69.36 h,pH 7.0,接种菌液含量7.2×107cfu/mL,250 r/min下对血红蛋白降解率为62.05%。Zhang等(2014)采用基因工程的方法将米曲霉蛋白酶基因重组到毕赤酵母菌中,通过对3.15%底物浓度血液进行降解试验,降解率达到49.05%。Asha等(2018)利用亚硝酸和紫外线对蜡样芽孢杆菌进行诱变处理后降解血红蛋白,当血红蛋白浓度为1.05%时,降解率为53.29%。李晓宇等(2021)利用枯草芽孢杆菌、短小芽胞和贝莱斯芽孢杆菌制备成复合菌剂,对屠宰牛废弃物进行堆肥试验,降解率达到95%以上。这些菌株大多数可以在有氧或无氧条件下产生分解血液蛋白的酶类,而这些蛋白酶在降解过程中对原料的要求较低,能全面保留血液水解后的氨基酸种类,并且可供植物吸收的左旋氨基酸也能得到保护,同时水解液中寡肽含量较高及有害物质较少 (Zhang等,2019;Wang等,2017)。
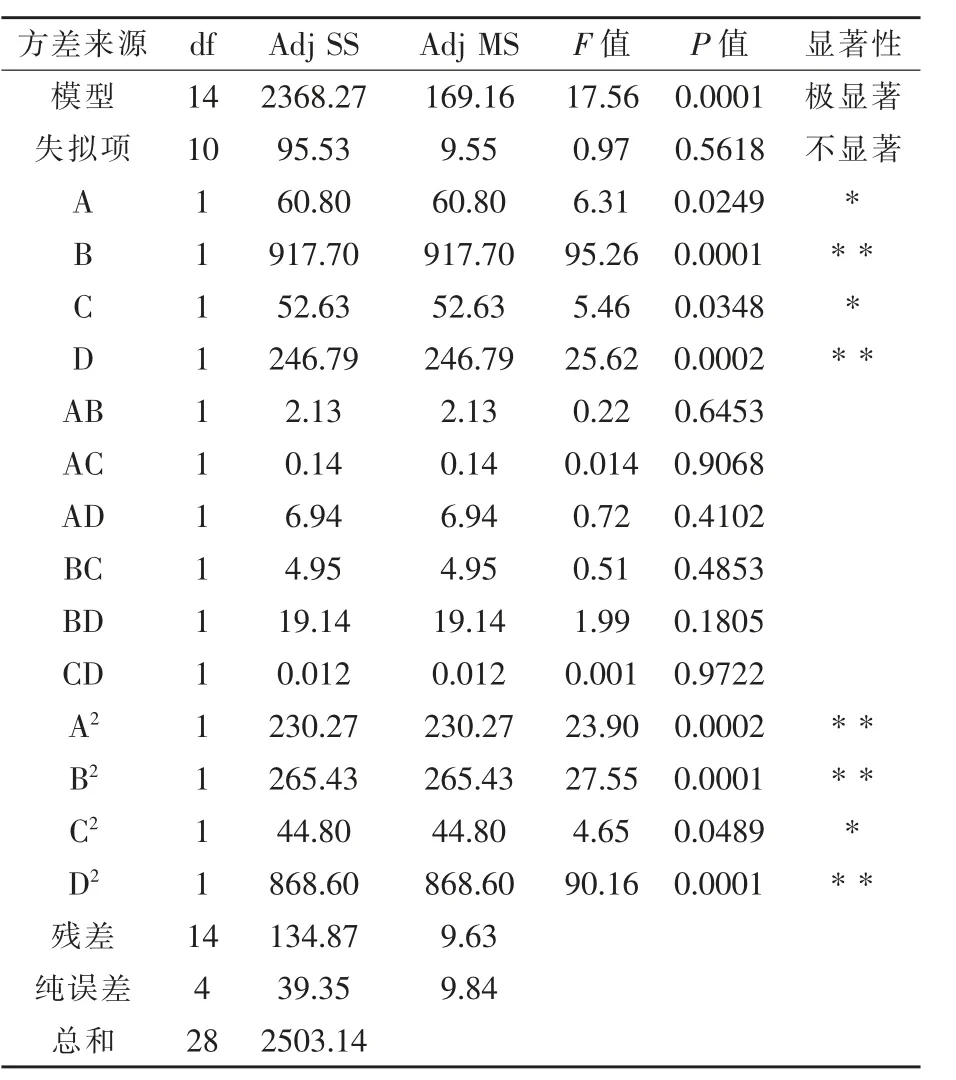
表8 Box-Behnken试验回归模型方差分析
微生物菌株对血液蛋白的降解机制比蛋白酶水解过程更为复杂,前者不仅存在其产生蛋白酶分解血液蛋白底物,同时还存在菌株生长繁殖需要利用血液蛋白底物作为氮源,从上述的研究数据来看,菌株的发酵降解率高于蛋白酶水解率。本试验筛选出的短小芽胞利用10%底物对牛全血液进行降解试验研究,优化其降解条件后的降解率为53.83%,较上述研究报道中的毕赤酵母菌和蜡样芽孢杆菌降解率要高,但是对于血液的降解处理还是没有完全利用。不同菌株对血液蛋白的降解能力是由菌株自身蛋白酶产生的数量及酶活性所决定,但血液降解除了受到所产蛋白酶影响外,还受到菌株自身的利用及血液蛋白浓度的影响。血液蛋白浓度对于整个分解体系来说,菌株对血液蛋白的利用机制比较复杂,菌株的生长会受到培养条件的影响,当血液添加量较少或较多时,则不能为菌体的生长提供适宜的繁殖条件,对于蛋白酶产生的数量也会受到一定的影响。但菌株在整个复杂的降解过程中,除了自身的生长之外,产生蛋白酶的数量,蛋白酶分解及菌株利用血液蛋白的多少,都需要进一步的研究。畜禽血液中的血红蛋白和纤维蛋白空间结构复杂,血液的理化因素复杂,导致蛋白酶无法完全水解,菌株无法完全分解利用,而现有菌株对血液蛋白的利用能力有限,因此如何将畜禽血液蛋白更全面彻底地降解以及对降解产物的开发有待进一步探究。就目前存在的问题可以采用以下几种途径:第一,探明蛋白酶水解和菌株降解的机制,优化菌株配方制备成复合菌剂来提高菌株利用血液的能力;第二,利用突变育种或基因工程育种方法对菌株进行优化,以增加菌株蛋白酶的产量,从而提升对血液的水解能力;第三,采用发酵补料或血液前处理的方式对血液进行降解;第四,采用菌-酶协同作用的方法实现对畜禽血液蛋白的充分降解和再利用。本试验中筛选出的短小芽胞对牛血液具有较高的降解能力,对动植物具有抗菌、抗病毒和改善农作物品质等益生作用(向军等,2021),可以作为微生物法降解牛血液的候选菌株,降解后的产物可制备成含氨基酸水溶肥料,从而实现对牛血液废弃物进行降解处理,既能有效解决对环境带来的污染问题,又能全面利用血液资源,提高废弃蛋白附加值,具有重要的现实意义。
4 结论
本研究利用酪素琼脂平板和哥伦比亚血琼脂平板从屠宰场血液污泥中分离得到一株高效降解牛血液的菌株NWMCC0302,根据形态学特征、生理生化特性和16S rDNA测序分析,鉴定为短小芽胞。利用该菌株对牛血液进行降解试验研究,以20 mL牛原血液作为氮源,得到影响降解牛血液关键影响因素为初始pH、麦麸浓度、接种量和降解温度。优化后的最佳降解参数为初始pH 7.39、麦麸浓度21.31 g/L、菌株接种量2.05%(V/V)、降解温度38.11℃、降解时间96 h、血液体积浓度10%(V/V),在该条件进行验证试验得到对牛血液的降解率为53.83%。

