LED补光对蛋白核小球藻生长和脱氮除磷的影响
甘钰华,魏 群,马湘蒙,杨尚茹,毛 瑞
(广西大学 资源环境与材料学院,南宁 530004)
微藻在废水处理方面具有巨大的潜力,废水的处理效率在很大程度上取决于微藻的生长情况。微藻的培养受到光照、温度、溶解氧、pH、营养物质等参数的影响[1-2],其中光照是影响微藻光合作用的重要因素之一[3-4]。光强度和光质是光照的两个重要参数,对微藻生长具有重要的调控作用[5]。光强度过高会导致光氧化和光抑制,而光强度过低会由于光限制导致微藻生长速率下降[6]。特定波长会影响微藻的生长和细胞生理指标[7-8],Wang等[9]研究发现Spirulina platensis在红光照明下的生物量积累速率要高于蓝光和白光。Shu等[10]研究表明Chlorella sp.在蓝光照明下的脂质含量比红光高。Blair等[11]采用蓝光照明培养Chlorella vulgaris,与红光和白光相比,蓝光的生物量有所增加。Yan等[12]在不同的光质下利用Chlorella sp.进行沼液的净化和沼气的提纯,研究结果表明,红色∶蓝色=5∶5的混合LED是最佳的光质组合,微藻的干重为506.30±38.47 mg/L,总氮(total nitrogen,TN)和总磷(total phosphorus,TP)的去除率分别达到了77.27±6.35%和79.32±6.83%。综上所述,光质在微藻的生长过程中起着重要的作用,由于微藻细胞代谢途径、光合色素积累和光受体的差异,不同的光质条件可能影响微藻的生长和脱氮除磷效率。
目前,微藻的补光研究基本上都是集中于补充光强、延长光周期或组合光对微藻生长的影响[13-17],而针对白光条件下补充某特定光质对微藻生长影响和脱氮除磷效果的研究甚少。因此,本实验设置了白红光(WR)、白蓝光(WB)、白绿光(WG)和白光(W)的光质组合,比较分析了在不同补光条件下的蛋白核小球藻的光密度(OD680)、生长速率、脂质含量和光合色素含量等指标变化情况以及脱氮除磷效果。
1 实验材料与方法
1.1 实验材料
(1)藻种:蛋白核小球藻(Chlorella pyrenoidosa)购自中国科学院水生生物研究所。
(2)补光光源:耐特辉LED(长330 mm、宽22 mm、高34 mm),功率为4 W。补充光源的三种LED分别为蓝光B(390~455 nm)、绿光G(492~580 nm)和红光R(622~760 nm);白光W(400~700 nm)作为对照。三个实验组为WR、WB、WG,对照组为W,实验通过调整红蓝绿LED灯的距离将光量子通量密度(photosynthetic photon flux density,PPFD)控制在80 μmol/(m2·s)。
(3)模拟生活污水:模拟生活污水的配方[18]见表1。
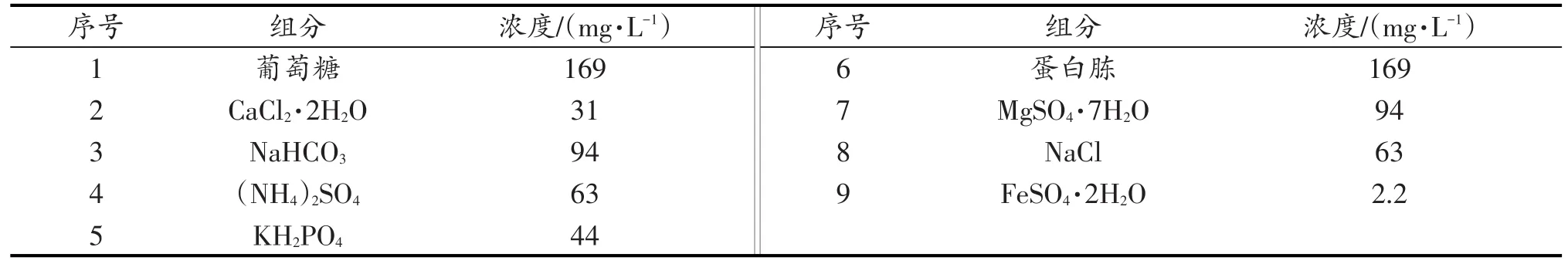
表1 模拟生活污水配方Table 1 Formula of simulated domestic wastewater
1.2 实验设计
1.2.1 微藻扩培
记号笔、量筒、酒精灯、玻璃棒等物品与高压灭菌冷却后的BG-11培养基[19]一同置于超净工作台中紫外灭菌30 min,然后按藻液与培养基1∶10的比例接种,用牛皮纸密封锥形瓶口并摇匀。在25±1℃、光强6 000 lx连续光照下培养,每天定时摇瓶3次。
1.2.2 LED补光对蛋白核小球藻生长和脱氮除磷的影响实验
藻液取样放入离心管,将样品放入离心机,以4 000 r/min离心10 min,去除上清液并用纯水洗涤,以上步骤重复3次(防止培养基中的氮磷元素以及微藻代谢物对新的实验产生干扰),获得的蛋白核小球藻备用;将蛋白核小球藻和配制好的模拟生活污水混合在1 L锥形瓶中,藻液体积为800 mL,初始OD680值为0.20,初始pH为7.0±0.1。用气泵以1 vvm(air volume/culture volume/minute)的速度供应二氧化碳用于微藻生长。在25±1℃和6 000 lx条件下进行4 d的实验,测定OD680、光合色素和脂质含量、TN和TP等指标。每组实验设置三个平行样。
1.3 指标检测方法
(1)OD680:用分光光度法测定[20]。
(2)光合色素:采用Cheirsilp等[21]的改良方法进行测量。取5 mL藻液加入离心管中,4 000 r/min离心10 min后倒掉上清液。往离心管中加入5 mL 90%丙酮对色素进行提取,超声破碎10 min。剧烈涡旋2 min混匀,在4℃的黑暗环境中反应2 h后以4 000 r/min离心10 min,在450 nm、630 nm、664 nm、647 nm、750 nm处,以90%丙酮作为空白参比,测量上清液的吸光度。
叶绿素a(Chlorophyll a,Chl a)、叶绿素b(Chlorophyll b,Chl b)的含量根据式(1)和(2)计算:
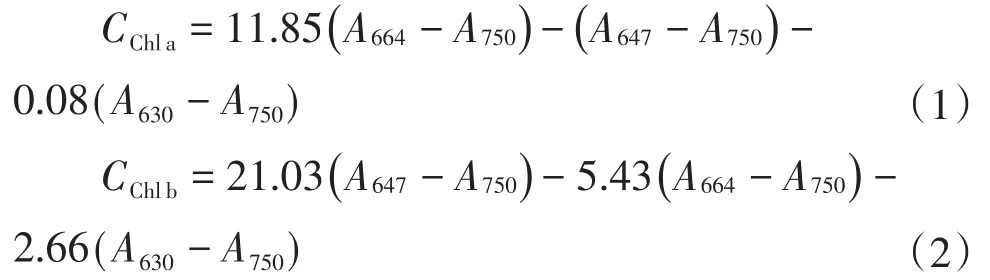
类胡萝卜素(Car)的含量根据式(3)[22]计算:

式中:CChla,CChlb,CCar的含量单位为mg/L;A表示在一定波长(450 nm,630 nm,647 nm,750 nm)的吸光度值。
(3)脂质含量:采用氯仿甲醇共溶剂提取法[23]。取20 mL藻液滴入离心管中,以8 000 r/min离心10 min后倒掉上清液。往离心管中加入15 mL氯仿/甲醇(2∶1)溶液和150 μL 1 mol/L HCl溶液,将离心管横置于摇床上震荡3 h后加入5 mL 0.9%NaCl溶液,涡旋2 min混匀后以8 000 r/min离心10 min。用无菌注射器将离心分层的有机相抽取至已称重的锡纸盘内,随后将锡纸盘置于通风橱的电热板中80℃干燥至恒重[24],按照式(4)计算。

式中:Wlipid为微藻脂质含量,%;Li和DWi分别为第i天的微藻脂质产量和藻粉的质量,均为g。
(4)TN:用过硫酸钾氧化-紫外分光光度法测定。
(5)TP:用钼酸铵分光光度法测定。
1.4 数据处理
氮和磷去除率R,微藻的比生长率μ,微藻生物量产率P的计算公式如下:
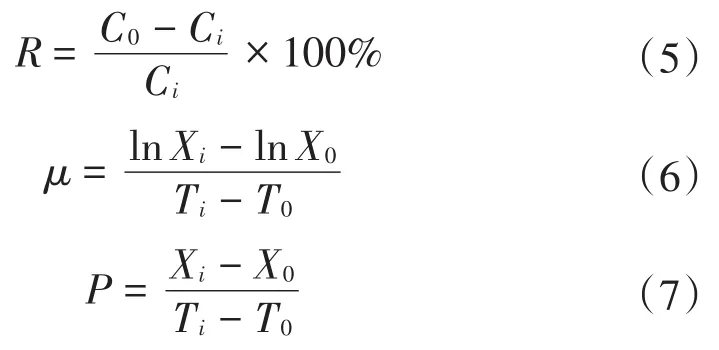
式中:R为氮和磷去除率,%;Ci和C0分别为第i天和初始的氮磷浓度,mg/L。μ为比生长速率,d-1;Xi和X0分别为第i天的微藻浓度和初始微藻浓度,g/L。P为生物量产率,g/(L·d)。
2 结果与讨论
2.1 数据处理
2.1.1 OD680、比生长速率μ和生物量产率P
不同补光条件下蛋白核小球藻的生长情况如图1所示。从图1可知,实验组和对照组的微藻在实验前2 d内迅速生长繁殖,而后生长趋于平缓。实验结束后WR、WB、WG实验组和W对照组的OD680分别为 1.908、2.032、1.923、1.459。因此,相比于对照组,补充红光、蓝光和绿光均可刺激蛋白核小球藻生长,但是微藻的生长情况因光质的变化而不同,与Mutaf等[25]、Gordon等[26]的研究结论一致。

图1 不同补光下蛋白核小球藻的OD680随时间的变化Fig.1 Chlorella pyrenoidosa OD680changes with different supplementary light over time
不同补光下蛋白核小球藻的比生长速率和生物量产率变化情况,如图2所示。由图2可知,WB实验组的比生长速率和生物量产率均为最高,分别为0.12/d、0.096 g/(L·d);WR实验组次之,比生长速率和生物量产率分别为0.10/d、0.084 g/(L·d);WG实验组最低,比生长速率和生物量产率分别为0.06/d、0.051 g/(L·d)。蛋白核小球藻的光合色素对不同种类的光质的吸收存在差异,进而影响微藻的光合速率,因而在不同补光条件下的蛋白核小球藻呈现出不同的比生长速率,蛋白核小球藻细胞对蓝光具有极强的光捕获能力。另外,由于蓝光促进了微藻光合作用中酶的活性和能量传递等活动[27],从而加快微藻的生长速度,因此,WB组的微藻生物量产率更高。
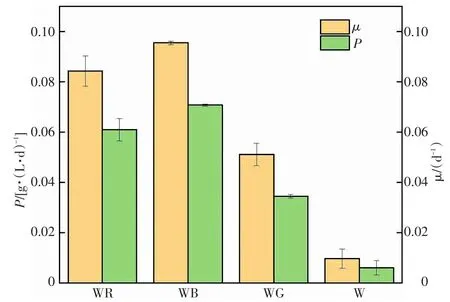
图2 不同补光下蛋白核小球藻的比生长速率和生物量产率Fig.2 Specific growth rate(μ)and biomass productivity(P)of Chlorella pyrenoidosa under different supplementary light
2.1.2 光合色素
不同补光下蛋白核小球藻的光合色素含量情况如图3所示。由图3可知,实验组的微藻光合色素含量为:WG>WR>WB>W。实验结束时,WG实验组蛋白核小球藻的光合色素含量明显高于其他实验组。实验4 d后WG组的Chl a、Chl b和Car含量分别达到了10.61 mg/L、3.52 mg/L、4.52 mg/L;WR实验组的Chl a、Chl b和Car含量分别达到了8.21 mg/L、2.57 mg/L、3.58 mg/L;WB 实验组的Chl a、Chl b和Car含量分别达到了6.98 mg/L、2.38 mg/L、3.44 mg/L。相比之下,W对照组的光合色素含量最低,Chl a、Chl b和Car含量分别为5.23 mg/L、1.56 mg/L、2.57 mg/L。综上所述,蛋白核小球藻在绿光胁迫条件下,通过调整其光系统复合体中捕获光子的“触角”来响应环境的变化[28],合成更多主要吸收红蓝光质的Chl a和Chl b,微藻浓度和光合色素含量之间却无线性关系[29],因此,尽管在WB的光照条件下蛋白核小球藻的生物量产率和比生长速率最高,但不是诱导色素合成的最有效光照组合。

图3 不同补光下蛋白核小球藻的光合色素含量Fig.3 Photosynthetic pigments content of Chlorella pyrenoidosa under different supplementary light
2.1.3 脂质含量
不同补光下蛋白核小球藻的脂质含量随时间的变化如图4所示。由图4可知,WR实验组生长2 d后的蛋白核小球藻脂质含量由初始值20.16%降到15.24%,而后回升,第4 d蛋白核小球藻的脂质含量达到干重的24.01%。高脂质含量通常伴随着较低的生长速率与高脂质产量[30],WR实验组蛋白核小球藻在前2 d迅速生长繁殖,第3、4 d微藻生长速率有所减缓,因此,WR实验组短期内(前2 d)蛋白小球藻脂质含量较低,而在第4 d蛋白核小球藻的脂质含量回升到了24.01%。与WR实验组相反的是,WB实验组的蛋白核小球藻生长2 d后的脂质含量由初始值20.16%增加到22.6%,而到第4 d又降低到17.70%,这可能是由于蓝光可以有效刺激碳酸酐酶(CA酶)和核酮糖二磷酸羧化酶(Rubisco酶)的活性,从而在微藻细胞体内积累甘油三酯。但是由于蓝光的能量较高,长时间的蓝光应激不利于微藻脂质的积累[31]。

图4 不同补光下蛋白核小球藻脂质含量随时间的变化Fig.4 Changes of lipid content of Chlorella pyrenoidosa under different supplementary light over time
补充绿光可以刺激蛋白核小球藻脂质积累,实验结束时WG实验组的微藻脂质含量最高,达到27.67%,表明较高的脂质产量需要一定的压力胁迫,绿光可能触发了微藻中与脂质相关的代谢反应使其得到较高的脂质产量,例如,蛋白质和DNA等细胞内化合物的降解以及脂质和碳水化合物等能量丰富的化合物的积累[32]。
2.2 补光对蛋白核小球藻脱氮除磷的影响
2.2.1 TN浓度变化
不同补光下蛋白核小球藻的TN浓度随时间变化情况如图5所示。由图5可知,在WR、WB、WG实验组和W对照组中,TN由初始平均浓度58.61 mg/L分别降至5.32 mg/L、7.57 mg/L、9.28 mg/L和3.66 mg/L,去除率分别为90.92%、87.08%、84.17%和93.76%。实验发现WR实验组在前2 d的TN去除效果比其他实验组差,微藻细胞对氮的吸收速率较低。因为氮的吸收速率是影响微藻细胞内脂质合成的关键因素[33],因此,WR实验组前2 d的脂质含量最低(图5)。
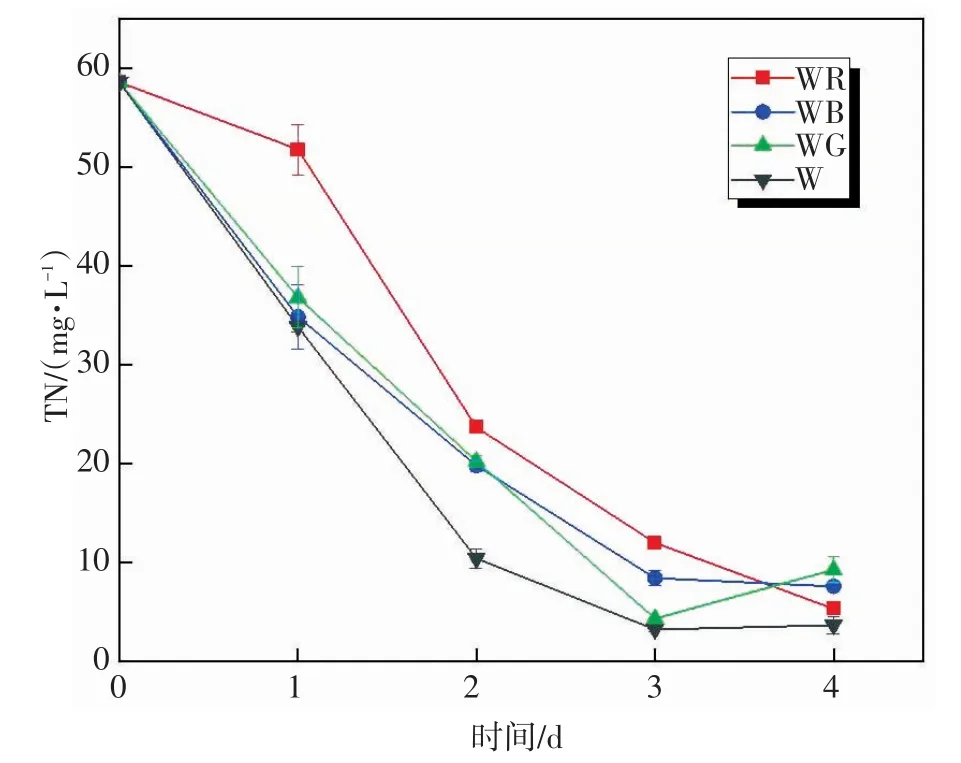
图5 不同补光下TN浓度随时间的变化Fig.5 Changes of TN concentration with different supplementary light over time
2.2.2 TP浓度变化
不同补光下蛋白核小球藻的TP浓度随时间的变化情况如图6所示。由图6可知,WR、WB和WG实验组的TP浓度由初始值10 mg/L分别降至1.06 mg/L、0.96 mg/L和1.08 mg/L,而W对照组TP浓度仅降到2.72 mg/L。WR、WB和WG实验组的TP去除率分别达到了89.4%、90.4%和89.2%,而W对照组的TP去除率为72.8%。表明补充红光、蓝光和绿光均能提高蛋白核小球藻的磷去除率。微藻对磷酸盐的吸收率受到光质的影响,并且蓝光可以提高微藻细胞对的吸收率[34]。另外,由于蓝光促进了微藻光合作用中酶(CA酶和Rubisco酶)的活性,提高了磷酸盐在微藻光合作用过程中被利用的速率,因而WB实验组磷的去除率高于WR和WG实验组。

图6 不同补光下TP浓度随时间的变化Fig.6 Changes of TP concentration with different supplementary light over time
从图6可知,前2 d的TP去除速率较高,这是因为高浓度磷促进蛋白核小球藻的短时间吸附和吸收,使其具有更高的磷吸收速率[35]。此外,相比于碳源和氮源,微藻细胞对磷源的需求量不大,微藻细胞对于磷吸附去除在于过量吸附,微藻细胞处理富含磷的污水后,细胞中的“磷库”储存充足并达到磷吸附饱和状态,因此,蛋白核小球藻处理污水的第2~3 d内磷浓度变化不大。微藻消耗细胞中储存的“磷库”进行细胞增殖后继续吸附磷,从而继续吸附/吸收污水中的磷酸盐,因此,在第4 d污水中的磷浓度有所下降。
3 结论
1)补充蓝光有利于蛋白核小球藻的生长,提高微藻生物量产率。WB实验组的比生长速率μ和生物量产率P分别为0.12/d和0.096 g/(L·d)。
2)补充绿光有利于蛋白核小球藻脂质积累。WG实验组蛋白核小球藻处理污水4 d后的脂质含量从初始时的20.16%提高到27.67%。
3)补光能提高蛋白核小球藻除磷效果。在WR、WB和WG光照条件下的磷去除率均比W对照组高;WB光照的TP去除率最高,达到90.4%。

