环丙沙星胁迫对小麦生理及代谢的影响
赵里曼,牟美睿,武丽娟,贲蓓倍,杨仁杰,刘海学
(1. 天津农学院农学与资源环境学院,天津 300384;2. 农业农村部环境保护科研监测所,天津 300191;3. 北京诺禾致源科技股份有限公司,天津 301700;4. 天津农学院工程技术学院,天津 300384)
【研究意义】近年来,抗生素被认为是环境中的一种新兴污染物,它在人类和兽药医学中被大量使用,并在环境中持续存在[1-2]。抗生素不能被生物充分代谢且不易降解,会对生物产生不良反应[3]。通过植物性食物或动物有助于抗生素在食物链中的运输[2],人们通过长期摄取暴露于低浓度抗生素的食品,会对人体健康产生负面的影响。环丙沙星是喹诺酮类抗生素的代表,抗菌谱广,杀菌力强[4]。环境调查显示,喹诺酮类抗生素在土壤、地表水和动植物体内等多种环境介质中都有检出[5-7]。因此,抗生素的吸收和累积以及对人类的健康威胁亟待人们的重视。【前人研究进展】不同类型作物对抗生素的敏感性明显不同,Jin等[8]以小麦、大白菜和番茄3种作物为实验材料,发现根和茎伸长的敏感性具有显著差异。顾国平和章明奎[9]研究发现,土霉素对水稻地上部分的影响明显小于地下部分, 且低浓度土霉素处理可促进水稻根表面积和根系总长的增加,高浓度土霉素会对水稻幼苗产生毒害作用,限制水稻幼苗正常生长。言青云等[10]发现不同浓度环丙沙星胁迫条件下,高积累菜心根部及地上部的可溶性蛋白质含量、SOD及POD活性总体大于低积累菜心,对CIP的耐受能力更较强。张天盈等[11]研究表明低浓度的磺胺二甲嘧啶和环丙沙星能够促进小麦籽粒根和芽的生长,但达到抑制临界浓度后会抑制小麦籽粒的根长生长。【本研究切入点】目前,有关抗生素在植物食品中的残留和富集的研究多集中在生长及生理的影响上,但其对代谢组学的影响鲜见报道。代谢组学是植物生物技术领域中发展迅速的一门学科,随着代谢组学数据采集分析工具的进步,代谢组学数据可以覆盖整个植物代谢组[12]。植物具有对各种逆境的防御机制,能够适应不利的环境,利用代谢组学方法研究防御反应有助于全面理解植物对逆境胁迫的响应[13-14]。【拟解决的关键问题】本研究以小麦‘百农207’幼苗作为试验材料,从植物的生理和代谢方面分析环丙沙星对小麦的影响,使小麦耐性品种的研究得到进一步完善,该研究对农产品的安全生产和人类健康具有重要意义。
1 材料与方法
1.1 试验材料
本试验选用‘百农207’小麦品种,由天津农学院农业分析测试中心提供。选取健康饱满的小麦种子,晒种一天后用5% NaClO 溶液浸泡20 min消毒,并用超纯水大量冲洗至无味后浸泡一晚。将吸胀的种子沟腹向下,均匀放置于发芽盒密网盘上。用蒸馏水培养5 d后,更换为Hoagland营养液。待幼苗长至两叶一心时,从中筛选出长势一致的麦苗,将其分为对照组和处理组,以不添加CIP的Hoagland营养液培养设置为对照组(0 mg/L,CK),处理组CIP梯度设定为5、10、25、50、100、200 mg/L。连续5 d培养后结束处理,收集小麦幼苗,洗净、吸干水分后进行生理指标及代谢物的测定。材料培养全程于天津农学院农学实验教学中心实验室人工气候箱中进行,设置(23±1)℃恒温,每日光照时间为12 h。所有试验共进行3个重复,每个重复以10~20个植株为样本。
1.2 试验方法
1.2.1 生理指标测定 叶绿素含量采用丙酮、无水乙醇混合浸提法[15]测定。超氧化物歧化酶(Superoxide dismutase,SOD)活性采用氮蓝四唑光化还原法[16]测定,过氧化氢酶(Catalase,CAT)活性采用分光光度法[16]测定,过氧化物酶(Peroxidase,POD)活性采用愈创木酚法[16]测定。丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸显色法[16]测定。
1.2.2 代谢物提取和鉴定 萃取衍生化:小麦叶片样本经液氮研磨后,取150 mg于2 mL离心管里,加入1 mL体积比为1∶1∶1的乙腈-异丙醇-水提取剂,40 kHz超声波提取,在4 ℃下持续35 min。再将样本离心1 min(4 ℃,10 000 r/min),移取150 μL上清液至2 mL离心管,在11 ℃下使用全自动氮吹仪将提取物吹干。紧接着向每个样品中加入10 μL衍生试剂(盐酸甲氧胺-吡啶混合溶液),充分摇匀混合后于30 ℃恒温水浴锅中衍生90 min;然后加入30 μL 衍生试剂[N-甲基N-(三甲基硅烷基)三氟乙酰胺]+1%三甲基氯硅烷,37 ℃恒温水浴锅中衍生30 min,衍生过程中摇晃3次,使提取液衍生完全。最后加入1 mL正庚烷溶剂(内含20 μg/mL的内标物十一烷),过0.22 μm滤膜后转入进样瓶,上机测定。
上机检测:气相分析衍生提取物用7890A-5975C型气相色谱质谱联用仪分析。色谱条件:采用HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样量 0.5 μL,不分流进样;氦气作为载气,并设定压力,使氦气流量保持在64 mL/min的恒定流速。溶剂延迟:270 s。升温程序:初始温度设置为60 ℃,保持1 min,以10 ℃/min提高到280 ℃后保持5 min。质谱条件:四级杆温度设置为150 ℃,离子源温度设置为230 ℃;电离电压:70 eV;扫描方式(全扫描):50~500 m/z;扫描速度:2 scan/s。
1.2.3 数据处理与分析 结果建立在至少3组独立试验基础之上,生理指标数据经Microsoft Office Excel 2007对数据进行计算后,采用Graphpad Prism 8 软件进行统计分析和绘图;代谢组学原始数据经Agilent-MassHunter工作站进行特征提取后,通过Microsoft Office Excel 2007对数据进行定性和定量分析,采用SIMCA-P 14.1软件进行多元统计(PCA和OPLS-DA)分析和差异代谢物筛选,通过MetaboAnalyst 5.0 平台对差异代谢物进行通路分析。
2 结果与分析
2.1 CIP对小麦生理指标的影响
2.1.1 CIP对小麦叶绿素含量的影响 如图1所示,随着CIP浓度的升高,小麦幼苗叶片叶绿素a、类胡萝卜素和总叶绿素含量呈先升后降的变化趋势,叶绿素b含量呈逐渐降低趋势。5 mg/L时CIP胁迫下小麦幼苗叶片叶绿素a、类胡萝卜和总叶绿素素含量最高,较对照分别提高2.7%、3.0%和0.7%(P>0.01)。50~200 mg/L CIP胁迫使小麦幼苗叶片叶绿素a和叶绿素b含量极显著降低,较对照分别降低15.8%、20.1%、22.9%和29.9%、40.1%、45.0%(P<0.01);25~200 mg/L CIP胁迫极使小麦幼苗叶片总叶绿素含量极显著降低,较对照分别降低7.8%、19.1%、24.7%和28.0%(P<0.01);25~100 mg/L CIP胁迫使小麦幼苗叶片类胡萝卜素含量显著降低,200 mg/L时含量最低,较对照降低12.2%(P<0.01),达到极显著水平。
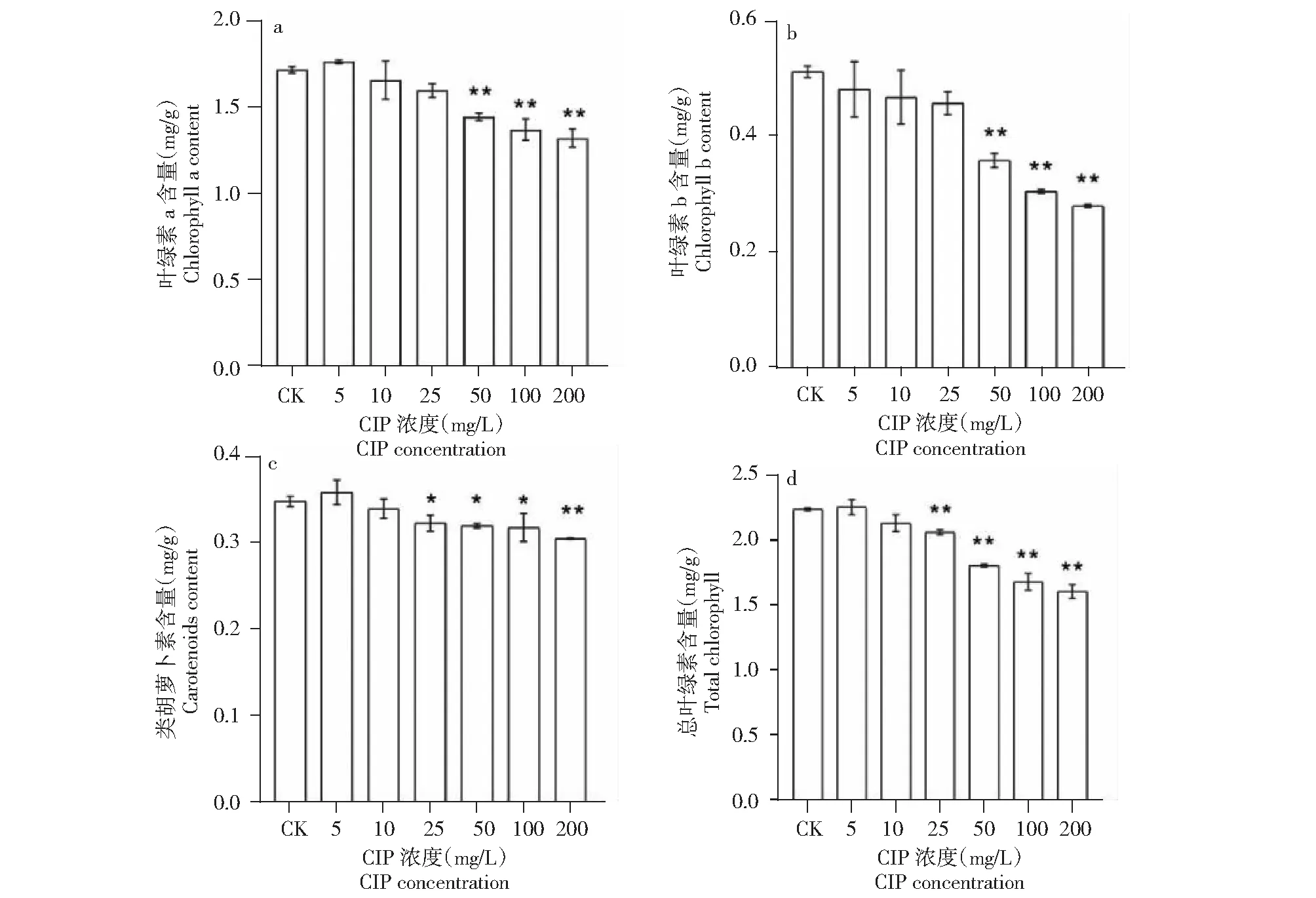
*表示处理与对照间差异显著(P<0.05),**表示处理与对照间差异极显著(P<0.01),下同
2.1.2 CIP对小麦抗氧化系统的影响 如图2所示,随着CIP浓度的增加,小麦幼苗叶片POD活性降低,200 mg/L CIP胁迫下小麦幼苗叶片POD活性降低13.9%(P<0.05)。小麦幼苗叶片的CAT和SOD活性呈先升高后下降的变化趋势。在10 mg/L CIP胁迫下CAT活性达到最高,较对照组增加89.52%(P<0.01)。在50 mg/L CIP胁迫下SOD活性达到最高,较对照增加37.77%(P<0.01),5、10、25、200 mg/L CIP胁迫下处理与对照间SOD活性差异不显著(P>0.05)。随着CIP浓度的增加,麦幼苗叶片的MDA含量呈先上升后降低的变化趋势。5~25 mg/L CIP胁迫使MDA含量极显著增加,其分别较对照增加40.26%、178.28%和147.46%(P<0.01),100~200 mg/L CIP胁迫则降低了MDA含量,较对照下降8.51%和15.06%。MDA含量在10 mg/L CIP胁迫下达到最高。
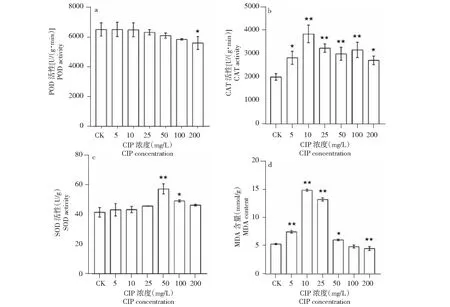
图2 CIP胁迫对小麦幼苗抗氧化系统的影响
2.2 CIP胁迫下小麦代谢物定性分析
对CIP胁迫下小麦幼苗样品的GC-MS总离子流图进行预处理后,通过NIST商业数据库进行谱库比对,结合各代谢物的保留时间和峰面积,确定各代谢物衍生化后的分子式和含量。结果共鉴定出代谢物55个(表1),包括有机酸16种、氨基酸14种、糖类化合物10种、多元醇3种和其他物质12种,分别占总代谢物个数的29.1%、25.5%、18.2%、5.5%和21.8%。

表1 经GC-MS鉴定出的小麦幼苗代谢物
2.3 CIP胁迫下小麦代谢组学的PCA分析
通过SIMCA-P 14.1软件的主成分分析 (Principal component analysis, PCA) 进行无监督识别,以确定一般的代谢趋势和可能的异常值[17]。PCA得分图表示了每个样本在主成分空间中的相对位置,并通过样本特征的线性组合使所有样本之间的方差最大化,揭示了相似样本的聚类和具有不同特征的个体样本(离群值)[18]。PCA结果中提取前3个主成分,贡献率分别为39%、18%和12%,绘制三维得分图(图3)。所有样本都在95%置信区间的Hotelling’s T2 椭圆内,每组的3次重复聚在一起,表明实验重复性较好。不同处理聚为不同的簇,说明各组间的整体的代谢物质呈现出一定程度的差异性。
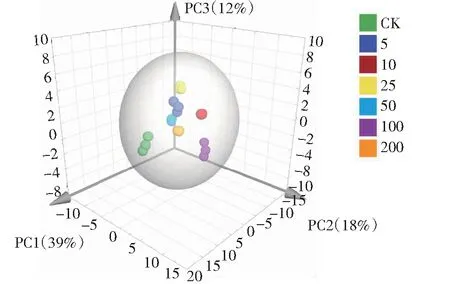
图3 CIP胁迫下小麦幼苗主成分三维得分
2.4 CIP胁迫下小麦代谢组学PLS-DA分析
由于PCA分析对于相关性较小的变量不敏感,且无法消除与研究目的无关的随机误差和组内误差,可通过偏最小二乘判别分析(Partial least squares discriminant analysis, PLS-DA)对不同处理组小麦幼苗代谢物进行分析。PLS-DA得分图(图4)显示高CIP胁迫处理组(浓度>10 mg/L)和低CIP胁迫处理组(浓度≤10 mg/L)被分布在PC1左右两侧,说明小麦叶片受到不同浓度环丙沙星胁迫后,代谢物质发生显著性变化。为验证PLS-DA模型是否过拟合,对模型进行n=200的置换检验,其中R2和Q2表示拟合优度系数(建模有效性得分值R2=0.88,Q2=0.46)。如图4所示,置换检验图中R2和Q2左边的点都低于最右边的点,且直线斜率都大于1,说明模型可靠,可用于差异代谢物的筛选。
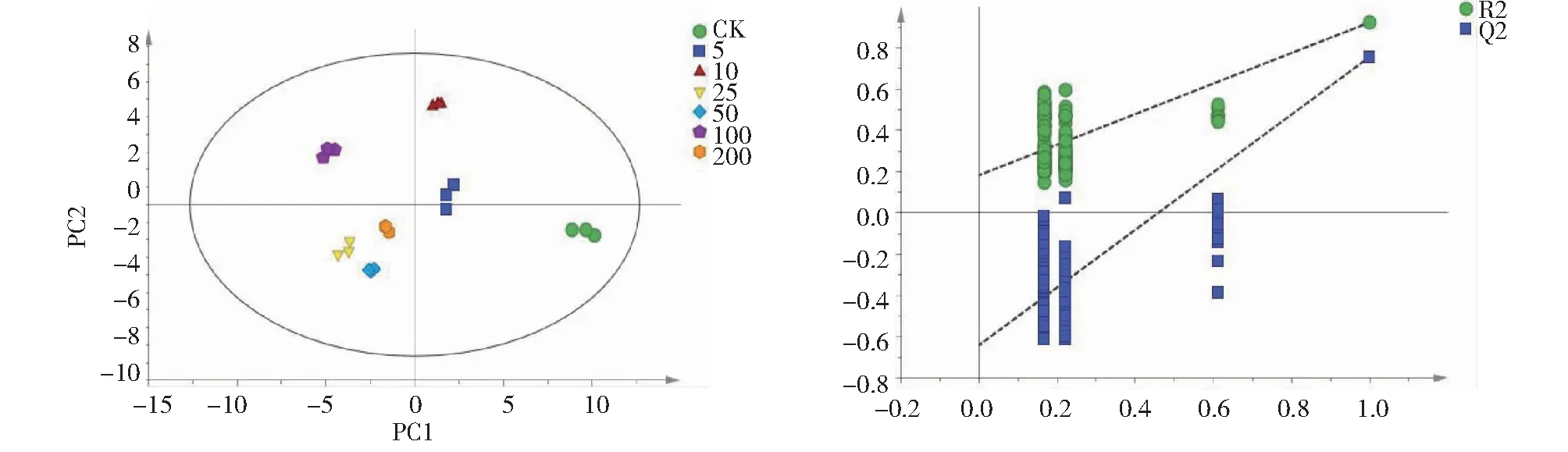
图4 不同CIP处理下小麦幼苗代谢物PLS-DA得分及置换检验
2.5 CIP胁迫下小麦差异代谢物及代谢通路分析
对GC-MS检测的55种代谢物,通过PLS-DA分析中得到的VIP值结合单因素方差分析的P值(VIP>1,P<0.05),共筛选出10种差异代谢物(表2)。包括4种氨基酸及其衍生物(甘氨酸、谷氨酰胺、L-天冬酰胺、L-丙氨酸)、2种有机酸(2-丙酸、2-戊烯酸)、2种糖类及其衍生物(塔洛糖、阿拉伯糖)和2种其他有机物(苯酚、2-吡咯烷酮)。氨基酸及其衍生物占40%,比重最大。其中差异最明显的为L-天冬酰胺,各处理组倍数变化在1.5~5.8,可见不同CIP浓度胁迫下小麦幼苗中相同代谢物的代谢水平上有明显差异,氨基酸类为小麦幼苗响应CIP的关键代谢物。此外, 利用MetaboAnalyst 5.0 平台对差异代谢物进行代谢通路分析,得到13条代谢通路,其中显著变化的有5条通路(P<0.05或Impact>0.2,图5),5条通路分别为:甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,乙醛酸和二羧酸代谢,氰基氨基酸代谢,氨酰-tRNA生物合成。

图5 差异代谢物通路影响因子
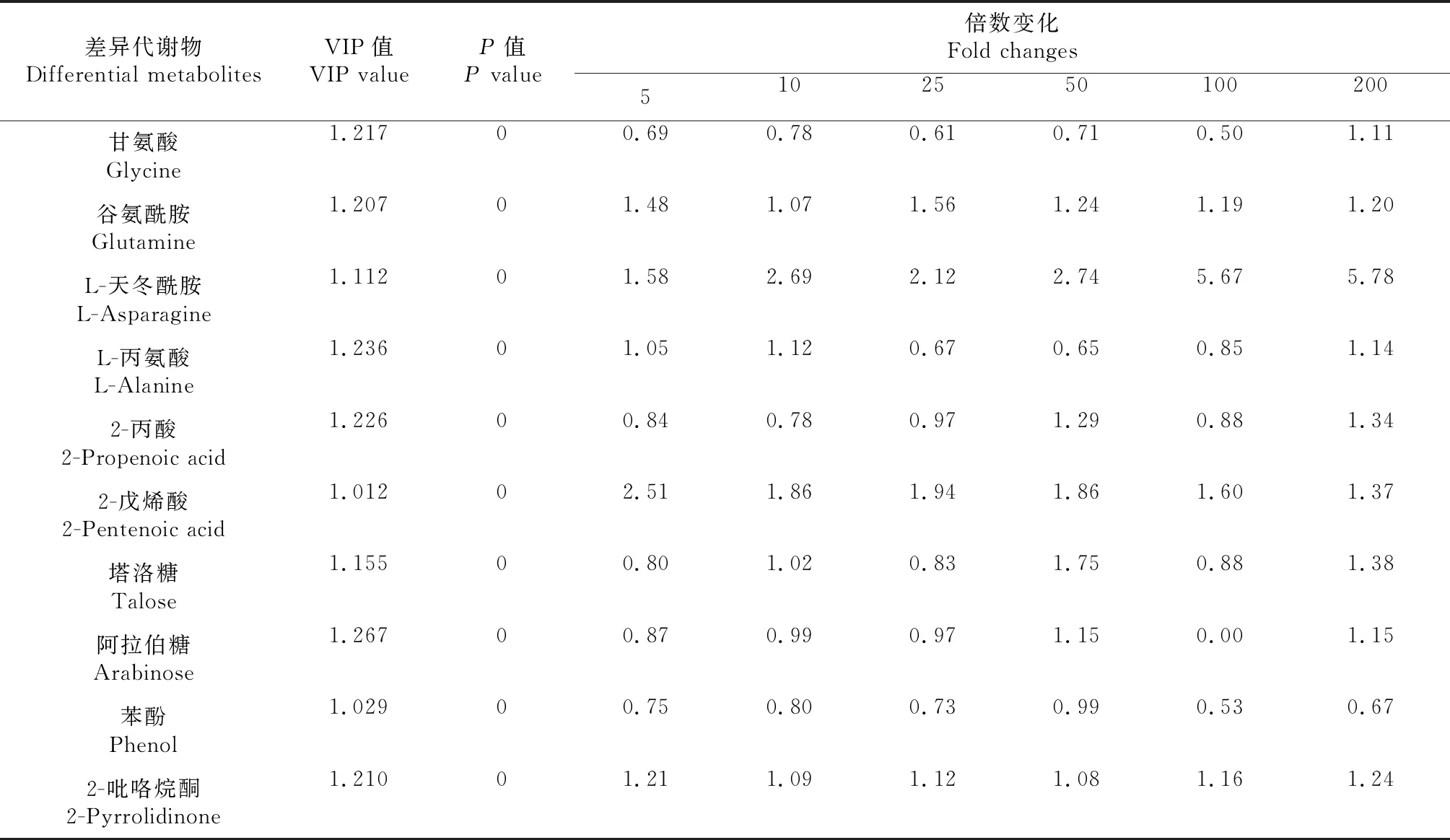
表2 CIP胁迫下小麦幼苗中的差异代谢物
3 讨 论
3.1 CIP对小麦幼苗生理的影响
光合作用是所有绿色植物的重要生理过程,叶绿素是参与光合作用中光能吸收、传递和转化的重要光合色素,植物叶绿素含量是评价光合活性的一个重要参数[19]。从本试验结果可以看出,低浓度抗生素胁迫对小麦幼苗叶片叶绿素未造成明显破坏,但是当抗生素浓度超过25 mg/L后,小麦幼苗的各叶绿素组分及总叶绿素含量均明显降低。这可能是由于高浓度抗生素可以通过抑制细胞内蛋白质的合成而抑制叶绿素的合成,同时对叶绿素合成过程中的关键酶类产生抑制,进而影响叶绿素的合成。Rydzyński等[20]研究了在含镉和四环素土壤中生长的菠菜叶片中叶绿素的降解,结果表明植物暴露于最高水平的四环素和最高水平的镉,叶绿素含量分别降低64%和68%,叶绿素降解速率常数随四环素和镉浓度的增加而增加。廖德润等[21]考察了土霉素、磺胺二甲基晓啶和环丙沙星3种兽用抗生素对空心菜叶绿素含量的影响,发现抗生素浓度低于100 μg/L处理的空心菜叶片中叶绿素含量没有显著变化,但抗生素浓度高于100 μg/L的处理中,叶绿素含量显著下降。SOD、POD和CAT是与植物抗氧化应激相关的重要酶[22],有助于消除外部环境胁迫引起的氧化干扰,属于活性氢清除剂。本试验结果可以看出,各处理组POD活性值降低但不显著,CAT和SOD活性呈先上升后下降的变化趋势,CAT的变化趋势更明显。整体上看POD和SOD活性对抗生素环丙沙星的影响作用弱于CAT活性。不同的环境逆境中,抗氧化酶的响应存在差异[21]。在抗生素环丙沙星的胁迫下,3种抗氧化酶敏感度由强到弱依次为:CAT>SOD>POD。
以往的研究表明,高浓度抗生素会导致植物产生过量自由基,若超出植物产生的抗氧化酶清除能力,甚至会引起植物体组织细胞损伤[23-24]。张天莹[25]通过抗生素磺胺二甲基嘧啶(SM2)对小麦的生态毒性研究,发现SM2处理组在低浓度条件下,抗氧化酶受到刺激而活性增强,但随着SM2浓度的增大,小麦叶片中SOD活性不断增强,POD与CAT活性受到抑制。朱健等[26]试验表明盐酸左氧氟沙星浸种后玉米种子中抗氧化酶活性表现出“低促高抑”现象。除了上面提到的抗氧化酶,植物还可能有其他的酶或非酶机制来耐受环丙沙星胁迫。此外,MDA是氧化应激的另一个主要指标[27]。王朋等[28]以玉米幼苗为研究对象,发现 MDA活性在低浓度CIP处理下被激发而在高浓度CIP处理下被抑制。说明在低浓度胁迫下,植物可以启动良好的防御措施,抵御外来伤害。植物通过体中MDA的含量,防止细胞结构受到破坏,从而对植物的伤害起到自我保护作用。但胁迫浓度升高,对植物的伤害则加强,植物本身的应激系统下降,植物毒害严重。因此,本研究通过分析不同CIP浓度胁迫下小麦幼苗生理的影响发现,小麦会通过提高叶绿素、MDA含量,以及提高保护酶CAT和SOD的活性来忍耐CIP胁迫的伤害。
3.2 CIP对小麦幼苗代谢物及代谢途径的影响
本研究结果显示CIP胁迫确实诱导小麦体内代谢物发生了显著变化,且代谢物变化与环丙沙星浓度有关。经过筛选共检测出55种代谢物,其中差异显著的代谢物有10种,包括氨基酸4种、有机酸2种、糖类2种和其他有机物2种。筛选共检测出13条代谢通路,其中显著变化的有5条,主要通过甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,乙醛酸和二羧酸代谢,氰基氨基酸代谢和氨酰-tRNA生物合成来抵御胁迫,保持植物的正常生理活动。在环丙沙星胁迫下小麦代谢产物涉及的主要是氨基酸代谢和有机酸代谢过程。
氨基酸对压力胁迫下植株的抗性具有重要的作用[29]。王晓丽等[30]研究发现,盐胁迫能促进酸枣幼苗体内游离氨基酸的累积,通过渗透物质来减轻盐害,维持酸枣幼苗的正常生长。本试验中,显著变化途径中有4条是氨基酸相关的代谢途径,表示小麦幼苗在CIP胁迫时氨基酸活动较为活跃,是响应CIP胁迫的重要调节物质,其中氨酰-tRNA的生物合成途径最为显著。氨酰-tRNA合成酶是生物体蛋白质合成途径中的关键酶[31],表示小麦幼苗在CIP胁迫时蛋白质合成也比较活跃。在逆境环境中,可产生逆境诱导蛋白来提高植物的耐胁迫能力,对植物逆境适应产生保护[32]。有机酸在植物能量代谢和抗逆过程中起着重要作用。本试验中,乙醛酸和二羧酸代谢为机体提供能量,促进植物生长发育。因此,氨基酸类代谢物为小麦幼苗响应CIP的关键代谢物,代谢通路中氨基酸相关通路占比较大,说明通过氨基酸代谢途径研究CIP对小麦幼苗代谢物的影响具有可行性,可为进一步探究代谢机理提供理论基础。
4 结 论
本研究通过对‘百农207’小麦品种,从生理和代谢组学两个层面探究小麦在不同浓度CIP胁迫下的差异性。生理层面,在CIP胁迫条件下小麦会通过提高叶绿素、MDA含量以及提高保护酶CAT和SOD的活性来忍耐CIP胁迫的伤害;代谢组学层面,氨基酸类代谢物为小麦幼苗响应CIP的关键代谢物。本研究结果可为探究小麦响应CIP提供理论依据。

