南大洋浮游细菌群落结构研究进展
孙玉蓉 马玉欣 曹叔楠 罗光富 蓝木盛 何剑锋,4,5
研究进展
南大洋浮游细菌群落结构研究进展
孙玉蓉1,2马玉欣3,4,1曹叔楠2,3罗光富2,3蓝木盛2,3何剑锋2,3,4,5
(1上海海洋大学海洋科学学院, 上海 201306;2南极长城极地生态国家科学观测研究站, 中国极地研究中心, 上海 200136;3自然资源部极地科学重点实验室, 中国极地研究中心, 上海 200136;4上海交通大学海洋学院, 上海 200030;5同济大学环境科学与工程学院, 上海 200092)
浮游细菌是海洋微食物环的重要组成部分, 在维持海洋生态系统稳定和物质循环中起着重要作用。本文对南大洋浮游细菌群落组成和分布特征以及影响因素进行概述, 结果显示, 优势类群为α-变形菌纲、γ-变形菌纲和噬纤维菌-屈挠杆菌-拟杆菌群, 非优势类群组成则存在显著的空间差异。浮游细菌群落存在明显的季节变化, 温度和溶解有机碳浓度是调控群落结构的主要环境因子, 浮游细菌与微食物环其他类群存在明显的相互作用。气候变化导致的海洋升温、海洋酸化等环境变化会对浮游细菌产生深远影响。未来应加强对极地上层海洋与海冰相关浮游细菌群落和深海浮游细菌群落的研究, 依托站基开展季节变化的现场调查和模式研究, 预测南大洋浮游细菌群落的潜在变化趋势及调控机理。
南大洋 浮游细菌 群落组成 季节变化 环境因子
0 引言
海洋浮游细菌是海洋微食物环的重要组成部分, 具有极强的有机物摄入能力[1], 是海洋物质循环的重要一环[2-4], 而碳、氮等物质的生物地球化学循环在维持海洋生态系统稳定和影响全球气候变化中起着重要作用[5-7]。对南大洋的研究同样显示, 微食物环是南极海域碳和能量流动的重要途径[8]。
海洋浮游细菌群落中, 变形菌门的a-变形菌纲和γ-变形菌纲在生物量和多样性上均占优势, 而拟杆菌门也具有较高的生物多样性[9-10]。南大洋浮游细菌、特别是海洋表层浮游细菌群落, 具有明显的区域特异性[11]。尽管相较于其他海域, 南大洋和北冰洋的浮游细菌群落结构较为相近[12], 但有研究表明, 南大洋表层特有分类单元(Operational Taxonomic Units, OTUs)比例高达78%[13]。
近年来, 随着南大洋局域升温、混合加剧、海冰覆盖面积波动和淡水输入增加等环境变化, 南大洋生态系统得到了更多的关注, 对浮游细菌群落组成、空间分布、季节变化和环境调控机理等也进行了更多的研究[14-17], 但与低纬度海域的研究强度相比仍有较大的差距。我国对南大洋浮游细菌的研究极为有限[17-19]。本文对南大洋浮游细菌群落结构的最新研究进行总结, 分析其时空分布和季节变化特征, 并对今后该领域的研究进行了展望, 以期可以推进我国的相关研究。
1 南大洋浮游细菌优势类群
南大洋上表层海域浮游细菌的优势类群为α-变形菌纲、γ-变形菌纲和噬纤维菌-屈挠杆菌-拟杆菌群(Cytophaga-Flexibacter-Bacteroides, CFB), 中深层优势类群则以γ-变形菌纲为主[20-21], 不同海域优势类群详见表1。其中,a-变形菌纲又以SAR11类群占优[22]。该类群在开阔大洋和近岸水域都具有较高的丰度[20], 但垂向分布上在真光层相对较高, 水平分布上在亚南极和极地锋附近海域的丰度相对较高[23]。a-变形菌纲中另一个常见的类群为玫瑰杆菌属, 但其所占的比例要低于全球其他海域[10,24]。a-变形菌纲中的SAR116类群在全球海洋中均有分布, 在亚南极和南极浮游细菌丰度较低的海域也检测到了该类群[10]。
南大洋中, γ-变形菌纲丰度很高, 其中SAR86类群是南极表层海水中的主要类群[25]。该类群可以代谢脂类和碳水化合物, 并且与SAR11类群具有不同的碳水化合物代谢途径, 因而两者的竞争性很小[9]。CFB在南大洋分布较广, 其占比的高低与浮游植物水华出现与否密切相关[24], 其中拟杆菌中的黄杆菌属细菌也是颗粒物附着菌的主要类群[26-27]。
β-变形菌纲占比较低但分布广泛, δ-变形菌纲主要存在于深层海水中[28-29], 而蓝细菌类群主要出现在亚南极水域[25,30]。其他出现的类群包括疣微菌门、浮霉菌门和放线菌门等。
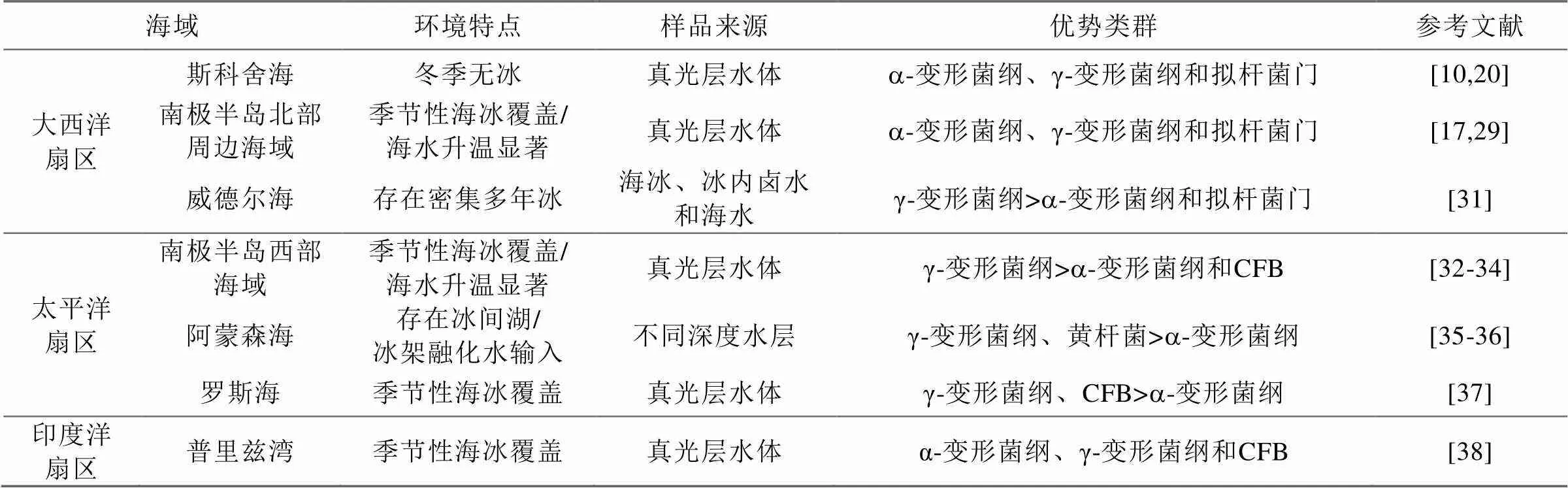
表1 南大洋不同海域浮游细菌优势类群组成
2 南大洋浮游细菌空间分布
2.1 大西洋扇区
斯科舍弧邻近海域表层海水浮游细菌优势类群为α-变形菌纲、γ-变形菌纲和噬纤维菌-屈挠杆菌-拟杆菌群(Cytophaga-Flexibacter-Bacteroides, CFB), 不同站位间优势类群组成较为一致, 但稀有类群组成存在明显差异[20]。斯科舍海a-变形菌纲占比最高, 其次为γ-变形菌纲和鞘脂杆菌纲/黄杆菌纲[10]。其中,a-变形菌纲主要包括SAR11类群、玫瑰杆菌属和SAR116类群, γ-变形菌纲主要为SAR86类群。
南设得兰群岛乔治王岛珀特湾浮游细菌的优势类群为变形菌门, 其次是杆菌门和放线菌门[15]。对该地区智利湾的研究则表明, 其优势类群为变形菌门和杆菌门, 浮游植物水华期间较为常见的类群有α-变形菌纲中的玫瑰杆菌属、远洋杆菌属和属以及γ-变形菌门中的交替单胞菌属、海杆菌属、交替假单胞菌属和海洋螺菌科[39]。
南极半岛北端邻近海域浮游细菌群落包括变形菌门、拟杆菌门、蓝细菌门、放线菌门、浮霉菌门和疣微菌门细菌。其中a-变形菌纲, γ-变形菌纲和拟杆菌门为优势类群[18]。对威德尔海冰缘区的研究表明, 浮冰内部和冰下海水中的细菌群落存在明显差异。冰下海水中的可培养细菌以非发酵的革兰氏阴性杆菌为主, 而部分海水细菌群落中, γ-变形菌纲可占到 25%以上[31]。
2.2 太平洋扇区
从澳大利亚霍巴特到东南极默茨冰川断面的调查表明, 极地锋以北和以南浮游细菌群落组成存在明显差异。极地锋以北海域优势类群为SAR11/SAR116和蓝细菌门, 而以南则为γ-变形菌纲、杆菌门、疣微菌门和红细菌目[28]。
布兰斯菲尔德海峡浮游细菌优势类群为γ-变形菌纲和拟杆菌门, 其他包括α-变形菌纲、δ-变形菌纲和SAR406类群等。其中, γ-变形菌纲主要包括海洋螺菌目、弧菌目和交替单胞菌目, 拟杆菌门主要包括黄杆菌目, 而α-变形菌纲主要包括红细菌目[32]。
南极半岛美国帕尔默站近岸海域浮游细菌主要类群包括: γ-变形菌纲、α-变形菌纲、δ-变形菌纲和拟杆菌门, 其中γ-变形菌纲在冬季占有优势[33]; 该海域另有研究表明, 浮游细菌以γ-变形菌纲为优势类群, 占比为47%~53%, α-变形菌纲占22%~27%, 而拟杆菌占比为8%~17%, 其他类群占比不足6%[28]。而对南极半岛英国罗瑟拉站附近瑞德湾的研究显示, 其浮游细菌类群包括γ-变形菌纲、β-变形菌纲、α-变形菌纲、放线菌门和CFB簇群[34]。
阿蒙森海是南大洋太平洋扇区重要的边缘海之一, 也是近年来我国新开辟的调查海域[40]。研究表明, 冰间湖表层海水优势类群为黄杆菌门的极杆菌属和γ-变形菌纲海洋螺菌科的巴氏发菌属, 深层的优势类群为a-变形菌纲的远洋杆菌属[35-36]。
罗斯海近岸海域浮游细菌优势类群为γ-变形菌纲和 CFB, 与海冰细菌优势类群类似[37]。
2.3 印度洋扇区
普里兹湾浮游细菌优势类群主要包括CFB类群、γ-变形菌纲和α-变形菌纲细菌, 其他类群包括δ-变形菌纲、疣微菌目、浮霉菌门、芽单胞菌门和一个分类地位未定类群ANT4E12[38]。另有研究显示, 夏季普里兹湾达恩利角附近海域可培养细菌分属α-变形菌纲、γ-变形菌纲和拟杆菌门3个类群下的35个不同分类单元, 其中α-变形菌纲为优势类群[41]。亚南极凯尔盖朗群岛近岸海域中, α-变形菌纲为最优势类群(33%~38%), 其次是β-变形菌纲和γ-变形菌纲[29]。
3 南大洋浮游细菌季节性演替
受极昼/极夜交替和海冰生消的影响, 南大洋浮游细菌群落结构存在明显的季节变化特征[33,38]。研究显示, 南极半岛近岸海域浮游细菌丰富度在冬季要明显高于夏季, 细菌属的数量在冬季要高出夏季时的3倍以上, 其中隶属γ-变形菌纲的属的数量在冬季为21个、夏季仅有7个[33]。
对南极半岛和凯尔盖朗群岛近岸海域浮游细菌一整年的研究表明, 全年最优势类群为γ-变形菌纲, 其中夏季优势亚群为Ant4D3、冬季则为Ant10A4, 拟杆菌门黄杆菌纲丰富度在夏季明显高于冬季, 而δ-变形菌和脱铁杆菌门仅在冬季被检测到[29]。
普里兹湾浮游细菌优势类群呈现明显的季节变化, 其中春初浮游细菌群落主要由CFB类群、γ-变形菌纲和α-变形菌纲细菌组成, 但春末夏初随着春季浮游植物水华形成, CFB类群开始占据主导地位[38]。
总体而言, 冬季浮游细菌表现出更高的系统发育多样性和功能潜力, 同时夏季细菌的代谢主要为化学异养、光合异养和好氧不产氧光合作用, 而冬季则具备化能无机自养能力[20,33]。
4 南大洋不同水团的浮游细菌
就空间分布而言, 上表层和中深层生态系统可能具有两种不同的微生物群落发育和维持机制。上表层浮游细菌以变形菌门、拟杆菌门和蓝细菌门为优势类群, 由于易受短期环境变化的影响, 不同站位浮游细菌群落结构存在显著差异。随着深度的增加, 蓝细菌门和a-变形菌纲相对丰度减少, γ-变形菌纲相对丰度增加。中深层受较长周期的水团驻留和较为稳定的环境影响, 群落结构较为一致, γ-变形菌等为优势类群[12]。相比上表层浮游细菌群落, 中深层水团中的黄杆菌比例较低, 且检测出未分类细菌序列的比例较高。
对阿蒙森海冰间湖浮游细菌的研究表明, 表层生物多样性相对较低, 以富营养型类群占据优势, 而中深层水团中多样性较高, 以寡营养型类群占据优势[35]。从表层到深层, 南极表层水、冬季残留水、绕极深层水中的浮游细菌群落结构存在明显差异: 表层水中的多样性低, 优势类群为黄杆菌科极杆菌属以及海洋螺菌科海洋螺菌属; 冬季残留水和绕极深层水中浮游细菌群落的主要差别是优势类群占比不同, 并且绕极深层水中含有其他两个水团少有的丰富类群[35]。
水文过程同样会影响浮游细菌的群落结构。对南极半岛英国罗瑟拉站附近瑞德湾浮游细菌的研究表明, 在春夏季上层跃层被逐步混合的过程中, 浮游植物优势藻种从辐环藻属种转变为海链藻属种, 数天后, 浮游细菌优势类群从α-变形菌纲和γ-变形菌纲更替为CFB簇群[34]。南大洋海冰冻结可以产生高盐冷水团并下沉到海底, 形成温度、盐度和溶解氧等环境要素的垂直梯度, 导致浮游细菌群落呈明显的垂直分布模式[12]。另有研究表明, 对浮游细菌群落结构的影响, 除环境和距离效应外, 对流可以长距离输运浮游细菌并使其可能在新的环境下生长形成优势[28]。
5 南大洋浮游细菌群落结构调控因子
5.1 环境因子
5.1.1 光照
光照可直接影响部分细菌类群, 除蓝细菌的典型产氧光合作用外, 部分类群的光合营养可通过好氧不产氧光合作用(如红细菌科)或依托细菌视紫红质富集能量(如极杆菌属、SAR11以及部分γ-变形菌纲种类)[42-43], 加上部分异养种群生长存在光抑制现象, 夏季光照显著增强会改变海洋表层浮游细菌的群落结构。南大洋相关研究有限。对阿蒙森海浮游细菌群落的模拟实验表明, 光照和对有机营养物质的竞争力是调控浮游细菌群落结构的关键因子[35]。但实验研究同时表明, 春季较强的紫外辐射对群落结构的影响并不显著[38]。
5.1.2 温度和盐度
温度和盐度是影响微生物群落结构的重要因子[17]。海水温度直接影响细菌的新陈代谢能力, 同时通过影响浮游植物初级生产和光合作用过程中溶解有机质(Dissolved Organic Matter, DOM)的释放间接影响细菌生产力。对斯科舍海的调查显示, 温度是影响浮游细菌群落结构的第一影响因子[12]。模式研究则显示, 全球变化导致表层海水升温, 在21世纪后半叶对浮游细菌和古菌的影响是显著而持续的[16]。
(9)Property Rules,Liability Rules,and Inalienability:One Viewof the Cathedral.
夏季近岸海域受到冰雪融化水注入的影响, 表层海水盐度明显下降。对西南极南设得兰群岛乔治王岛珀特湾为期1年的研究表明, 盐度、温度和颗粒物是影响群落结构的主要环境因子[15]。该湾在夏季时的浮游细菌群落结构与河口附近的沿海地区类似, 而秋冬季的群落结构则更接近于大洋水域, 表明浮游细菌群落的结构受到盐度的强烈制约[15]。
对南极的研究表明, 寒冷环境可能会提高浮游细菌的生物多样性。对普里兹湾近岸海域的研究表明, 冰区浮游细菌具有相对较高的生物多样性[37]。而对亚南极凯尔盖朗群岛和南极半岛近海海域的研究同样显示, 冬季的浮游细菌多样性更高, 其OTUs数量比全年其他季节的要多出约60%[29]。
5.1.3 海冰与淡水输入
海冰内部存在着一个有别于海水的特殊微生物区系[31,44]。海冰融化会导致生长在其中的微生物释放至表层海水, 从而影响表层海水浮游细菌群落结构。对罗斯海西海岸近岸海域表层海水浮游细菌的研究显示, γ-变形菌纲和拟杆菌门占优, 其中变形菌纲中的优势类群为杆嗜冷菌和嗜冷杆菌属, 拟杆菌门的优势类群为极杆菌属和弯杆菌属, 这些类群与海冰密切相关[37]。
对冰山追踪和实验研究显示, 冰山漂移导致的水体混合和营养状况改变, 会影响海洋浮游细菌群落的活性、组成以及物质利用能力[14]。气温上升导致冰山数量的增加, 可以影响局域碳和营养物质的生物地球化学循环。而夏季陆上冰雪融化导致淡水输入近岸海域, 会把陆上细菌带入海洋, 同样会影响表层浮游细菌群落结构。罗斯海西海岸罗德湾表层海水中发现的β-变形菌和ε-变形菌与沉积和淡水相关, 推测与附近意大利站的人类活动有关[37]。
5.1.4 其他
对南大洋25个主要水团的研究显示, 即使在环境要素和空间分割受控的情况下, 水团对流距离与微生物种类组成差异性存在正相关, 表明“对流效应”是塑造微生物群落结构的一个因素[45]。
对罗斯海表层海水浮游细菌的酸化实验结果显示, 海水pH下降会提高细胞的酶活性, 加速碳水化合物和脂肪的降解以及磷酸盐的再循环, 导致细菌丰度增加和多样性下降[46]。而对阿蒙森海冰间湖区的研究表明, 海水中的无机营养盐主要影响浮游细菌的丰度而非多样性[47]。
5.2 生物因子
5.2.1 浮游植物
浮游植物光合作用过程中释放的DOM是浮游细菌的主要营养源, 因而浮游植物的生物量和组成会显著影响浮游细菌的群落结构[48-49]。对南极半岛近岸海域的研究表明, 细菌群落结构会随着浮游植物组成的变化而变化, 但存在时间上的滞后[34]。与此同时, 浮游细菌与浮游植物间存在对海洋中限制性铁(Fe)元素的竞争。实验和模式研究均显示, 增加Fe浓度和提高光照强度有利于浮游植物主导Fe的利用, 而提高溶解有机碳(Dissolved Organic Carbon, DOC)浓度和降低Fe浓度可促进浮游细菌对Fe的吸收[50]。在高DOC、低Fe浓度的环境下, 浮游细菌对Fe具有极强的竞争力, 浮游植物释放的DOC可调节相互竞争的强度。
对南极南设得兰群岛智利湾的研究发现, 浮游细菌的多样性与浮游植物丰度密切相关, 浮游植物水华期间浮游细菌群落的多样性明显较高, 主要类群为α-变形菌纲和拟杆菌门[39]。对普里兹湾的研究表明, 细菌多样性与浮游植物量和生产力水平呈现正相关[41]。但对阿蒙森海的研究则显示, 浮游植物水华通过颗粒物沉降等过程会提高真光层以下水层中浮游细菌的多样性[47]。而对南极半岛和亚南极凯尔盖朗群岛近海海域研究同样表明, 浮游细菌群落结构和生物多样性的变化与浮游植物水华密切相关, DOC是冬季期间支配浮游细菌群落的主要因子[29,51]。
预测表明南大洋浮游植物群落会受到气候变化的显著影响[52], 这将对包括浮游细菌在内的整个南大洋生态系统产生深远影响。
5.2.2 原生动物
海洋原生动物是浮游细菌最主要的捕食者, 其捕食行为可以直接抑制细菌生物量的增长, 同时捕食过程也会导致DOM 的释放和无机盐的再生, 从而促进浮游细菌的生长。对南大洋的研究显示, 原生动物可以消耗90%的日细菌产量[53], 但对于浮游细菌生物群落的影响, 目前尚缺乏相关研究。
5.2.3 内部竞争
浮游细菌群落结构和多样性不仅受环境因素的影响, 也会受到不同细菌类群间的相互合作或竞争的影响[54-55]。例如, 亚硫酸盐杆菌是一种亚硫酸盐氧化细菌, 而海杆菌、交替单胞菌和食碱菌亚硫酸盐杆菌能够利用碳氢化合物, 它们之间可以很好地合作共生[56]。具有相同或者相似生态功能的浮游细菌优势类群, 彼此间会为争取相同或者相似的生境产生竞争。如α-变形菌中的SAR11类群存在于特定生境, 呈寡营养方式生活[57], 玫瑰杆菌类群则具有诸如厌氧光合[58]、一氧化碳氧化[59]以及对一系列有机物的异养利用[30]等多种代谢途径, 而SAR116类群兼具SAR11类群和玫瑰杆菌类群的功能, 它们之间存在竞争关系。在寡营养海域, 具有多种代谢功能有利于细菌在竞争关系中占据优势。另外, 具有自养能力的蓝细菌在表层海水中广泛分布, 但在黄杆菌丰度较高的表层海域却很少能被检测到[37]。对南极半岛北端海域表层浮游细菌群落的研究表明, 在夏季其优势属间的相互作用是浮游细菌群落结构的主控因子[11]。
6 展望
浮游细菌在极区海洋生态系统中扮演着十分重要的角色。高通量测序技术的逐渐成熟、生物信息学的发展以及相关数据的积累, 在一定程度上增进了对于极地浮游细菌群落结构的认知。但目前对南极浮游细菌群落结构的研究, 主要集中在对优势类群的分析, 对小众类群的研究极为有限, 导致未能鉴定OTUs的比例偏高。与此同时, 尽管浮游细菌群落在南大洋发挥着至关重要的作用, 但对它们的分布和季节变化的研究仍然有限, 研究区域主要集中在西南极、特别是南极半岛近岸海域, 而对开阔大洋的调查偏少、对东南极广阔海域的研究很少。气候变化导致局域海水升温和海冰减少, 会对生态系统造成深远影响[60-61], 但对浮游细菌群落的相关研究和预测仍极为有限[16]。为此, 今后应重点开展以下几个方面的研究。
1.群落组成与空间分布研究。加强船基大洋调查与研究, 补充东南极海域和冰区浮游细菌群落研究, 开展小众类群结构及调控机理研究, 提升对南大洋浮游细菌群落的系统了解。
2.群落季节变化研究。加强依托考察站的近岸浮游细菌群落研究, 重点分析海冰变化对群落结构的影响。加强对浮冰区冰下浮游细菌群落季节变化研究, 重点开展融冰期冰缘区浮游细菌群落及其与冰缘浮游植物水华的相关性分析。
3.深层群落结构及调控机理研究。开展深海浮游细菌群落结构研究, 探索群落空间分布特征及其调控机理, 与其他大洋深层群落的特异性对比, 分析水文过程和上层海域颗粒物沉降对深层海域群落结构的潜在影响。
4.气候变化潜在影响研究。研究气候变化导致的海水增暖、水团变异、海洋酸化等环境快速变化对浮游细菌群落的影响, 发展南大洋海洋微食物环模型, 预测在全球变化背景下浮游细菌群落的调控机理及潜在变化。
1 BLACKBURN N, FENCHEL T, MITCHELL J. Microscale nutrient patches in planktonic habitats shown by chemotactic bacteria[J]. Science, 1998, 282(5397): 2254-2256.
2 LE B P J WILLIAMS. The balance of plankton respiration and photosynthesis in the open oceans[J]. Nature, 1998, 394(6688): 55-57.
3 AZAM F. Microbial control of oceanic carbon flux: The plot thickens[J]. Science, 1998, 280(5364): 694-696.
4 KARL D M. Nutrient dynamics in the deep blue sea[J]. Trends in Microbiology, 2002, 10(9): 410-418.
5 LOREAU M, NAEEM S, INCHAUSTI P, et al. Biodiversity and ecosystem functioning: Current knowledge and future challenges[J]. Science, 2001, 294(5543): 804-808.
6 GIOVANNONI S J, STINGL U. Molecular diversity and ecology of microbial plankton[J]. Nature, 2005, 437(7057): 343-348.
7 MURRAY A E, GRZYMSKI J J. Diversity and genomics of Antarctic marine micro-organisms[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2007, 362(1488): 2259-2271.
8 DELILLE D. Abundance and function of bacteria in the Southern Ocean[J]. Cellular and Molecular Biology, 2004, 50(5): 543-551.
9 DUPONT C L, RUSCH D B, YOOSEPH S, et al. Genomic insights to SAR86, an abundant and uncultivated marine bacterial lineage[J]. The ISME Journal, 2012, 6(6): 1186-1199.
10 TOPPING J N, HEYWOOD J L, WARD P, et al. Bacterioplankton composition in the Scotia Sea, Antarctica, during the austral summer of 2003[J]. Aquatic Microbial Ecology, 2006, 45(3): 229-235.
11 CAO S, ZHANG W, DING W, et al. Structure and function of the Arctic and Antarctic marine microbiota as revealed by metagenomics[J]. Microbiome, 2020, 8(1): 47.
12 YU Z, YANG J, LIU L, et al. Bacterioplankton community shifts associated with epipelagic and mesopelagic waters in the Southern Ocean[J]. Scientific Reports, 2015, 5(1):12897.
13 GHIGLIONE J F, GALAND P E, POMMIER T, et al. Pole-to-pole biogeography of surface and deep marine bacterial communities[J]. PNAS, 2012, 109(43): 17633-17638.
14 DINASQUET J, RICHERT I, LOGARES R, et al. Mixing of water masses caused by a drifting iceberg affects bacterial activity, community composition and substrate utilization capability in the Southern Ocean[J]. Environmental Microbiology, 2017, 19(6): 2453-2467.
15 HERNÁNDEZ E A, LOPEZ J L, PIQUET A M T, et al. Changes in salinity and temperature drive marine bacterial communities’ structure at Potter Cove, Antarctica[J]. Polar Biology, 2019, 42(12): 2177-2191.
16 TONELLI M, SIGNORI C N, BENDIA A, et al. Climate projections for the Southern Ocean reveal impacts in the marine microbial communities following increases in sea surface temperature[J]. Frontiers in Marine Science, 2021, 8: 636226.
17 LIU Q, JIANG Y. Application of microbial network analysis to discriminate environmental heterogeneity in Fildes Peninsula, Antarctica[J]. Marine Pollution Bulletin, 2020, 156: 111244.
18 CAO S, HE J, ZHANG F, et al. Diversity and community structure of bacterioplankton in surface waters off the northern tip of the Antarctic Peninsula[J]. Polar Research, 2019, 38: 3491.
19 WANG Z B, SUN Y Y, LI Y, et al. Significant bacterial distance-decay relationship in continuous, well-connected Southern Ocean surface water[J]. Microbial Ecology, 2020, 80(1): 73-80.
20 JAMIESON R E, ROGERS A D, BILLETT D S M, et al. Patterns of marine bacterioplankton biodiversity in the surface waters of the Scotia Arc, Southern Ocean[J]. FEMS Microbiology Ecology, 2012, 80(2): 452-468.
21 MILICI M, VITAL M, TOMASCH J, et al. Diversity and community composition of particle-associated and free-living bacteria in mesopelagic and bathypelagic Southern Ocean water masses: Evidence of dispersal limitation in the Bransfield Strait[J]. Limnology and Oceanography, 2017, 62(3): 1080-1095.
22 MORRIS R M, RAPPÉ M S, CONNON S A, et al. SAR11 clade dominates ocean surface bacterioplankton communities[J]. Nature, 2002, 420(6917): 806-810.
23 GIEBEL H A, BRINKHOFF T, ZWISLER W, et al. Distribution ofRCA and SAR11 lineages and distinct bacterial communities from the subtropics to the Southern Ocean[J]. Environmental Microbiology, 2009, 11(8): 2164-2178.
24 BUCHAN A, GONZÁLEZ J M, MORAN M A. Overview of the marinelineage[J]. Applied and Environmental Microbiology, 2005, 71(10): 5665-5677.
25 ABELL G C J, BOWMAN J P. Ecological and biogeographic relationships of class Flavobacteria in the Southern Ocean[J]. FEMS Microbiology Ecology, 2005, 51(2): 265-277.
26 DELONG E F, FRANKS D G, ALLDREDGE A L. Phylogenetic diversity of aggregate-attached vs. free-living marine bacterial assemblages[J]. Limnology and Oceanography, 1993, 38(5): 924-934.
27 PINHASSI J, SALA M M, HAVSKUM H, et al. Changes in bacterioplankton composition under different phytoplankton regimens[J]. Applied and Environmental Microbiology, 2004, 70(11): 6753-6766.
28 WILKINS D, LAURO F M, WILLIAMS T J, et al. Biogeographic partitioning of Southern Ocean microorganisms revealed by metagenomics[J]. Environmental Microbiology, 2013, 15(5): 1318-1333.
29 GHIGLIONE J F, MURRAY A E. Pronounced summer to winter differences and higher wintertime richness in coastal Antarctic marine bacterioplankton[J]. Environmental Microbiology, 2012, 14(3): 617-629.
30 BRINKHOFF T, GIEBEL H A, SIMON M. Diversity, ecology, and genomics of theclade: A short overview[J]. Archives of Microbiology, 2008, 189(6): 531-539.
31 DELILLE D. Marine bacterioplankton at the Weddell Sea ice edge, distribution of psychrophilic and psychrotrophic populations[J]. Polar Biology, 1992, 12(2): 205-210.
32 SIGNORI C N, THOMAS F, ENRICH-PRAST A, et al. Microbial diversity and community structure across environmental gradients in Bransfield Strait, Western Antarctic Peninsula[J]. Frontiers in Microbiology, 2014, 5: 647.
33 WILLIAMS T J, LONG E, EVANS F, et al. A metaproteomic assessment of winter and summer bacterioplankton from Antarctic Peninsula coastal surface waters[J]. The ISME Journal, 2012, 6(10): 1883-1900.
34 PIQUET A M T, BOLHUIS H, MEREDITH M P, et al. Shifts in coastal Antarctic marine microbial communities during and after melt water-related surface stratification[J]. FEMS Microbiology Ecology, 2011, 76(3): 413-427.
35 RICHERT I, DINASQUET J, LOGARES R, et al. The influence of light and water mass on bacterial population dynamics in the Amundsen Sea Polynya[J]. Elementa: Science of the Anthropocene, 2015, 3(2): 000044.
36 KIM J G, PARK S J, QUAN Z X, et al. Unveiling abundance and distribution of planktonic Bacteria and Archaea in a polynya in Amundsen Sea, Antarctica[J]. Environmental Microbiology, 2014, 16(6): 1566-1578.
37 GENTILE G, GIULIANO L, D’AURIA G, et al. Study of bacterial communities in Antarctic coastal waters by a combination of 16S rRNA and 16S rDNA sequencing[J]. Environmental Microbiology, 2006, 8(12): 2150-2161.
38 PIQUET A M T, BOLHUIS H, DAVIDSON A T, et al. Seasonal succession and UV sensitivity of marine bacterioplankton at an Antarctic coastal site[J]. FEMS Microbiology Ecology, 2010, 73(1): 68-82.
39 FUENTES S, ARROYO J I, RODRÍGUEZ-MARCONI S, et al. Summer phyto- and bacterioplankton communities during low and high productivity scenarios in the Western Antarctic Peninsula[J]. Polar Biology, 2019, 42(1): 159-169.
40 李丙瑞. 中国第35次南极科学考察简报[J]. 极地研究, 2019, 31(3): 364-367.
41 吴月红, 韩正兵, 张心齐, 等. 南极普里兹湾可培养浮游细菌群落结构研究[J]. 极地研究, 2014, 26(2): 222-229.
42 GIOVANNONI S J, BIBBS L, CHO J C, et al. Proteorhodopsin in the ubiquitous marine bacterium SAR11[J]. Nature, 2005, 438(7064): 82-85.
43 COTTRELL M T, KIRCHMAN D L. Photoheterotrophic microbes in the Arctic Ocean in summer and winter[J]. Applied and Environmental Microbiology, 2009, 75(15): 4958-4966.
44 BECQUEVORT S, DUMONT I, TISON J L, et al. Biogeochemistry and microbial community composition in sea ice and underlying seawater off East Antarctica during early spring[J]. Polar Biology, 2009, 32(6): 879-895.
45 WILKINS D, VAN SEBILLE E, RINTOUL S R, et al. Advection shapes Southern Ocean microbial assemblages independent of distance and environment effects[J]. Nature Communications, 2013, 4(1): 2457.
46 MAAS E W, LAW C S, HALL J A, et al. Effect of ocean acidification on bacterial abundance, activity and diversity in the Ross Sea, Antarctica[J]. Aquatic Microbial Ecology, 2013, 70(1): 1-15.
47 RICHERT I, YAGER P L, DINASQUET J, et al. Summer comes to the Southern Ocean: How phytoplankton shape bacterioplankton communities far into the deep dark sea[J]. Ecosphere, 2019, 10(3): e02641.
48 DELMONT T O, HAMMAR K M, DUCKLOW H W, et al.blooms strongly influence bacterial community structures in the Amundsen Sea polynya[J]. Frontiers in Microbiology, 2014, 5(5): 646.
49 LANDA M, BLAIN S, CHRISTAKI U, et al. Shifts in bacterial community composition associated with increased carbon cycling in a mosaic of phytoplankton blooms[J]. The ISME Journal, 2016, 10(1): 39-50.
50 RATNARAJAH L, BLAIN S, BOYD P W, et al. Resource colimitation drives competition between phytoplankton and bacteria in the Southern Ocean[J]. Geophysical Research Letters, 2021, 48(1): e2020GL088369.
51 LANDA M, BLAIN S, HARMAND J, et al. Major changes in the composition of a Southern Ocean bacterial community in response to diatom-derived dissolved organic matter[J]. FEMS Microbiology Ecology, 2018, 94(4): fiy034.
52 DEPPELER S L, DAVIDSON A T. Southern Ocean phytoplankton in a changing climate[J]. Frontiers in Marine Science, 2017, 4(40): 1-28.
53 BECQUEVORT S, MENON P, LANCELOT C. Differences of the protozoan biomass and grazing during spring and summer in the Indian sector of the Southern Ocean[J]. Polar Biology, 2000, 23(5): 309-320.
54 DANG H Y, LOVELL C R. Microbial surface colonization and biofilm development in marine environments[J]. Microbiology and Molecular Biology Reviews, 2015, 80(1): 91-138.
55 KOSTKA J E, PRAKASH O, OVERHOLT W A, et al. Hydrocarbon-degrading bacteria and the bacterial community response in gulf of Mexico beach sands impacted by the deepwater horizon oil spill[J]. Applied and Environmental Microbiology, 2011, 77(22): 7962-7974.
56 MAS-LLADÓ M, PIŇA-VILLALONGA J M, BRUNET-GALMÉS I, et al. Draft genome sequences of two isolates of thegroup,sp. strains 3SOLIMAR09 and 1FIGIMAR09, from harbors of Mallorca Island (Mediterranean Sea)[J]. Genome Announcements, 2014, 2(3): e00350-14.
57 BROWN M V, LAURO F M, DEMAERE M Z, et al. Global biogeography of SAR11 marine bacteria[J]. Molecular Systems Biology, 2012, 8(1): 595.
58 BIEBL H, ALLGAIER M, TINDALL B J, et al.gen. nov. sp. nov., a new aerobic phototrophic bacterium isolated from dinoflagellates[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55: 1089-1096.
59 KING G M. Molecular and culture-based analyses of aerobic carbon monoxide oxidizer diversity[J]. Applied and Environmental Microbiology, 2003, 69(12): 7257-7265.
60 SALLÉE J-B. Southern Ocean warming[J]. Oceanography, 2018, 31(2): 52-62.
61 PINKERTON M H, BOYD P W, DEPPELER S, et al. Evidence for the impact of climate change on primary producers in the Southern Ocean[J]. Frontiers in Ecology and Evolution, 2021, 9: 592027.
Progress in the study of bacterioplankton community structures in the Southern Ocean
Sun Yurong1,2, Ma Yuxin3,4,1, Cao Shunan2,3, Luo Guangfu2,3, Lan Musheng2,3, He Jianfeng2,3,4,5
(1College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;2Antarctic Great Wall Polar Ecology National Scientific Observation and Research Station, Polar Research Institute of China, Shanghai 200136, China;3MNR Key Laboratory for Polar Science, Polar Research Institute of China, Shanghai 200136, China;4School of Oceanography, Shanghai Jiao Tong University, Shanghai 200030, China;5College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China)
Bacterioplankton is an important part of the marine microbial loop, playing a role in maintaining the stability of the marine ecosystem and material circulation. This paper summarizes the community composition of bacterioplankton and its influencing factors in different parts of the Southern Ocean. The results show that the dominant groups are α-proteobacteria, γ-proteobacteria, and Cytophaga-Flexibacter-Bacteroides (CFB), while less abundant groups exhibit strong spatial variability. Temperature and dissolved organic carbon concentrations are two of the main environmental factors that regulate the community structure. There is an obvious interaction between bacterioplankton and other compnents of the microbial food web. Environmental changes such as increasing water temperature and ocean acidification caused by climate change may affect the bacterioplankton community. In the future, research on the bacterioplankton in the pelagic waters, pack ice zone, and deep waters, should be strengthened. In addition, research on seasonal community changes in nearshor waters should be conducted, as should attempts to predict the potential changes and regulation mechanisms of the bacterioplanktonic community in the Southern Ocean via both field investigations and modeling.
Southern Ocean, bacterioplankton, community structure, seasonality, environmental factors
2020年12月收到来稿, 2022年3月收到修改稿
极地调查专项(IRASCC-01-02)和国家自然科学基金(41976230)资助
孙玉蓉, 女, 1997年生。硕士, 主要从事海洋微生物学和海洋化学研究。E-mail:1018445900@qq.com
何剑锋, E-mail: hejianfeng@pric.org.cn
10.13679/j.jdyj.20200079

