泊沙康唑诱导的假性醛固酮增多症的临床特征分析
王春江 孙伟 吴翠芳 刘世坤 李佐军
(中南大学湘雅三医院药学部,长沙 410013)
泊沙康唑是一种抗真菌剂,通过抑制细胞色素 P450 依赖的14α-脱甲基酶进而抑制麦角甾醇的合成,导致真菌细胞膜的生物合成障碍, 细胞膜通透性改变,从而抑制真菌生长[1]。对念珠菌属(包括克柔氏念珠菌和光滑念珠菌)、曲霉属(包括土曲霉)、新生隐球菌、粗球孢子菌、镰刀菌、组织胞浆菌、接合菌和其他丝状真菌有效[2]。泊沙康唑通常耐受性良好,最常见不良反应为胃肠道反应(恶心、呕吐和腹痛等)、肝毒性、皮疹和发热等[3]。先前的临床试验数据表明,在接受每日300 mg口服泊沙康唑治疗的患者中,22%发生低钾血症,11%发生高血压。在评估泊沙康唑预防性使用的1 b期研究中,9%的患者出现低钾血症[4]。
假性醛固酮增多症(pseudohyperaldosteronism,PH)是指不依赖醛固酮的盐皮质激素活性增加(如脱氧皮质酮、氟氢化可的松、氟泼尼松龙、雌激素),并导致新的或恶化的高血压和低钾血症的发展。引起PH的原因很多,最常见的是长期过量食用甘草所致,其他原因包括遗传因素如Liddle 综合征、表象性盐皮质激素过多综合征、糖皮质激素可治性高血压;内分泌疾病如库欣综合征、异位促肾上腺皮质激素综合征[5]。 研究表明泊沙康唑与假性醛固酮增多症 (posaconazole-induced pseudohyperaldosteronism, PIPH)有关,但对于PIPH的研究大部分是基于病例报道,对于PIPH的临床特征及预后了解有限。本研究的目的是探讨泊沙康唑相关假性醛固酮增多症的临床特点,有助于该不良反应的防范,为泊沙康唑的合理使用提供依据。
1 资料与方法
1.1 病例资料
检索PubMed、Ovid、Web of Science、Embase、Springer-link、Wiley Oline Library 和中国知网、万方和维普数据库(截至2021年5月),收集报道泊沙康唑诱导的假性醛固酮增多症的病例报告,以泊沙康唑、假性醛固酮增多症、高血压、盐皮质激素、低钾血症、醛固酮、posaconazole、pseudohyperaldosteronism、hypertension、mineralocorticoid、hypokalemia、aldosterone作为中英文关键词。
文献纳入标准:①泊沙康唑诱导的假性醛固酮增多症诊断明确且被作者判定为与泊沙康唑相关;②泊沙康唑使用情况、实验室检查和处置及转归等临床资料相对完整。文献排除标准:①会议论文、毕业论文等非公开发表的文献;②综述、动物研究、重复发表病例;③临床资料不完整的文献。
PIPH的诊断标准:开始泊沙康唑治疗后平均收缩压 (SBP) 增加至少10 mmHg和/或血清钾减少至少0.5 mmol/L。PIPH的诊断通过实验室检测得到证实,11-脱氧皮质醇升高,血清醛固酮检测不到,肾素活性低至正常低线。
1.2 方法
由2位研究者按照纳入与排除标准对文献进行初步筛选,再由小组讨论决定纳入分析的文献。采用自行设计的数据提取表,提取患者以下信息:国籍,性别,年龄,泊沙康唑应用情况,实验室检查,假性醛固酮增多症发生情况、处置及转归等。对提取的各类数据进行描述性统计分析。
2 结 果
2.1 文献收集及患者一般情况
共收集到泊沙康唑诱导的假性醛固酮增多症病例报告12篇[6-17],包括32例患者(18例男性,14例女性),其中美国27例,英国和瑞士各2例,泰国1例。患者的中位年龄为58岁(6~87)。9例患者使用泊沙康唑主要用于预防真菌感染,其中4例患者预防造血细胞移植患者发生侵袭性真菌病(IFD),3例患者预防急性髓细胞白血病/骨髓增生异常综合征IFD,1例患者预防联合免疫缺陷IFD,1例患者用于囊性纤维化IFD。23例患者使用泊沙康唑治疗IFD(12例球孢子菌病、4例毛霉病、3例组织胞浆菌病、1例曲霉病、1例孢子丝菌病)。见表1。
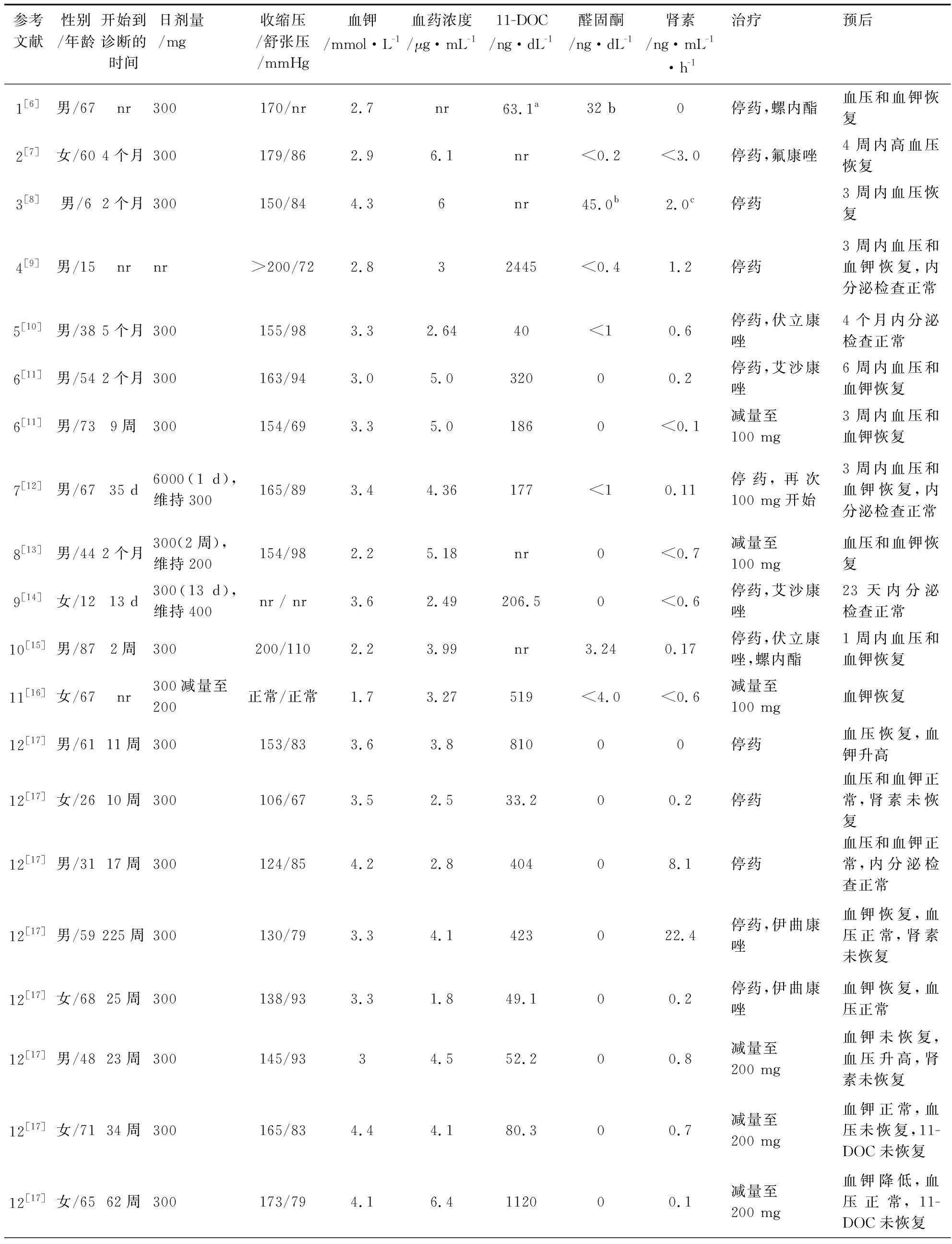
表1 32例泊沙康唑诱导的假性醛固酮增多症患者的临床资料Tab.1 Clinical data of 32 patients with pseudo-aldosteronism induced by posaconazole
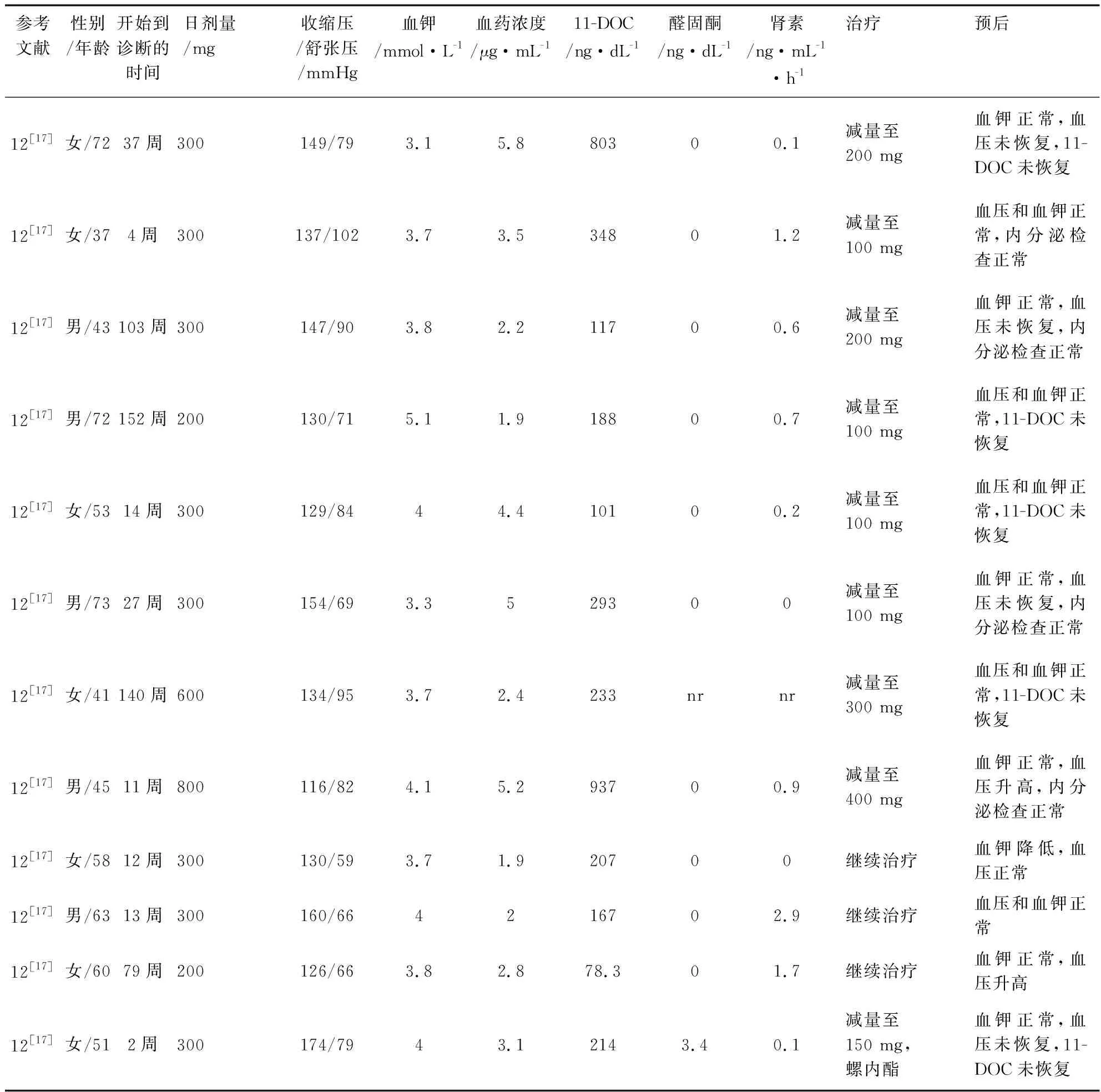
(续表)
2.2 用药情况
31例患者描述了泊沙康唑使用剂量,23例患者始终使用300 mg,2例患者始终使用200 mg;1例患者始终使用600 mg,1例患者始终使用800 mg;2例患者开始服用300 mg,然后减为200 mg;1例患者300 mg,2次/天,1 d后改为300 mg,1次/天;1例患者给予负荷剂量,后300 mg维持,13 d后增加为400 mg/d。6例患者同时使用了其他药物。见表1。
2.3 假性醛固酮增多症发生情况
发生时间 29例患者的假性醛固酮增多症发生的中位时间为14周(1.4~225),5例患者发生在用药1个月内,8例患者发生在用药1~3个月内,12例患者发生在用药3~20个月内,5例患者发生在20个月后。见表1。
临床表现及实验室检查结果 4例患者出现了临床症状,其中1例患者潮红和头痛,1例患者男性乳房发育症,1例患者疲劳、多尿,1例患者手足肿胀。19例患者收缩压>140 mmHg,最高值可达>200 mmHg,12例患者血压<140 mmHg;20例患者舒张压<90 mmHg,9例患者舒张压≥90 mmHg,最高舒张压110 mmHg。15例患者血钾<3.5 mmol/L,其中3例患者血钾<2.5 mmol/L,5例患者2.5~3 mmol/L,7例患者3~3.5 mmol/L;17例患者血钾3.5~5.5 mmol/L。24例患者描述了碳酸氢盐(HCO3-),其中5例患者<22 mmol/L,13例患者22~27 mmol/L,6例患者>28 mmol/L,7例患者出现了代谢性碱中毒。
泊沙康唑血药浓度中位值为3.80 μg/mL(0.03~6.4),4例患者浓度<2 μg/mL,14例患者2~4 μg/mL,11例患者4~6 μg/mL,3例患者≥6 μg/mL。28例患者报告了11-脱氧皮质醇检查结果,其中26例患者11-脱氧皮质醇升高,2例患者正常;31例患者报告了醛固酮水平,均降低或检测不到;32患者报告了肾素水平,其中19例降低或检测不到,2例患者升高,11例患者位于正常下限。
2.4 假性醛固酮增多症临床处置及转归
15例患者停用了泊沙康唑,14例患者泊沙康唑减量,3例患者继续治疗。3例患者加用了螺内酯,7例患者更换为其他抗真菌药物,其中使用伏立康唑、艾沙康唑、伊曲康唑各2例,氟康唑1例。15例患者停用泊沙康唑后,血压、血钾在6周内均恢复到正常水平,而2例患者肾素未恢复。14例患者减少泊沙康唑减量后,6例患者血压或血钾未完全恢复正常,7例患者11-脱氧皮质醇未恢复,1例肾素未恢复。3例继续泊沙康唑原剂量治疗的患者,1例患者低血钾,1例患者血钾升高,1例患者11-脱氧皮质醇未恢复。
3 讨 论
泊沙康唑是一种广谱三唑,具有广泛的抗真菌活性,通常用于治疗或预防曲霉病、毛霉病和其他侵袭性真菌感染[18-19]。临床中泊沙康唑用于预防侵袭性真菌病时血药谷浓度应维持在0.7 mg/L以上,而用于治疗IFD 时药谷浓度应维持在1.0 ~ 1.25 mg/L以上[20]。泊沙康唑剂型主要包括口服混悬液(40 mg/mL)、肠溶缓释片(100 mg)和静脉注射液(300 mg)[3]。泊沙康唑缓释片与溶液制剂相比,其生物利用度更高,耐受性良好,安全性更高[21-22]。泊沙康唑主要通过 UDP1A4 葡糖苷酸化进行代谢,并且是P糖蛋白(P-gp)泵出作用的底物,也是 CYP3A4 的强效抑制剂[23]。
醛固酮增多症可分为真性醛固酮增多症和PH,真性醛固酮增多症可分为原发性醛固酮增多症(不依赖肾素)或继发性醛固酮增多症(依赖肾素),实验室检查表现为醛固酮增高。PINP患者血浆醛固酮和肾素水平受到抑制,因此排除了醛固酮增多症的可能,考虑PH。PH原因主要包括药物、遗传因素和内分泌疾病。根据患者的疾病史、用药史、临床症状和生化特征可考虑PINP。然而不是所有PINP患者均出现低钾血症,考虑到它并不总是出现在原发性醛固酮增多症中。PINP患者很少出现相关的临床表现,仅个别患者出现潮红、头痛、疲劳、多尿、水肿以及1男性乳房发育。PINP实验室检查可表现为11-脱氧皮质醇升高、醛固酮和肾素降低或低于检测值。PINP经常与血清碳酸氢盐增加有关,但并不总是观察到,不是诊断所必需的。
泊沙康唑诱导的PIPH 时间范围广泛,主要发生在给药后13 d到225周。Nguyen等[24]对69名接受泊沙康唑治疗的回顾性、观察性研究中发现假性醛固酮增多症 (PIPH)与年龄(61.1岁与44.7岁,P=0.007)、药物浓度(3.0∶1.2 μg/mL,P≤0.0001)和先前高血压(68.8% 与 32.1%,P=0.009)有关。血清泊沙康唑水平与收缩压增加(r=0.37,P=0.01),与血钾减少(r =-0.39,P=0.006),以及与11-脱氧皮质醇增加(r=0.69,P<0.0001)相关。而性别、种族、体重指数、糖尿病、肾功能和剂量(mg·kg-1·d-1)不是PINP的危险因素[24]。药物相互作用可能会影响泊沙康唑药代动力学和药效学。本研究患者所用药物未增加泊沙康唑浓度,而泮托拉唑可增加胃的 pH 值,减少泊沙康唑吸收。此外,一些易感因素也会影响泊沙康唑浓度,如编码参与泊沙康唑代谢或转运的蛋白质的基因多态性[25]。
11β-羟化酶(CYP11B1)是一种由CYP11B1编码的线粒体酶,它通过添加羟基将 11-脱氧皮质醇和 11-脱氧皮质酮分别转化为皮质醇和皮质酮[26]。抑制 11β-羟化酶导致11-脱氧皮质醇和 11-脱氧皮质酮 (DOC) 的积累。DOC具有盐皮质激素作用,是醛固酮的盐皮质激素效力的1/40[27]。导致远端小管和集合管中的上皮钠通道过度活动,导致钠和水潴留引起的高血压以及低钾血症。醛固酮受体被醛固酮和皮质醇激活。11β-羟基类固醇脱氢酶 2 (11β-HSD2) 在肾脏中将皮质醇转化为无活性的可的松,可的松不与1型盐皮质激素受体结合。当11β-HSD2的活性受损时,质醇依赖性盐皮质激素受体过度激活会导致低钾血症、高钠血症和水潴留,导致严重的高血压,低肾素、低醛固酮、血浆和尿皮质醇与可的松比值增加[28]。泊沙康唑诱发高血压的机制尚不清楚,目前的研究归因于11 β-羟化酶抑制[10-11,14-15]或 11 β-羟基类固醇脱氢酶 2 抑制(11β-HSD2)[8]或两者均抑制[7,12-13]。11β-HSD2的抑制可以解释血清中皮质醇/可的松增加,抑制 11β羟化酶可解释11-脱氧皮质酮 (DOC) 和 11-脱氧皮质醇水平升高。目前不能确定这两种诱导酶缺乏对盐皮质激素过量的影响的相对贡献,具有显著的个体差异[13]。
PIPH的治疗尚无统一标准。鉴于 PIPH 的潜在病理生理机制,推荐的一线抗高血压药物通常效果较差。停用泊沙康唑,其他三唑类抗真菌药物(如艾沙康唑和伊曲康唑)可作为一种治疗选择。但应注意的是伊曲康唑也报告了类似的高血压和低钾血症综合征[29]。持续感染且没有其他治疗选择的患者可能仅通过降低泊沙康唑剂量或添加盐皮质激素受体拮抗剂(如螺内酯)来改善。对于不能耐受螺内酯的患者,可考虑使用上皮钠通道拮抗剂,如阿米洛利或氨苯蝶啶[30]。患者在停止治疗或减量后血压、血钾及实验室检查指标逐渐恢复正常。
综上,PIPH的特征包括临床(高血压和低钾血症)和内分泌(11-脱氧皮质醇升高,醛固酮和肾素降低或检测不到),且与泊沙康唑血清浓度升高有关。但迄今为止描述的患者数量较少,无法提出明确的治疗药物监测目标建议。鉴于泊沙康唑与高血压与低血钾的相关性,接受泊沙康唑治疗的患者都应筛查高血压和低钾血症,如果发现异常,应进一步进行内分泌评估。

