植物乳杆菌对北京鸭脂质代谢和抗氧化功能的影响
安柯颖 高文文 李 蕾 夏兆飞
(中国农业大学动物医学院,北京100193)
在畜禽养殖生产中,营养水平、饲养密度、病原、品系、免疫等因素均可导致动物出现应激反应,从而产生大量活性氧自由基(reactive oxygen species,ROS),破坏机体氧化平衡状态,造成细胞和组织氧化损伤。因此,寻找安全有效的动物饲料添加剂来调控畜禽的健康状态一直是研究热点。乳酸菌(lactose acid bacterium,LAB)具有降低胆固醇、提高抗氧化功能、调节免疫等作用,而其中的植物乳杆菌(Lactobacillusplantarum,LP)因具有良好的益生效果以及高安全性而广泛应用于食品、医药、畜牧等领域[1-3]。Li等[4]研究表明,植物乳杆菌NCU116可通过下调肝脏低密度脂蛋白胆固醇受体(low density lipoprotein cholesterol receptor,LDLR)和胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)基因的表达,降低高脂血症小鼠模型的血清胆固醇含量。另有研究表明植物乳杆菌发酵大豆提取物可通过调控过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)通路,缓解高脂饮食引起的脂质代谢异常[5]。此外,还有研究表明植物乳杆菌FC225可通过激活核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路,提高小鼠肝脏超氧化物歧化酶(superoxide dismutase,SOD)活性,降低肝脏丙二醛(malondialdehyde,MDA)含量[6]。然而,当前植物乳杆菌对北京鸭益生效果的研究甚少,而对其调控脂质代谢和抗氧化功能的研究尚未见报道。因此,本试验以北京鸭为研究对象,探究饲粮中添加植物乳杆菌对北京鸭脂质代谢和抗氧化功能的影响及其可能的分子机制,为植物乳杆菌在北京鸭生产中的应用提供科学依据。
1 材料与方法
1.1 试验材料
植物乳杆菌购自某生物科技有限公司,活菌数≥5×109CFU/g,菌株编号:WYRSJ1000。北京鸭购自天津禽养殖专业合作社。
1.2 试验设计与饲养管理
饲养试验在中国农业大学家禽试验基地(河北涿州)进行。将体重[(59.99±0.69) g]相近的180只1日龄北京鸭随机分为3个组,每组6个重复,每个重复10只鸭。对照组饲喂玉米-豆粕型基础饲粮,试验组在基础饲粮中分别添加400(LP1组)和800 mg/kg植物乳杆菌(LP2组)。试验期42 d。基础饲粮参照NRC(1994)肉鸭饲养标准配制,其组成及营养水平见表1,以粉料形式饲喂。试验鸭采用网上平养模式,试验第1周鸭舍温度维持在33~35 ℃,后期逐步降至22 ℃,24 h光照,自由采食及饮水。
1.3 样品采集与指标测定
1.3.1 腹脂率
试验第42天,从各组中随机挑选体重相近的试验鸭12只,记录其空腹体重,麻醉屠宰后取腹脂进行称重,计算腹脂率,计算公式为:
腹脂率(%)=100×腹脂重(g)/活体重(g)。

表1 基础饲粮组成及营养水平(风干基础)

续表1项目Items含量 Content1~2日龄 1 to 21 days of age22~42日龄 22 to 42 days of age有效磷 AP0.290.39总磷 TP0.540.62蛋氨酸+半胱氨酸 Met+Cys0.790.69
1.3.2 血脂指标
试验第21、42天,从各组中随机挑选体重相近的试验鸭12只,颈静脉采集非抗凝血5 mL,3 000 r/min、4 ℃离心15 min,分离血清,于-80 ℃保存备用。采用德国Prodia Diognostics公司试剂盒测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量,测定仪器为日立全自动生化仪。使用南京建成生物工程研究所试剂盒(微板法)测定血清游离脂肪酸(NEFA)含量,严格按照试剂盒说明书执行。
1.3.3 肝脏脂质代谢和抗氧化功能相关基因表达
取50 mg肝脏组织加入1 mL Trizol(大连TaKaRa公司),按照试剂盒说明书进行总RNA提取,使用NanoDrop®ND-2 000C分光光度计(Thermo fisher Scientific公司,美国)对其浓度和纯度进行测定。使用PrimeScriptTMRT reagent Kit with gDNA Eraser(大连TaKaRa公司)将RNA反转录为cDNA,反转录产物于-20 ℃保存备用。选用TB Green®Premix Ex TaqTM(大连TaKaRa公司)试剂盒并按照说明书进行采用荧光定量PCR操作,反应仪器为7500荧光检测系统(Applied Biosystems公司,美国)。肝脏脂质代谢相关基因包括:脂肪酸合成酶(fatty acid synthase,FAS)、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、肝X受体α(liver X receptor-α,LXR-α)、过氧化物酶体增殖物激活受体-α(peroxisome proliferators-activated receptor-α,PPAR-α)、固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c)、固醇调节元件结合蛋白-2(sterol regulatory element-binding protein-2,SREBP-2)、3-羟基-3-甲基戊二酰辅酶A还原酶(recombinant 3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR)和CYP7A1,肝脏抗氧化功能相关基因包括:SOD和Nrf2。PCR扩增完成后用熔解曲线分析法确定产物特异性,所有基因以甘油醛-3-磷酸脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)作为内参,基因引物序列表见表2。计算方法参考Fu等[7]。
1.3.4 血清、肝脏和回肠抗氧化指标
采集固定位置的肝脏组织样本,刮取回肠黏膜样本,分别置于无RNA酶管中,并放入液氮速冻,于-80 ℃保存。分别称取100 mg的肝脏组织样本和回肠黏膜样本,各加入900 μL生理盐水进行涡旋混匀,于3 000 r/min、4 ℃离心15 min取上清备用。测定血清、肝脏和回肠抗氧化指标,使用试剂盒测定总抗氧化能力(total antioxidant capacity,T-AOC)(ABTS法)、过氧化氢酶(catalase,CAT)活性(钼酸铵法)、SOD活性(WST-1法)以及MDA(TBA法)、总蛋白(total protein,TP)含量(考马斯亮蓝法)。所用试剂盒均购自南京建成生物工程研究所,所有指标检测均严格按照试剂盒说明书执行。
1.4 数据统计与分析
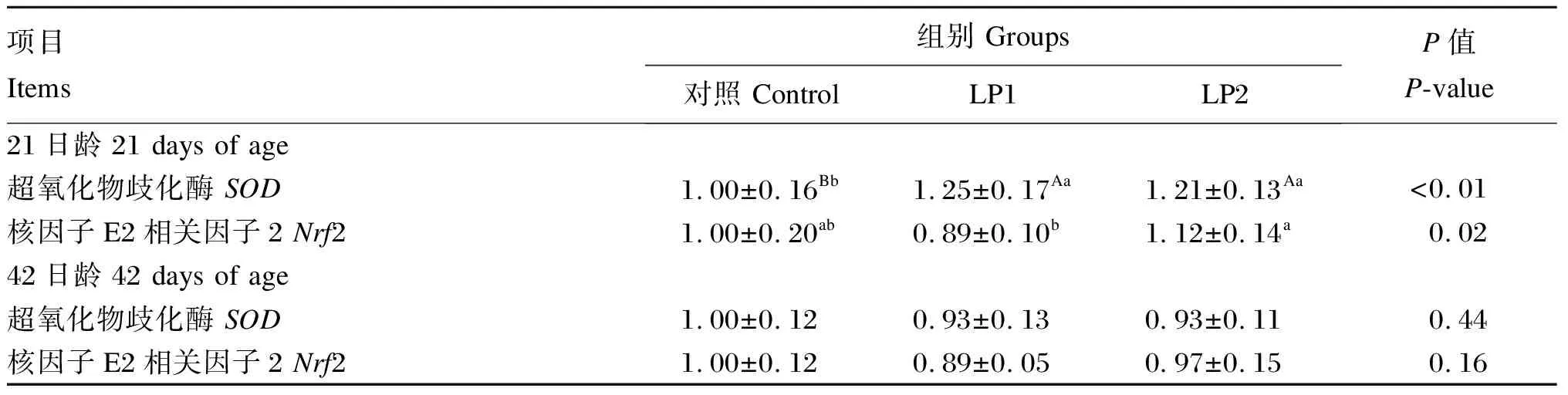
使用SPSS 26.0软件对试验数据进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较检验。结果以平均值±标准差表示,0.01≤P<0.05为差异显著,P<0.01为差异极显著,0.05 表2 肝脏脂质代谢和抗氧化功能相关基因引物序列 由表3可知,21日龄时,各组之间血清TG、TC、HDL-C、LDL-C、NEFA含量差异不显著(P>0.05)。 42日龄时,与对照组相比,LP1和LP2组的腹脂率分别降低了11.40%和5.03%,但差异不显著(P>0.05)。与对照组相比,LP1和LP2组的血清TC含量极显著降低(P<0.01),LP1组的血清LDL-C含量有降低的趋势(P=0.08)。各组之间血清TG、HDL-C、NEFA含量无显著差异(P>0.05)。 由表4可知,21日龄时,与对照组相比,LP1和LP2组肝脏CYP7A1的mRNA相对表达量均极显著升高(P<0.01),LP2组肝脏LXR-α的mRNA相对表达量极显著降低(P<0.01),LP2组肝脏HMGCR的mRNA相对表达量显著降低(P<0.05)。各组之间肝脏FAS、ACC、PPAR-α、SREBP-1c、SREBP-2的mRNA相对表达量无显著差异(P>0.05)。 42日龄时,与对照组相比,LP1和LP2组肝脏FAS和HMGCR的mRNA相对表达量均极显著降低(P<0.01),LP1组肝脏SREBP-1c的mRNA相对表达量极显著降低(P<0.01)。各组之间肝脏ACC、LXR-α、PPAR-α、SREBP-2、CYP7A1的mRNA相对表达量无显著差异(P>0.05)。 由表5可知,21日龄时,各组之间血清T-AOC无显著差异(P>0.05);与对照组相比,LP1和LP2组血清CAT活性极显著升高(P<0.01),LP1组血清SOD活性显著升高(P<0.05),LP1组血清MDA含量显著降低(P<0.05)。各组之间肝脏CAT、SOD活性和T-AOC及MDA含量均无显著差异(P>0.05)。各组之间回肠CAT、SOD活性和T-AOC均无显著差异(P>0.05);与对照组相比,LP1和LP2组回肠MDA含量极显著降低(P<0.01)。 表3 植物乳杆菌对北京鸭腹脂率及血脂指标的影响 表4 植物乳杆菌对北京鸭肝脏脂质代谢相关基因表达的影响 42日龄时,各组之间血清CAT活性、T-AOC及MDA含量均无显著差异(P>0.05);与对照组相比,LP2组血清SOD活性极显著升高(P<0.01)。各组之间肝脏SOD活性和T-AOC均无显著差异(P>0.05);与对照组相比,LP1组肝脏CAT活性显著升高(P<0.05),LP1和LP2组肝脏MDA含量极显著降低(P<0.01)。各组之间回肠CAT活性和T-AOC均无显著差异(P>0.05);与对照组相比,LP1和LP2组回肠SOD活性显著或极显著升高(P<0.05或P<0.01),LP1组回肠MDA含量极显著降低(P<0.01)。 表5 植物乳杆菌对北京鸭血清、肝脏及回肠抗氧化指标的影响 由表6可知,21日龄时,与对照组相比,LP1和LP2组肝脏SOD的mRNA相对表达量均极显著升高(P<0.01),Nrf2的mRNA相对表达量无显著差异(P>0.05)。42日龄时,各组之间肝脏SOD和Nrf2的mRNA相对表达量均无显著差异(P>0.05)。 表6 植物乳杆菌对北京鸭肝脏抗氧化功能相关基因表达的影响 随着消费者对饮食健康的需求增加,畜禽产品中的脂肪和胆固醇含量愈发受到关注。同时,腹脂的过度沉积也会降低禽类胴体的经济价值。本实验室前期研究表明,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌可分别使42日龄北京鸭的平均体重提高1.33%和0.52%[8]。本试验研究了植物乳杆菌对北京鸭脂质代谢的影响,结果显示,饲粮中添加400、800 mg/kg植物乳杆菌可分别使北京鸭的腹脂率降低11.40%和5.03%。这表明轻微下降的腹脂率并未导致北京鸭平均体重的下降,提示植物乳杆菌可一定程度上改善北京鸭的腹脂沉积情况,但并未引起显著差异,这与前人在大鼠和人上取得的研究结果[9-11]相似。血清脂质和脂蛋白含量可反映机体脂质代谢和脂肪沉积的情况。饲粮中添加400、800 mg/kg植物乳杆菌均可显著降低北京鸭的血清TC含量,饲粮中添加400 mg/kg植物乳杆菌有降低血清LDL-C含量的趋势。LDL-C由富含胆固醇、TG的极低密度脂蛋白(VLDL)失去TG后形成,负责将胆固醇运送到各组织,用于合成细胞膜和产生类固醇激素,最终与肝细胞表面的LDLR结合,从而被清除[12]。这提示植物乳杆菌可以改善北京鸭的血脂状况。Trabelsi等[13]报道,饲粮中添加植物乳杆菌TN8可降低肉鸡血清TC含量;Li等[14]和Salaj等[9]研究均表明,饲粮中添加植物乳杆菌能够降低高脂饮食小鼠血清TC和LDL-C含量,与本试验结果相似。 肝脏是脂质代谢的核心器官。本试验进一步研究了肝脏中脂质代谢相关基因的表达情况,探究植物乳杆菌调控北京鸭脂质代谢的潜在机制,结果表明,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌均可显著降低肝脏FAS的mRNA相对表达量,此外,饲粮中添加400 mg/kg植物乳杆菌还可显著降低肝脏SREBP-1c的mRNA相对表达量。SREBP-1c可以和多种脂肪合成酶基因的启动子结合并诱导其表达,还可以作为核转录调节因子直接调控FAS和ACC的表达[15]。FAS是脂肪从头合成过程的限速酶[16]。本试验结果表明,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌可显著降低肝脏SREBP-1c和它的靶基因FAS的mRNA相对表达量,而对肝脏ACC的mRNA相对表达量没有显著影响,这与Wang等[17]在研究约氏乳酸杆菌(LactobacillusJohnsonii)BS15对肉鸡影响中的结果一致。此外,Dawood等[18]也报道了植物乳杆菌L-137可以下调吉富品系尼罗罗非鱼肝脏FAS的mRNA相对表达量。提示植物乳杆菌等乳酸杆菌可下调肝脏脂肪酸的从头合成过程,这可能是其缓解腹部脂肪沉积的途径之一。与本试验结果不同的是,Wang等[17]的结果还发现LactobacillusjohnsoniiBS15可以通过提高肝脏中PPAR-α的mRNA相对表达量,促进脂肪的β-氧化分解,从合成和分解2方面调控脂质代谢。这种差异可能与菌株和模式动物的不同有关[19-20]。 血液中的胆固醇受3条途径调节:吸收、合成和排泄[21]。SREBP-2负责调控胆固醇的合成和摄取,可直接激活内源胆固醇合成限速酶HMGCR基因和负责外源胆固醇摄取的LDLR基因[22]。CYP7A1负责将胆固醇转化为胆汁酸,进而通过粪便排泄,可有效降低血液TC和LDL-C含量[23]。本试验结果表明,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌均可显著降低肝脏HMGCR的mRNA相对表达量,显著提高肝脏CYP7A1的mRNA相对表达量,与血清TC含量降低的结果相吻合,提示植物乳杆菌可通过增强排泄、减少内源合成来降低血清TC含量。值得注意的是,肝脏脂质代谢相关基因从21日龄组间就开始出现差异,而血清TC含量在42日龄组间才出现差异,这与Wang等[17]的研究结果类似,其推测为持续变化的脂质代谢基因最终导致血脂表型的出现。 肝脏作为机体脂质代谢的核心及应对氧化应激的重要效应器官,发生脂质代谢紊乱可产生大量ROS,攻击核酸、蛋白质等生物分子,从而破坏细胞正常功能[24-25]。同样,当肝脏受到氧化应激损伤时势必也会引起脂质代谢功能紊乱[26]。肠道作为除肝脏外的另一大消化器官,物质能量代谢旺盛,极易受到氧化损伤,从而影响肠道屏障功能。因此,当氧化应激发生时,家禽可出现生产性能下降、肉品质降低、免疫抑制等现象[27-28]。因此,本试验还评估了植物乳杆菌对北京鸭血清、肝脏和回肠抗氧化指标的影响,结果显示,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌均可显著降低北京鸭肝脏和回肠MDA含量,提高血清SOD和CAT活性;此外,饲粮中添加400 mg/kg植物乳杆菌还可显著降低血清MDA含量。MDA是ROS攻击细胞膜上的多不饱和脂肪酸形成脂质过氧化物,可作为氧化损伤的生物标志物,细胞中的抗氧化酶如CAT、SOD可清除体内过量的ROS[29]。以上结果表明,植物乳杆菌有助于提高北京鸭的抗氧化功能,抑制脂质过氧化,减少氧化应激。这与前人在肉鸡和断奶羔羊中的研究结果[30-31]基本一致。 为了进一步探究其潜在机制,本试验检测了肝脏抗氧化功能相关基因的表达情况,结果显示,与对照组相比,饲粮中添加400、800 mg/kg植物乳杆菌可显著提高21日龄肝脏SOD的mRNA相对表达量,对肝脏Nrf2的mRNA相对表达量无显著影响,与前人在肉鸡中使用植物乳杆菌得出的结果[30]不一致。Wang等[32]的研究结果从蛋白质层面揭示了植物乳杆菌ZLP001通过促进胞质中的Nrf2向细胞核转移,从而调节细胞氧化还原状态,而非促进Nrf2的转录。对植物乳杆菌MA2的体外研究发现,其发酵液具有很强的还原能力、二价铁离子(Fe2+)螯合能力以及清除各种自由基的能力,此外,发酵的上清液和细胞匀浆中均可检测到抗氧化酶GSH-Px和SOD[33]。还有大量研究表明,植物乳杆菌分泌的胞外多糖(exopolysaccharides,EPS)可提高细胞中SOD、CAT等抗氧化酶活性[34-36]。因此,除了通过促进Nrf2表达外,植物乳杆菌还可能通过促进Nrf2在细胞中的转移、释放小分子抗氧化物质、螯合过渡金属氧化物等多种途径,改善动物抗氧化功能[37-38],或是通过作用于沉默信息调节因子1(silent information regulator 1,Sirt1)、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和蛋白激酶C(protein kinase C,PKC)等其他信号通路激活机体的抗氧化系统[39-41]。本研究中使用的植物乳杆菌对北京鸭抗氧化功能的调节机制还需要进一步研究。 饲粮中添加植物乳杆菌可通过减少合成、增强排泄机制改善北京鸭的脂质代谢,同时提高其抗氧化功能。基于本试验结果及经济成本,推荐北京鸭饲粮中植物乳杆菌添加剂量为400 mg/kg。
2 结 果
2.1 植物乳杆菌对北京鸭腹脂率及血脂指标的影响
2.2 植物乳杆菌对北京鸭肝脏脂质代谢相关基因表达的影响
2.3 植物乳杆菌对北京鸭血清、肝脏及回肠抗氧化指标的影响



2.4 植物乳杆菌对北京鸭肝脏抗氧化功能相关基因表达的影响
3 讨 论
3.1 植物乳杆菌对北京鸭脂质代谢的影响
3.2 植物乳杆菌对北京鸭抗氧化功能的影响
4 结 论

