不同硒源对黄羽肉鸡生长性能和肠道形态及抗氧化功能、免疫功能和细胞凋亡的影响
沈雨甜 张小东 张 玲 王永侠*
(1.浙江农林大学动物科技学院·动物医学院,临安311300;2.安徽农业大学动物科技学院,合肥230036)
肠道是动物体重要的消化器官,是消化食物和吸收营养物质的主要场所[1]。同时,肠道又是机体十分重要的防御屏障,可有效阻止细菌及内毒素等有害物质透过肠黏膜进入体循环,从而减少机体炎症反应的发生[2]。肠道功能受损可引起肠道菌群紊乱、蠕动减弱和免疫力降低及肠黏膜通透性升高,从而导致肠道消化吸收功能降低和炎症反应发生,最终造成畜禽生长性能下降[3-5]。因此,维护肠道健康对于促进营养物质的消化吸收及提高动物生产性能和养殖效益具有重要的意义。
饲粮中添加的硒源主要分为无机硒和有机硒,常用无机硒源为亚硒酸钠(sodium selenite, SS),有机硒源为酵母硒(selenium yeast,SY)。范秋丽等[6]研究表明,SY较SS可显著降低21日龄黄羽肉鸡空肠黏膜丙二醛(malondialdehyde,MDA)含量。Lynch等[7]的研究发现,SY减轻镉诱导的猪空肠上皮细胞DNA损伤的效果优于SS。Muhammad等[8]在23周龄罗曼蛋鸡饲粮中添加SS和SY进行16周的饲养试验,结果发现,SY较SS显著提高了回肠绒毛高度(villus height,VH)和空肠绒毛高度与隐窝深度的比值(villus height/crypt depth ratio,V/C)。
酵母硒的主效成分为硒代蛋氨酸(selenomethionine,SM),但含量不稳定[9]。因此,近年来化工合成的SM产品逐渐应用到饲粮中。与SS相比,SM在动物体内具有吸收率高、生物活性强、毒性低、抗氧化功能强和环境污染小等特点[10-11]。已有研究结果表明,SM在提高肉鸡肝脏、肾脏、胰脏和肌肉的抗氧化能力方面优于SS[12-14],而SM与肉鸡肠道抗氧化、免疫和细胞凋亡之间的关系却鲜有报道。为此,本试验以岭南黄鸡为研究对象,以无机硒源SS为对照,研究SM对肉鸡生长性能和肠道组织形态及抗氧化功能、免疫功能和细胞凋亡的影响,为SM在肉鸡生产上的应用提供理论依据。
1 材料与方法
1.1 试验材料
亚硒酸钠(货号:10102-18-8),纯度99%,购自某化学试剂有限公司;SM(货号:259960000),纯度99%,购自北京某科技有限公司。
1.2 试验设计与饲粮
1.2.1 试验设计
本试验经浙江农林大学动物伦理委员会批准,该委员会按照试验动物护理和使用指南来管理试验过程中所有动物的使用。选取1日龄体重相近的岭南黄肉雏鸡(购自浙江群大畜牧养殖有限公司)540只,按照单因素试验设计随机分为3组,每组6个重复,每个重复30只鸡(公母各占1/2)。试验分组如下:对照组(CON组),饲喂基础饲粮;SS组和SM组分别饲喂在基础饲粮中添加0.15 mg/kg(以硒计)SS和SM的试验饲粮,SS和SM的添加剂量根据本课题组前期的试验结果[13,15]确定。饲养试验为期56 d,分为1~21日龄和22~56日龄2个饲养阶段。
1.2.2 基础饲粮
基础饲粮参照我国农业行业标准《黄羽肉鸡营养需要量》(NY/T 3645—2020)[16]进行配制,其组成及营养水平见表1。
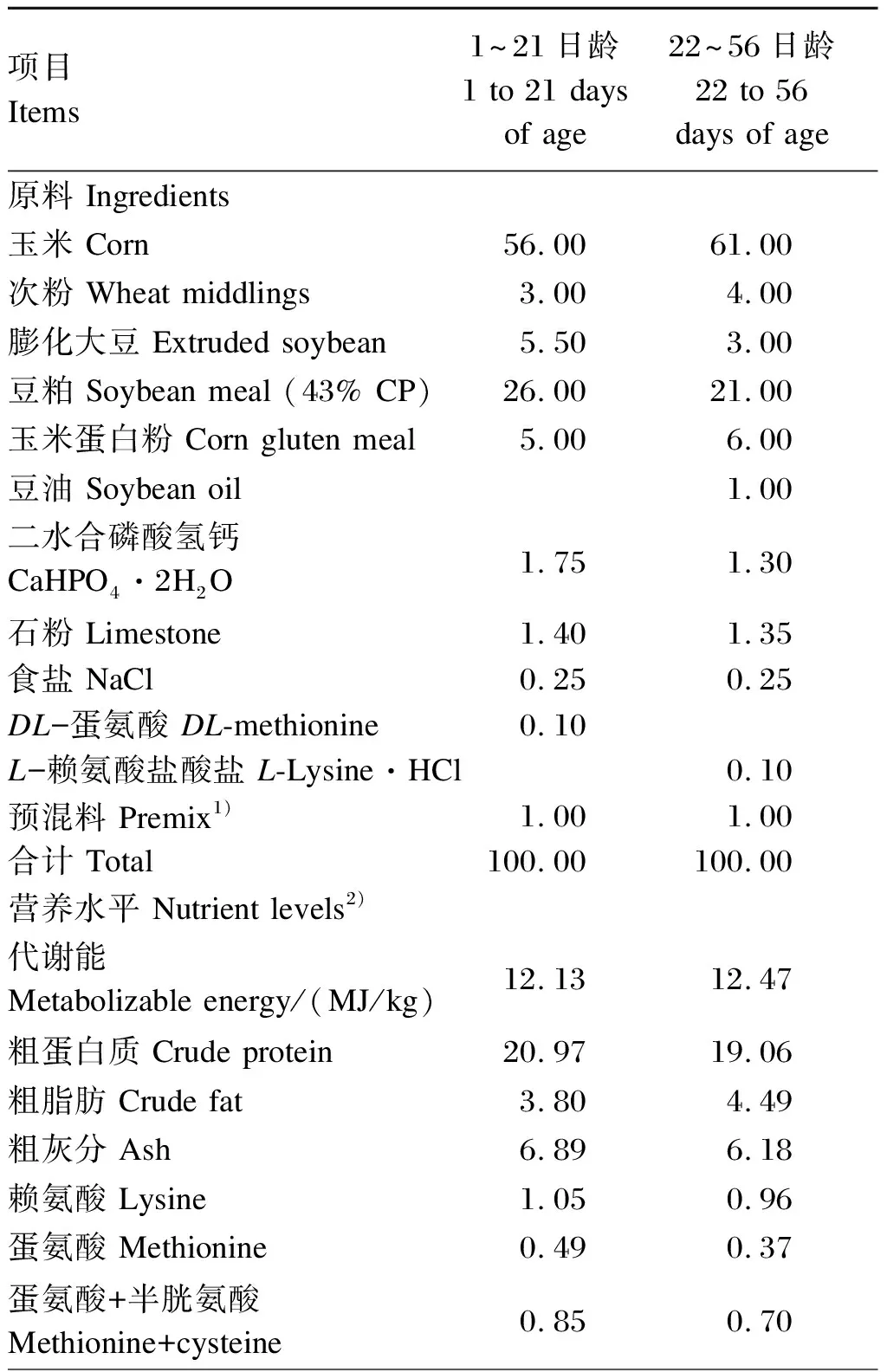
表1 基础饲粮组成及营养水平(风干基础)

续表1项目Items1~21日龄1 to 21 days of age22~56日龄22 to 56 days of age钙 Calcium 1.02 0.88总磷 Total phosphorus 0.65 0.58非植酸磷 Nonphytate phosphorus 0.44 0.36
1.2.3 饲粮硒含量测定
准确称取饲粮样品2.0 g,根据GB/T 13883—2008的方法处理样品,采用氢化物原子荧光光谱法测定饲粮中硒含量,所用仪器为AF-610A型原子荧光光度计(北京北分瑞利分析仪器有限责任公司)。每个样品6个重复。各组饲粮中硒含量见表2。
1.3 饲养管理
试验鸡采用网上平养,自由采食和饮水,按正常免疫程序免疫,其他饲养管理按照常规程序进行。每日以重复为单位记录耗料量和死淘鸡数。于1、21和56日龄以重复为单位对空腹12 h肉鸡称重,并准确统计各重复各阶段的耗料量和死亡数,同时以重复单位计算1~21日龄、22~56日龄和1~56日龄的平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。

表2 各组饲粮中硒含量(实测值)
1.4 样品采集与指标测定
1.4.1 样品采集
饲养试验结束后,每组选取12只体重接近平均体重的健康公鸡(每重复2只),共计36只,给水不给料,禁食12 h,翅静脉采血于促凝管中,3 000 r/min(4 ℃)离心10 min制备血清。采血后,用戊巴比妥钠(50 mg/kg)对鸡进行麻醉并解剖,打开腹腔,将消化道取出,按组织学把小肠分为十二指肠、空肠和回肠。取十二指肠和空肠中段约2 cm,用预冷的生理盐水将其冲洗干净,而后平铺在滤纸上将液体吸干,置于4%多聚甲醛溶液固定。剩余十二指肠和空肠肠段迅速取黏膜。血清和肠黏膜样品于-80 ℃保存,用于后续指标的测定。
1.4.2 肠道形态的测定
取出经4%多聚甲醛溶液固定后的十二指肠和空肠样品,经脱水、石蜡包埋、修块、切片、苏木精-伊红(HE)染色及封片固定后放于光学显微镜下拍照,用Image软件测量VH和隐窝深度(crypt depth,CD),每张切片选取5根完整肠绒毛测量VH和其对应位置CD,并计算V/C。
1.4.3 抗氧化指标的测定
用商品化试剂盒(南京建成生物工程研究所)测定十二指肠和空肠黏膜NAD(P)H:醌氧化还原酶1[NAD(P)H:dehydrogenase quinone 1,NQO1]、硫氧还蛋白还原酶(thioredoxin reductase,TrxR)、血红素加氧酶-1(heme oxygenase-1,HO-1)、过氧化氢酶(catalase,CAT)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)活性,具体操作步骤按照试剂盒说明书严格执行。
1.4.4 氧化损伤指标的测定
采用商品化试剂盒(南京建成生物工程研究所)测定十二指肠和空肠黏膜蛋白羰基(protein carbonyl,PC)、MDA和8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)含量,操作步骤按照试剂盒说明书进行。
1.4.5 免疫指标的测定
采用酶联免疫吸附试验(ELISA)法测定血清中免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)和免疫球蛋白G(immunoglobulin G,IgG)含量及十二指肠和空肠黏膜分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)含量,所用试剂盒购自北京方程生物科技有限公司。
1.4.6 细胞凋亡指标的测定
采用ELISA法测定十二指肠和空肠黏膜半胱氨酸天冬氨酸蛋白酶-3(cysteine-aspartic acid protease-3,Caspase-3)和B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的含量,所用试剂盒购自圣地亚哥生物技术公司。
1.4.7 肠黏膜蛋白含量的测定
十二指肠和空肠黏膜蛋白含量测定采用南京建成生物工程研究所生产的试剂盒以考马斯亮兰法测定。
1.5 数据统计与分析
试验数据采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,结果以平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 不同硒源对黄羽肉鸡生长性能的影响
由表3可知,各组之间肉鸡各生长阶段ADFI均无显著差异(P>0.05)。与CON组相比,饲粮中添加SS可显著提高56日龄肉鸡均重及22~56日龄和1~56日龄肉鸡ADG(P<0.05);饲粮中添加SM可显著提高21和56日龄肉鸡体重及各生长阶段肉鸡ADG(P<0.05),并显著降低各生长阶段肉鸡F/G(P<0.05)。此外,SM组56日龄肉鸡体重及22~56日龄和1~56日龄肉鸡ADG较SS组显著提高(P<0.05),22~56日龄和1~56日龄肉鸡F/G较SS组显著降低(P<0.05)。

表3 不同硒源对黄羽肉鸡生长性能的影响
2.2 不同硒源对黄羽肉鸡肠道形态的影响
各组肉鸡肠道组织切片见图1。由表4可知,与CON组相比,饲粮添加SS和SM均显著提高了十二指肠和空肠VH和V/C(P<0.05),显著降低了十二指肠和空肠CD(P<0.05)。与SS组相比,SM组十二指肠V/C以及空肠VH和V/C显著提高(P<0.05),空肠CD显著降低(P<0.05)。

A:十二指肠 duodenum;B:空肠 jejunum。
2.3 不同硒源对黄羽肉鸡肠黏膜抗氧化指标的影响
由表5可知,与CON组相比,SS组和SM组十二指肠和空肠黏膜GPx和TrxR活性显著提高(P<0.05)。SM组空肠黏膜GPx和TrxR活性显著低于SS组(P<0.05)。SS组十二指肠黏膜HO-1和CAT活性及空肠黏膜NQO1活性显著高于CON组(P<0.05)。SM组十二指肠和空肠黏膜NQO1、HO-1、CAT和T-SOD活性比CON组显著提高(P<0.05)。SM组十二指肠和空肠黏膜NQO1和CAT活性及十二指肠黏膜HO-1和T-SOD活性较SS组显著提高(P<0.05)。
2.4 不同硒源对黄羽肉鸡肠黏膜氧化损伤指标的影响
由表6可知,与CON组相比,SS组十二指肠和空肠黏膜MDA和PC含量及十二指肠黏膜8-OHdG含量显著降低(P<0.05)。SM组十二指肠和空肠黏膜MDA、PC和8-OHdG含量显著低于SS组和CON组(P<0.05)。

表4 不同硒源对黄羽肉鸡肠道形态的影响

表5 不同硒源对黄羽肉鸡肠黏膜抗氧化指标的影响
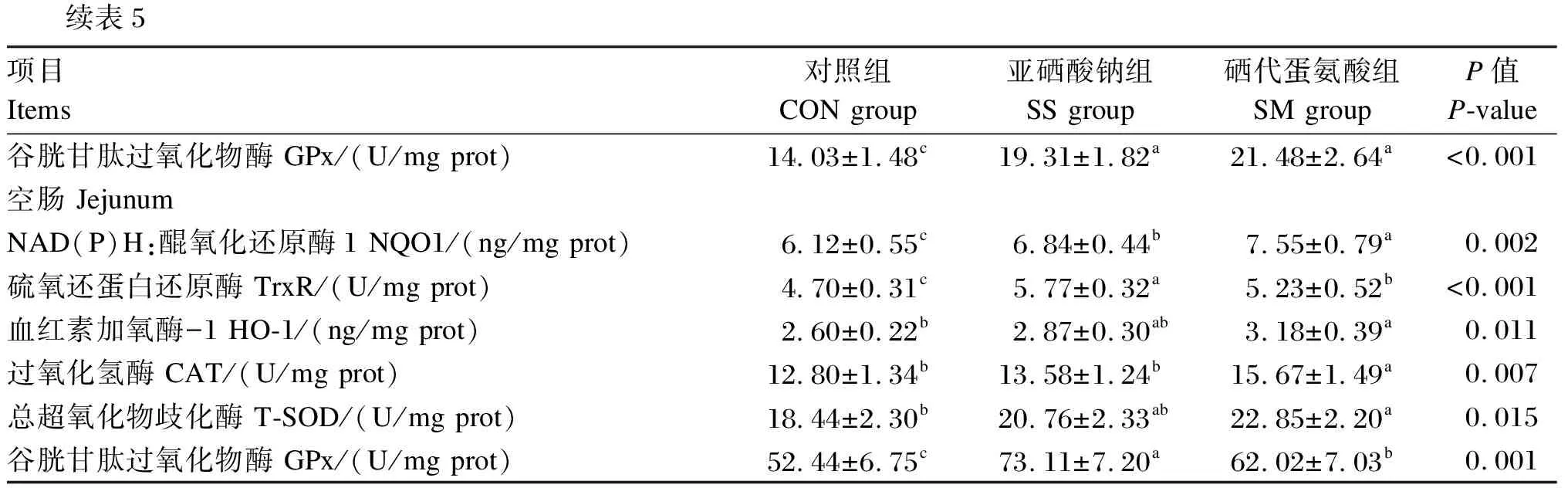
续表5项目Items对照组CON group亚硒酸钠组SS group硒代蛋氨酸组SM groupP值P-value谷胱甘肽过氧化物酶 GPx/(U/mg prot)14.03±1.48c19.31±1.82a21.48±2.64a<0.001空肠 JejunumNAD(P)H:醌氧化还原酶1 NQO1/(ng/mg prot)6.12±0.55c6.84±0.44b7.55±0.79a0.002硫氧还蛋白还原酶 TrxR/(U/mg prot)4.70±0.31c5.77±0.32a5.23±0.52b<0.001血红素加氧酶-1 HO-1/(ng/mg prot)2.60±0.22b2.87±0.30ab3.18±0.39a0.011过氧化氢酶 CAT/(U/mg prot)12.80±1.34b13.58±1.24b15.67±1.49a0.007总超氧化物歧化酶 T-SOD/(U/mg prot)18.44±2.30b20.76±2.33ab22.85±2.20a0.015谷胱甘肽过氧化物酶 GPx/(U/mg prot)52.44±6.75c73.11±7.20a62.02±7.03b0.001
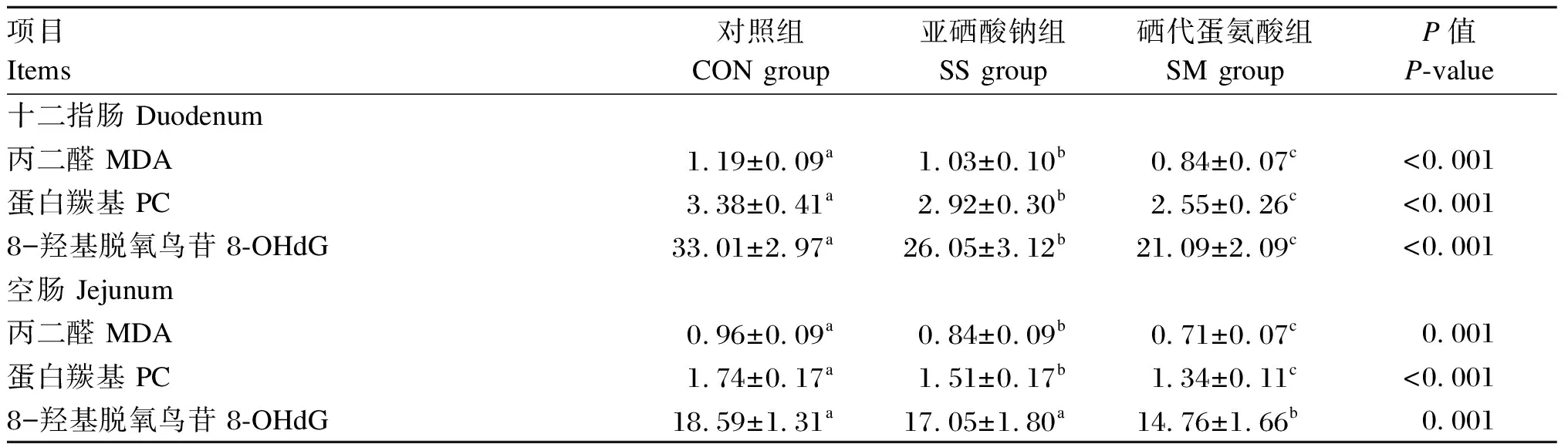
表6 不同硒源对黄羽肉鸡肠黏膜氧化损伤指标的影响
2.5 不同硒源对黄羽肉鸡血清和肠黏膜免疫指标的影响
由表7可知,与CON组相比,SS组血清IgA和IgG含量及空肠黏膜sIgA含量显著增加(P<0.05)。SM组血清IgA、IgM和IgG含量及十二指肠和空肠黏膜sIgA含量较CON组和SS组显著增加(P<0.05)。
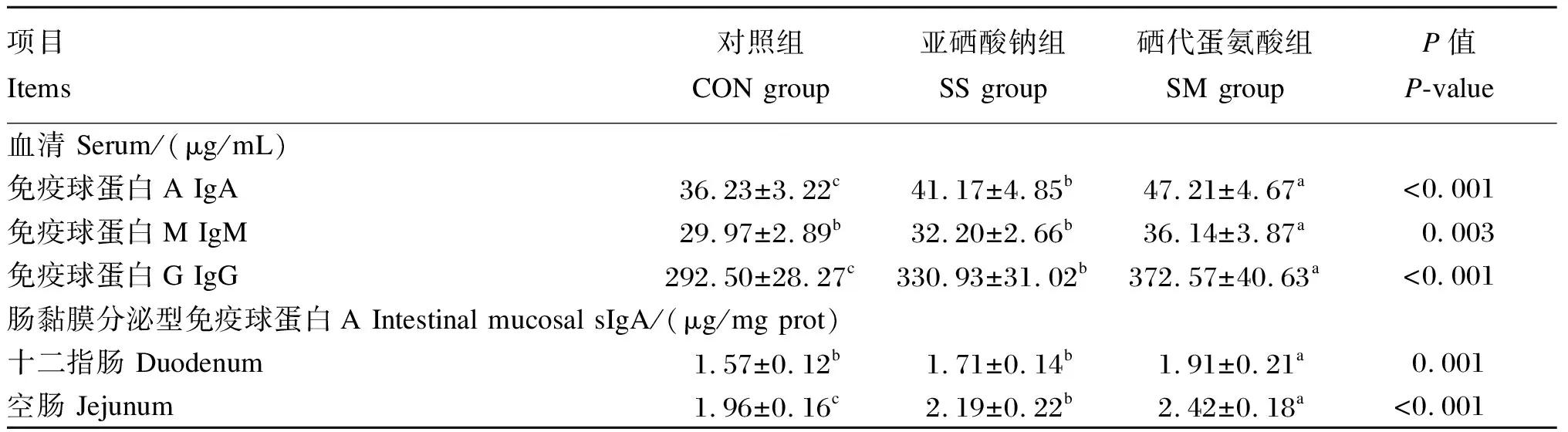
表7 不同硒源对黄羽肉鸡血清和肠黏膜免疫指标的影响
2.6 不同硒源对黄羽肉鸡肠黏膜细胞凋亡指标的影响
由表8可知,与CON组相比,SS组十二指肠黏膜Caspase-3含量显著降低(P<0.05),空肠Bcl-2含量显著提高(P<0.05);SM组十二指肠和空肠黏膜Caspase-3含量显著降低(P<0.05),十二指肠和空肠黏膜Bcl-2含量显著提高(P<0.05)。与SS组相比,SM组十二指肠和空肠黏膜Bcl-2含量显著提高(P<0.05),空肠黏膜Caspase-3含量显著降低(P<0.05)。

表8 不同硒源对肉鸡肠黏膜细胞凋亡指标的影响
3 讨 论
3.1 不同硒源对黄羽肉鸡生长性能的影响
硒是动物生长必需的微量元素,饲粮中补硒可提高动物的生产性能[17]。本试验结果发现,饲粮添加SS和SM显著提高了22~56日龄和1~56日龄黄羽肉鸡的ADG,添加SM还显著降低了各生长阶段黄羽肉鸡的F/G。李建柱等[18]在饲粮中添加0.2 mg/kg的SS和SY进行9周的饲养试验,发现SY组淮南麻鸭的ADG较SS组显著提高。Arnaut等[19]在科宝肉鸡上的研究发现,与SS组相比,SY组ADG显著提高。本试验结果表明,SM组与SS组22~56日龄和1~56日龄黄羽肉鸡ADG及F/G的差异达到显著水平,这与以上研究结果大体一致。造成此结果的原因在于SM较SS显著提高了肠黏膜抗氧化和免疫功能,减轻了肠黏膜氧化损伤和细胞凋亡,改善了肠道形态,进而可能促进了营养物质的消化和吸收,导致了生长性能的提高。
3.2 不同硒源对黄羽肉鸡肠道形态的影响
小肠是消化食物和吸收营养物质的主要场所,其VH、CD和V/C是衡量小肠消化吸收功能的重要指标。在本试验中,与CON组相比,饲粮中添加SS或SM均显著提高了十二指肠和空肠VH和V/C,显著降低了十二指肠和空肠CD,这与He等[20]的研究结果相似。Muhammad等[8]研究表明,与SS组相比,SY组39周龄罗曼蛋鸡回肠VH和空肠V/C显著提高。本试验结果与上述试验结果基本一致,本研究发现,与SS组相比,SM组十二指肠V/C以及空肠VH和V/C显著提高,空肠CD显著降低。对此结果的解释是SM比SS减轻了肠黏膜细胞凋亡,进而引起肠道VH和V/C的升高及CD的降低。
3.3 不同硒源对黄羽肉鸡肠黏膜抗氧化指标的影响
硒在体内的生物学功能主要是以硒蛋白的形式表现,硒以硒代半胱氨酸(Sec)的形式共价结合在硒蛋白中[21]。目前在人和动物体内比较重要的抗氧化硒蛋白主要有GPx家族和TrxR家族[22]。GPx可特异性地清除有害的过氧化氢(H2O2),并阻止脂质过氧化物的形成[23]。TrxR具有抗氧化和还原核苷酸参与DNA合成等功能[24]。本试验结果表明,与CON组相比,饲粮中添加SS或SM均显著提高了十二指肠和空肠黏膜GPx和TrxR活性,这与前人研究报道[25-26]相似。另外,本试验结果还发现,在提高空肠黏膜GPx和TrxR活性方面,SS优于SM;但在提高十二指肠黏膜GPx和TrxR活性方面,SS与SM效果相当。这与前人试验结果[27-29]基本一致。无机硒在提高GPx和TrxR活性方面优于有机硒,其可能的原因有2种:1)不同硒源在体内均须转化为Sec后才能合成硒蛋白,而SS转化为Sec的效率显著高于SM[30],因此SS合成硒蛋白的效率更高;2)蛋氨酸(Met)-tRNA无法区分SM和Met化学形式上的不同,使得SM可直接替代Met用于机体蛋白质合成[9]。White等[31]的研究发现,SM中的硒小鼠成纤维细胞中首先合成体蛋白质然后再合成硒蛋白,而SS中的硒则以很快的速度直接合成硒蛋白。因此,SM和Met竞争性的合成体蛋白质也影响SM合成硒蛋白的效率。
超氧化物歧化酶(SOD)可催化超氧阴离子转化为H2O2和氧(O2);CAT可分解H2O2产生O2和H2O;NQO1可阻止环境胁迫剂对DNA造成的氧化损伤,还可通过维持泛醌和α-生育酚的还原形式,保护体内内源性抗氧化剂[32];HO-1是一种抗炎、抗氧化和具有神经保护作用的诱导酶[32];SOD、CAT、NQO1和HO-1活性的提高均可增强机体的抗氧化能力。本试验结果显示,从综合效果来看,饲粮中添加SS和SM均可提高十二指肠和空肠黏膜T-SOD、CAT、NQO1和HO-1活性,且以SM效果较佳,这与前人研究报道[33-34]基本一致。由此可见,本试验条件下饲粮中补硒可提高黄羽肉鸡肠道抗氧化能力,且SM的效果优于SS。补硒能提高肠道抗氧化能力的原因在于补硒可增加肠黏膜硒沉积。因为硒是GPx和TrxR的活性成分,补硒直接导致GPx和TrxR活性升高,进而使H2O2和其他活性氧自由基(ROS)的降解作用加强,节省了SOD、CAT、NQO1和HO-1,最终提高了肠道的抗氧化能力。有机硒在提高肠道抗氧化能力方面优于无机硒,可能原因是SM较SS显著激活了抗氧化相关信号通路,但具体的作用机理还有待进一步研究。
3.4 不同硒源对黄羽肉鸡肠黏膜氧化损伤的影响
PC、8-OHdG和MDA分别是蛋白质、DNA和脂质氧化损伤的产物[35]。在本研究中,补硒降低了黄羽肉鸡十二指肠和空肠黏膜PC、8-OHdG和MDA含量,这与前人研究报道[36-37]一致。鞠耿越[38]在江南白鹅上的研究显示,SM组肝脏和血浆MDA含量极显著低于SS组。在本试验中,与SS组相比,SM组十二指肠和空肠黏膜PC、8-OHdG和MDA含量显著降低,这与上述试验结果一致。本试验结果提示,SM较SS降低十二指肠和空肠黏膜氧化损伤,这与SM较SS能提高肠黏膜的抗氧化功能有关。
3.5 不同硒源对黄羽肉鸡血清和肠黏膜免疫指标的影响
硒是优化免疫应答的重要元素之一,可促进免疫器官的生长发育和淋巴细胞的增殖及免疫球蛋白的合成[39]。在本研究中,2个补硒组黄羽肉鸡血清IgA和IgG含量及空肠黏膜sIgA含量显著高于CON组,这与前人试验结果[20,40]一致。此外,本试验数据还显示,SM组黄羽肉鸡血清IgA、IgM和IgG含量及十二指肠和空肠黏膜sIgA含量均显著高于SS组,这表明,在提高肉鸡肠黏膜免疫功能方面,SM的效果优于SS。当机体内活化的免疫细胞代谢增加时,产生的ROS增多。过多的ROS又可损伤免疫活性细胞,降低免疫功能,因此需要强大的抗氧化系统清除ROS。SM比SS能显著增强肠黏膜抗氧化能力,进而提高肠黏膜免疫力。
3.6 不同硒源对黄羽肉鸡肠黏膜细胞凋亡指标的影响
Caspase-3可通过对蛋白激酶、核酸酶及细胞骨架的裂解,激活特定信号系统,使细胞核皱缩,导致细胞凋亡[41]。Bcl-2可抑制细胞凋亡,能增强细胞对大多数DNA损伤因子的抵抗性[42]。本研究结果显示,补硒显著降低了黄羽肉鸡十二指肠黏膜Caspase-3含量,提高了空肠黏膜Bcl-2含量,这与前人研究结果[43-44]相似。此外,本研究结果还发现,与SS相比,SM显著提高了十二指肠和空肠黏膜Bcl-2含量及降低了空肠黏膜Caspase-3含量。本试验结果提示,在降低十二指肠和空肠黏膜细胞凋亡方面,SM效果优于SS,推测与SM较SS能提高肠黏膜的抗氧化能力和免疫功能有关。因为肠黏膜抗氧化能力和免疫功能下降会导致ROS过量蓄积,诱发细胞毒性和DNA损伤,导致细胞凋亡[45]。
4 结 论
本试验条件下,饲粮添加SM和SS均可提高黄羽肉鸡的生长性能,改善肠道形态,增强肠道抗氧化功能和免疫功能,减少肠道氧化损伤和细胞凋亡,且SM效果优于SS。

