miR-301b对山羊肌内脂肪细胞分化的调控作用
张浩 何长晟 李艳艳 王永 朱江江 俄木曲者 林亚秋
(1.青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041;2.西南民族大学畜牧兽医学院,成都 610041;3.四川省畜牧科学研究院 动物遗传育种重点实验室,成都 610066)
脂肪组织是体内重要的能量存储场所,但过多的脂肪会破坏人体的能量平衡,增加患II型糖尿病、高血脂、脂肪肝以及其他代谢疾病的风险。畜禽养殖过程中脂质代谢的调节可增加胴体的瘦肉率并改善肉的嫩度和风味。山羊作为家养动物是肉类的主要来源之一,与牛肉、猪肉相比,羊肉具有独特的风味,受到消费者的广泛推崇。羊肉的脂肪含量不仅影响羊肉的肉质,还直接关系到经济价值,因此阐明脂肪沉积的分子机制是进行分子育种的关键环节之一。研究表明,动物脂肪细胞分化不仅受功能基因的调控,还受非编码基因如miRNAs的调控[1-3]。microRNAs(miRNAs)于1993年首次在秀丽新小杆线虫中被发现[4],是物种间保守的内源性表达的非编码小分子RNA,长度一般在22 nt左右。miRNA通常与靶标基因的3′ UTR互补区结合,抑制靶基因的表达,在动物的生长发育、细胞增殖、细胞分化及细胞凋亡等过程中发挥重要调控作用[5-6]。
基于miRNA在转录调控中的重要作用,在动物脂肪沉积中的功能也被广泛关注。研究人员通过微阵列芯片在肉牛的肌内脂肪和皮下脂肪中发现了88个差异表达的 miRNA[7]。miR-130a靶向 PPARγ抑制脂质沉积[8],miR-130b通过抑制CYP2U1的表达抑制脂滴形成,miR-1271通过抑制ATF3的表达,提高PPARγ和C/EBPα的表达水平来促进脂质沉积[9]。另有研究对牛脂肪细胞分化前后的miRNA的表达进行分析,发现260个差异表达的miRNA,并且其靶基因与脂质代谢密切相关[10]。在产蛋后期母鸡和幼年母鸡的肌内脂肪细胞中也通过RNA-seq鉴定了104个差异表达miRNA[11]。对鸡腹脂衍生脂肪细胞测序也发现了33种差异表达的miRNA[12],在组织水平上通过对6、14、22、30 周龄的鸡腹脂测序,筛选到507种已知miRNA和53种新的miRNA,并发现miR-215-5p通过NCOA3抑制鸡腹脂形成[13]。在家兔的研究中发现,miR-130b可以抑制兔前体脂肪细胞的分化[14]。miR-301b是本实验室前期利用高通量测序筛选得到的调控山羊肌内脂肪细胞分化前后的差异miRNA,目前对其研究多集中于炎症反应[15]、癌症[16]、糖尿病心脏病[17]、细胞增殖[18]以及间充质干细胞的异常成脂分化[19],尚未见其在山羊脂肪细胞分化方面的报道。
根据本实验室前期对山羊肌内脂肪细胞油酸诱导分化前后测序结果,在分化0 d和2 d中差异表达的miRNA,筛选出表达水平差异上调的miR-301b作为研究对象。为了阐明miR-301b对山羊肌内脂肪细胞分化的调控作用,本实验以山羊肌内脂肪细胞为研究对象,通过过表达和干扰miR-301b明确其对脂肪细胞分化的影响,通过qPCR技术结合生物信息学分析来探究其发挥作用的可能调控机制,为山羊脂肪细胞分化的调控网络构建奠定基础。
1 材料与方法
1.1 材料
本试验以7 日龄简州大耳羊为试验对象,购买自四川省简阳大哥大牧业有限公司。取羔羊背最长肌分离原代前体脂肪细胞后液氮冻存。
Trizol 和 TB Green® Premix Ex TaqTMII购自 Ta-KaRa 公司,RevertAid First Stand cDNA Synthesis Kit、TurboFect Transfection Reagent和 Bodipy 购自 Thermo公司,油酸购自 Sigma 公司,DMEM/F12、胰酶、Opti-MEM、胎牛血清(FBS)和双抗购自Gibco,油红O 购自Solarbio 公司,甘油三酯(TG)测定试剂盒购自普利莱,引物由生工生物有限公司(成都)合成。
1.2 方法
1.2.1 细胞培养 取实验室前期冻存的山羊原代肌内脂肪细胞,37℃水浴迅速融化后转移至10 mL离心管中,加入7 mL含10% FBS的DMEM-F12完全培养基,1 000 r/min离心3 min弃去上清液,加入3 mL完全培养基重悬,并转移至10 cm培养皿中,补齐10 mL完全培养基,24 h贴壁后换液,后续每48 h换液。细胞生长至融合度约80%-90%传代,传代使用胰酶消化细胞。
1.2.2 细胞转染 根据miR-301b序列,由GenePharma公司合成miR-301b的mimics和inhibitor(表1),并按照TurboFect Transfection Reagent试剂说明书将mimics和inhibitor转染至约80%密度的F3代山羊原代肌内脂肪细胞中,转染12 h后更换为50 μmol/L 油酸诱导液,诱导分化48 h 后收集细胞样品。每个处理设置3个重复。

表1 miRNA mimic和 inhibitor序列Table 1 Sequences of miRNA mimic and inhibitor
1.2.3 甘油三酯测定 利用甘油三酯(TG)试剂盒测定甘油三酯合成情况,实验操作按照试剂盒说明书进行。
1.2.4 Bodipy和油红O染色 接种于24孔板的细胞转染后经诱导分化48 h后弃培养基,用PBS清洗3遍,并利用4%多聚甲醛固定30 min,弃去甲醛,PBS清洗3遍,油红O染色30 min,PBS清洗3遍,每孔保留约200 μL PBS,显微镜下观察脂滴分布并拍照。Bodipy避光染色后荧光显微镜下观察脂滴分布并拍照,染色步骤同油红O染色。
1.2.5 qPCR及数据分析 12孔板按照TRIzol的说明裂解细胞样品提取RNA,利用RevertAid First Stand cDNA Synthesis Kit将RNA样品反转录cDNA,5倍稀释后-20℃储存,分别以U6和UXT为内参基因,qPCR检测miR-301b和基因相对表达量,qPCR总 体 系 20 μL,TB Green®Premix Ex TaqTMII 10 μL,10 μmol/L 上下游引物各 1 μL,cDNA 1 μL,ddH2O 7 μL,引物信息如表2,用2-ΔΔCt法处理数据。
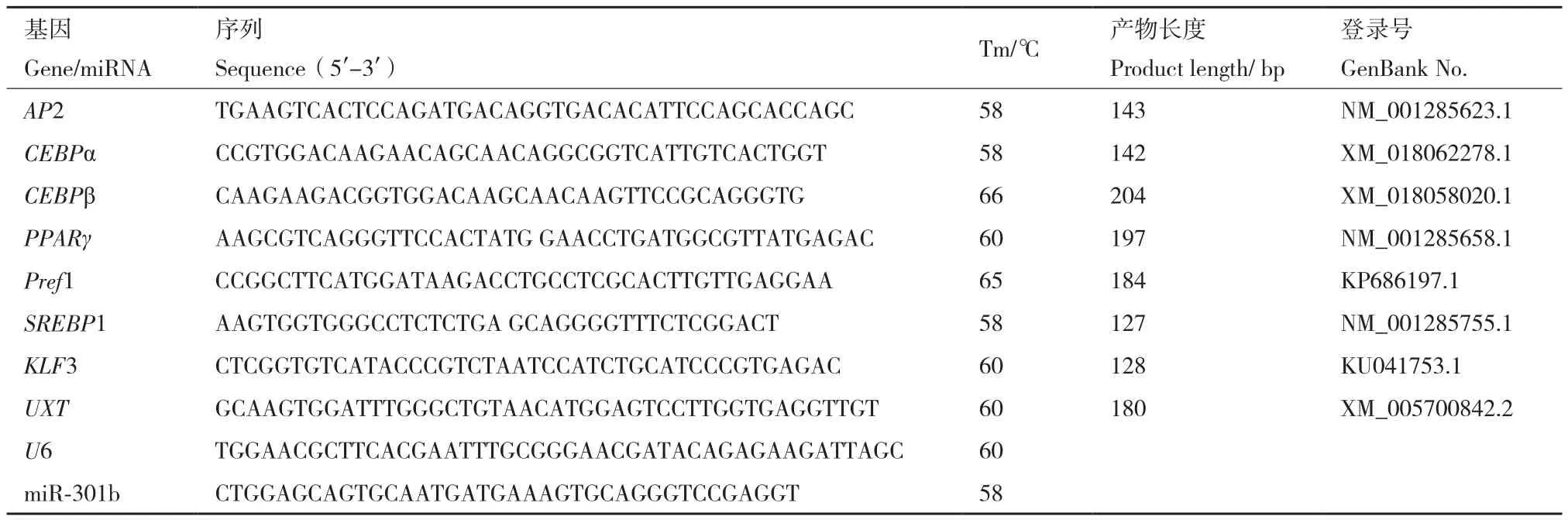
表2 特异性引物序列信息Table 2 Sequences information of specific primers
2 结果
2.1 过表达miR-301b对山羊肌内脂肪细胞分化的影响
利用qPCR 技术检测山羊肌内脂肪细胞转染miR-301b-mimics 的效率,结果(图1-A)显示,相比对照组,miR-301b-mimics组中miR-301b的相对表达水平升高29 290倍(P<0.01)。
2.1.1 细胞形态学观察及甘油三酯含量测定 通过油红O和Bodipy染色法观察细胞形态学变化,发现过表达miR-301b后山羊肌内脂肪细胞内脂滴积累减少(图1-B)。油红O染色量化结果(图1-C)显示,miR-301b-mimics 组OD490值显著低于NC组(P<0.01),此外TG测定结果(图1-D)显示miR-301b-mimics 组的甘油三酯含量极显著低于NC 组(P<0.01)。
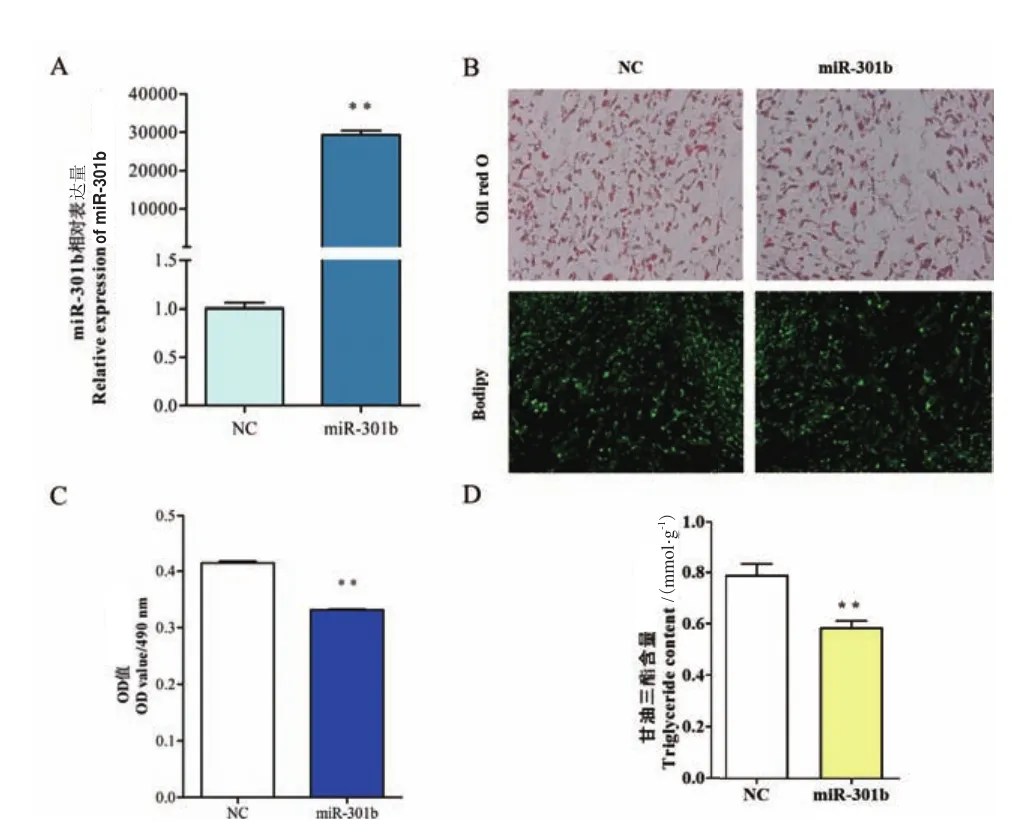
图1 过表达miR-301b对山羊肌内脂肪细胞形态学影响Fig.1 Effect of overexpressing miR-301b on the morphology of goat intramuscular adipocytes
2.1.2 qPCR检测脂肪细胞分化标志基因mRNA表达水平 结果(图2)显示,过表达miR-301b后,与 NC 组比较 CEBPα、PPARγ、SREBP1、LPL极显著降低(P<0.01),与细胞形态学观察得到的结果相一致,然而CEBPβ极显著上调(P<0.01),相对表达量上升了4倍,AP2的相对表达水平未发生显著性变化(P>0.05)。
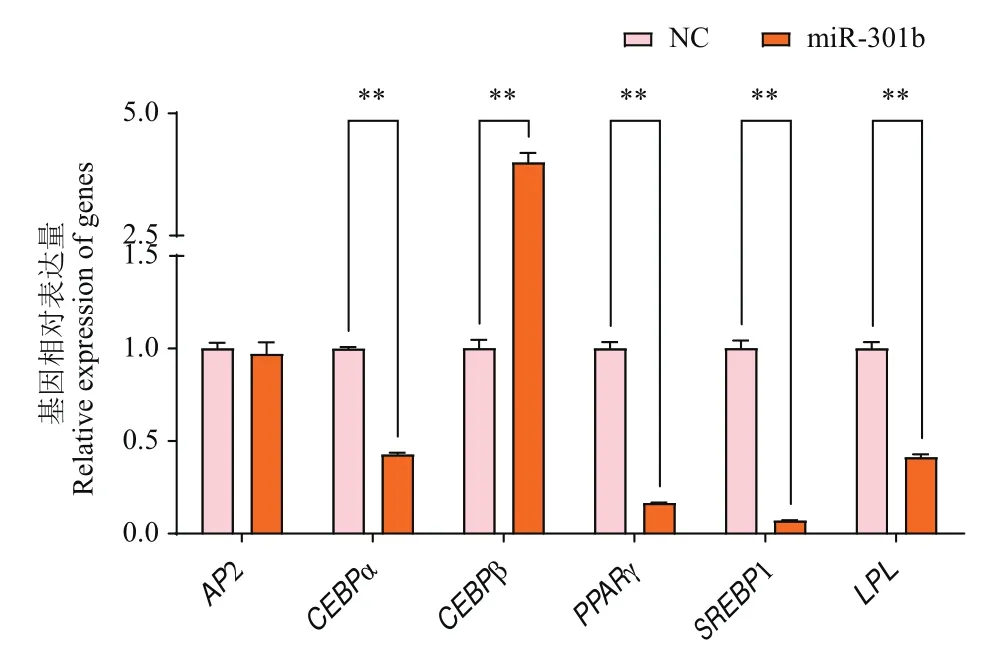
图2 miR-301b 山羊对肌内脂肪细胞分化标志基因表达的影响Fig.2 Effects of miR-301b goat on the expressions of differentiation marker genes of intramuscular adipocytes
2.2 干扰miR-301b表达对山羊肌内脂肪细胞分化的影响
成功在山羊肌内脂肪细胞中干扰miR-301b的表达,并且干扰效率达到60%,极显著低于对照组(图3-A)(P<0.01)。
2.2.1 细胞形态学观察及甘油三酯含量测定 油红O 和Bodipy染色结果(图3-B)均表明,干扰miR-301b表达促进脂质在细胞内积聚。油红O染色结果量化数据显示,与NC 组对比,in-miR-301b组(干扰miR-301b组)的OD490值显著上调(P<0.01)(图3-C),甘油三酯含量也增长了1.31倍(图3-D)(P<0.01)。

图3 干扰miR-301b 对山羊肌内脂肪细胞形态学影响Fig.3 Effect of interfering miR-301b on the morphology of goat intramuscular adipocytes
2.2.2 qPCR检测脂肪细胞分化标志基因mRNA表达水平 为进一步解释山羊肌内脂肪细胞中干扰miR-301b表达对分化影响的机制,检测脂肪细胞分化相关基因mRNA的表达水平。结果(图4)显示,干扰 miR-301b 表达后 AP2、CEBPα、CEBPβ、SREBP1和LPL的表达水平极显著上调(P<0.01),PPARγ显著上调(P<0.05)。

图4 干扰miR-301b 山羊对肌内脂肪细胞分化标志基因表达的影响Fig.4 Effect of interferring mir-301b goat on the expression of differentiation marker genes of intramuscular adipocytes
2.3 miR-301b靶基因预测及初步研究
利用Targetscan和miRDB并结合实验室前期转录组测序结果对miR-301b下游靶基因进行预测,使用Venny 2.1绘制韦恩图(图5-A),3种方法取交集得到392个潜在靶基因,其中包括CLIP1、GJA1、ACVR1、RPS6KA5、MDM4、PPARγ、KLF3和C/EBPα等。结合实验室前期研究结果,发现KLF家族对山羊脂肪细胞分化有重要的调控作用,KLF3可促进山羊脂肪细胞分化[20],通过TargetScan预测KLF3 3′UTR的miRNA结合位点,得到2个miR-301b的潜在结合位点(图5-B)。因此,本实验选定KLF3作为miR-301b的潜在靶基因,分别在过表达miR-301b和干扰miR-301b表达的样品中检测KLF3的表达,发现过表达miR-301b后显著抑制KLF3的mRNA表达水平(图5-C),而干扰miR-301b后,KLF3的mRNA水平得到了显著提升(图5-D)。
图5 miR-301b靶基因预测及表达水平检测Fig.5 Prediction and expression level detection of miR-301b target gene
3 讨论
脂肪细胞的分化是脂肪组织脂质积累的重要过程,在机体的能量稳态中发挥重要功能,同时在畜牧方面,脂肪含量对于胴体性状和肉质及其经济价值有着极大的影响。脂肪细胞分化过程是极复杂的生理进程,受多种转录因子和非编码RNA的严格调控[21-23],动物体内的miRNAs可以通过与不完全互补的靶mRNA结合来切割或抑制翻译,从而发挥重要的调节作用[24]。pre-miRNA通过裂解、转运和切割等方式修饰以产生成熟的miRNA[25],后者通过补充靶基因的3′UTR碱基来引导RNA诱导沉默复合物(RISC)切割靶mRNA结构域,从而降低靶mRNA的表达或抑制其翻译[26]。
本研究通过利用化学合成的mimics和inhibitor在体外培养的山羊肌内脂肪细胞中分别过表达和干扰miR-301b,探究miR-301b的调控作用。本研究发现,过表达miR-301b后,山羊肌内脂肪细胞的脂滴显著减少,成脂相关基因CEBPα、PPARγ、SREBP1、LPL的表达水平极显著降低,CEBPβ极显著升高。干扰miR-301b的表达后,山羊肌内脂肪细胞的脂滴显著增加成脂相关基因AP2、CEBPα、CEBPβ、SREBP1和LPL的表达水平极显著上升,PPARγ表达水平显著上升。PPARγ和CEBPα作为经典的成脂分化标志基因,在成脂分化过程中起着关键作用[27-29]。CEBPβ可以激活 CEBPα和 PPARγ并产生级联反应,快速激活成脂相关基因的表达[30]。结合本研究中,过表达和干扰miR-301b后,PPARγ与CEBPα的表达水平都发生了显著变化,因此推测miR301b可能是通过调控PPARγ与CEBPα的表达,从而抑制肌内脂肪细胞分化。而CEBPβ在过表达和干扰miR-301b的实验中,出现了一致的上升趋势,可能是由于CEBPβ在成脂分化过程中对PPARγ和CEBPα的调控作用,过表达miR-301b时,PPARγ和CEBPα的表达极显著下调,使得二者的调控因子CEBPβ期望对下调的趋势予以挽救,表达量极显著上升,因此在过表达miR-301b的标志基因中,CEBPβ呈现了与PPARγ和CEBPα相反的表达趋势。研究发现与miR-301b同家族的miR-301b-3p可以通过靶向CPEB3/EGFR轴,加速高级别卵巢浆液性肿瘤的迁移和侵袭[31]。在家兔前体脂肪细胞中的研究发现,过表达和干扰miR-130b抑制/促进分化和细胞内甘油三酯的积累,分别显著下调和上调PPARγ和CEBPα的表达[14],发现miR-130b通过抑制其靶基因PPARγ来减少猪脂肪沉积[32],而miR-301b与miR-130b属同一家族,具有相同的种子序列,其表达模式和生物学功能可能存在类似的地方。
miRNA作为生物发生过程中基因调控的关键调控因子,主要通过与靶基因的相互作用来调控脂肪细胞的分化,例如,miR-27b靶向LPL并抑制人脂肪干细胞(human adipose tissue-derived stem cell,hASC)分化[19]。miR-130a靶向 PPARγ抑制牛脂肪细胞的脂滴积聚[8],在肉牛脂肪细胞中,过表达miR-378表达,通过下调靶基因的表达水平,致使PPARγ和SREBP1的表达水平上升,从而促进脂肪细胞的成脂分化。在固始鸡的皮下脂肪细胞中,miR-215-5p靶向NCOA3抑制脂肪细胞的增殖和分化[13],miR-206靶向KLF4抑制猪脂肪细胞的分化[33],miR-106b-5p靶向KLF4负向调控山羊脂肪细胞分化[34]。以上研究表明miRNA在不同物种中主要通过靶向基因发挥调控作用,因此本实验通过Targetscan、miRDB预测并结合实验室前期转录组测序结果对miR-301b下游靶基因进行预测,发现miR-301b靶标基因包括KLF3。此前已有报道miR-324-5p靶向KLF3促进猪的脂肪细胞分化和脂肪沉积[35]。本实验室致力于探究KLF家族基因在山羊脂质沉积中的作用,且前期研究发现KLF3是山羊皮下脂肪细胞分化的正向调控因子[20],因此我们选择KLF3作为研究对象。过表达miR-301b可以极显著降低KLF3的mRNA表达水平,同时干扰miR-301b可以极显著提高KLF3的表达水平,推测miR-301b与KLF3之间的表达存在着调控关系。本研究从实验水平推测KLF3可能为miR-301b的靶标基因,但二者之间具体的结合关系是本实验下一步研究的重点,拟利用双荧光素酶报告实验明确其靶标关系。
4 结论
本研究以实验室前期通过RNA-Seq筛选得到的山羊肌内脂肪细胞分化差异miR-301b为研究切入点。miR-301b是一个山羊肌内脂肪沉积的负调节因子。推测miR-301b可能通过靶向KLF3抑制山羊肌内脂肪细胞分化。

