电离辐射诱发癌症的线性无阈模型研究动态
刘晓明,武晓燕,马跃峰,张艳娜,薛向明,古晓娜,战景明,刘占旗,边林秀
(1.中国辐射防护研究院,太原 030006;2.山西省疾病预防控制中心,太原 030012)
电离辐射诱发癌症的线性无阈模型(the linear non threshold,LNT)认为“无论多么小的辐射,都会增加人类患癌风险,且随着累积剂量的增加,风险被假设为呈线性增加[1]。LNT已持续70多年,是目前应用最广泛的辐射风险评估模型,并得到了美国国家科学院(NRC)[2]、国际放射防护委员会(ICRP)[3]等多个机构推荐。LNT也是国际社会核与辐射防护监管的基础及依据。然而,近年来,LNT风险模型的有效性越来越受到质疑[4],且认为基于LNT的法规体系给社会带来了过度的成本[1]。因此,2018年美国环保部(EPA)开始讨论如何脱离LNT[5]。本文通过对近期国际社会有关LNT文献研读,以探讨LNT发展动向及进一步研究方向,为国内相关领域工作开展提供借鉴。
1 线性无阀假说起源及现状
在20世纪早期的几十年里,公认的辐射剂量-效应关系有一个阈值[6],低于剂量阈值时没有辐射风险[7]。1934—1956年间,美国工人的容许辐射剂量一直保持在500 mGy/a[8],是目前职业接触限值(20 mSv/a)的25倍,一般公众接触限值(1 mSv/a)的500倍。日本原子弹爆炸后,美国国家科学院(NAS)推荐使用线性无阈模型(LNT),并作为辐射防护基础在ICRP 18号出物后广泛被接受。2006年,NAS根据广岛和长崎原子弹幸存者寿命研究报告重申了对LNT的支持[2];2018年,美国国家辐射防护和测量委员会(NCRP)发表了27号报告,对暴露于低剂量及低剂量率范围人群相关的29项辐射流行病学研究进行了批判性审查,结论认为:为辐射防护目的,近年来的多数流行病学研究支持继续采用LNT[9],NCRP认为“在辐射保护方面,没有任何剂量效应模型比LNT模型更务实或更谨慎”[10]。
2 线性无阈模型面临的挑战
2.1 辐射流行病学数据
有研究认为,20世纪50年代末提出的LNT模式为”0”假设模型,即”LNT”模型首先被假设LNT是正确的,若推翻LNT模型则需证明其是错误的。然而由于辐射致癌性较弱,到目前为止,不论大型辐射事故或原爆幸存者研究队列均不能提供有统计意义的证据以支持LNT[11-12]。近期有人采用Monte Carlo估计原爆幸存者实体癌发病率,结果显示男性辐射致癌剂量阈值的最佳估计值为0.75 Gy,但与0 Gy相比,无统计学差异。作者认为如果在统计不确定性范围内,仅低于急性放射病剂量(1 Gy)的0.75 Gy与0没有区别,则不能声称原爆幸存者研究队列证实了LNT,尽管也不能证明LNT是错误的,但不能证明“错误”并不代表其正确[13-14]。
NAS在2006年原爆幸存者队列研究的基础上编写了BEIR Ⅶ报告,作为LNT的支持证据,但却受到了众多学者的质疑[15],主要体现在:①白血病的剂量-效应关系明显是线性二次,实体癌线性模型与线性二次模型无统计学差异,线性二次拟合更好,但BEIR Ⅶ报告直接采用线性模型;②在BEIR Ⅶ报告图4中最高剂量只显示到2 Gy,实际上超额相对危险(ERR)在剂量高于2 Gy通常显示出下降趋势,因为高于2 Gy时,受照人群可能等不到癌症发病已死亡,BEIR Ⅶ报告通过将剂量限制在2 Gy以内来掩盖这种下降,成功给人线性感觉;③BEIR Ⅶ报告将所有剂量低于 100 mGy的数据合并成一个点数据,然而80%的原爆幸存者的剂量在这一范围内,这种合并给人一种直线感觉;④BEIR Ⅶ报告只考虑人群初始辐射(核爆炸),未考虑残余辐射(爆炸后黑雨),导致对照组选择错误,但通过贝叶斯分析认为日本原爆队列辐射效应具有阈值和低剂量刺激效应现象。从BEIR Ⅶ报告以来,国际上没有发表类似有关LNT总结报告,而2016年UNSCEAR报告根本没再提到LNT一词。
NCRP第27号报告(2018)分析了29项近10年的辐射流行病学调查数据,认为目前的研究仍支持LNT模型,但据Siege等[16]分析,在29项研究中只有5项为LNT提供了有力支持,包括LSS队列及国际核工业作业人员联合研究,而其它研究几乎没有提供任何支持证据(实际上提供了反驳证据),但NCRP 27号报告忽略了上述矛盾和不确定性,仍坚持LNT模型。
剂量是否准确、混杂因素控制方式、统计方法是否有效,仍是目前流行病学研究中至关重要的因素。而随意放弃特定范围的辐射剂量,可能会得出支持LNT的结论,若包括整个剂量范围数据可为剂量阈值提供证据;若非辐照组中包含了低剂量组个体可能会掩盖低剂量引起的刺激(适应性)效应[14]。有研究认为与辐射有关的风险可能在个体层面研究中得到更好的解决(如组学技术),而不是在人群层面[17-18]。
2.2 低剂量辐射生物效应数据
首先,线性无阈模型认为引发癌症的主要原因是辐射导致的DNA损伤,并且DNA损伤随着辐射剂量呈线性增加,故认为癌症发生率也随剂量呈线性增加[19]。然而,对细胞机制的回顾性研究表明,过去20年中进行的低剂量辐射(LDR)生物学研究不支持上述假说。首先,细胞系可采用多种机制,如DNA修复、凋亡、自噬、细胞周期阻滞等有效去除或修复LDR介导的DNA损伤,使得LDR不会导致DNA突变的积累,不会对细胞转化产生有害影响。大量的分子表达谱分析表明,LDR与高剂量电离辐射(HDR)所致细胞的基因/蛋白表达谱不同,即LDR和HDR所致细胞分子效应不符合线性;另一种基于LDR诱导的细胞机制是辐射诱导的旁观者效应,该机制直接否定了LNT的“命中理论”。有研究认为LDR介导的DNA修复机制的激活不仅可保护DNA免受直接损伤,而且可产生长期适应性反应,从而保护细胞免受后期氧化损伤(如HDR),单次或分次给予低于100 mGy剂量,足以增加细胞的DNA修复系统,能保护DNA免受后期1~4 Gy电离辐射损伤[21-22];有研究认为,慢性LDR辐射暴露后,DNA修复基因如H2AX、ATM、Lig4和RRM2的表达增强,这些修复后的细胞似乎不会再犯错,因为这些细胞对辐射诱导的肿瘤转化已不易感[23]。然而,LDR介导的DNA修复防御系统的激活往往会导致细胞程序性死亡(凋亡),特别是修复能力差的干细胞,细胞凋亡可去除受损遗传物质从而防止癌症的形成[24-29]。LDR介导的细胞凋亡是一种短暂的效应,通常无法修复的损伤细胞会发生凋亡[30-31]。总之,DNA修复、细胞凋亡、自噬和细胞周期阻滞被认为是防止癌症形成的策略[20]。
基于“组学”的大规模实验研究结果表明,LDR致细胞表达特征与HDR有很大的差异。网络富集分析表明,LDR表达的细胞网络具有生物保护作用,或至少不具有破坏性,而HDR表达谱与癌症进展、免疫激活和细胞死亡有关[32]。目前认为,LDR对生物学分子的影响结论为:①辐射介导的DNA损伤在所有剂量范围都呈明显的线性,但是LDR暴露不会改变癌症的风险;②LDR激活DNA防御机制以修复受损DNA;③LDR通过凋亡和自噬机制去除无法进行DNA修复的受损细胞;④LDR启动G2/M细胞周期阻滞,以防止未修复的DNA发生有丝分裂,同时允许DNA修复机制有时间充分恢复受损的DNA序列;⑤LDR作用下的分子基因/蛋白质/miRNA表达谱不同于HDR,表明生物效应与辐射剂量不呈线性;⑥LDR通过改变基因特异性DNA甲基化状态的表观遗传机制诱导适应性记忆;⑦LDR暴露的细胞通过旁效应方式将信号传递给未辐照细胞,使得组织作为一个整体做出反应,而不是单个细胞;⑧LDR促进免疫介导的致瘤癌细胞去除;⑨LDR提高正常细胞的抗氧化能力,从而限制肿瘤的形成;⑩LDR可防止自发肿瘤细胞转化[20]。
总之,低剂量辐射生物效应研究结果认为,辐射呈线性改变了各种生物分子过程,然而,由于细胞防御系统的存在,在低剂量范围发生的细胞修饰并不能对疾病进展产生影响。基因组学、表观基因组学、转录组学、蛋白质组学和代谢组学是估计低剂量辐射风险新的生物研究领域,上述方法可通过高通量筛选方法寻找辐射效应生物标志物,但目前大量高通量数据的分析及其验证方法仍然是不完整的[7]。
2.3 代价利益分析挑战
有研究者认为[33],在世界范围内,LNT和ALARA原则已导致商业核电、核医学和环境管理成本呈几乎无法估量的、不合理的增长。LNT和ALARA是扼杀公众对核能认知和接受的两大障碍。据估计,在LNT模式下,花费1亿美元控制辐射释放只可能挽救1人生命[34];日本原爆后,1950—2009年间可归于电离辐射的实体癌超额死亡人数约900人,而与辐射无关的其它癌症死亡人数多达2万人[13];严格的监管政策也引起了公众对辐射危害的非理性恐惧,在切尔诺贝利核事故和福岛核事故中,强制搬迁导致社会性破坏,并造成疏散人群严重的身心问题和寿命的缩短,如福岛核事故后的第一年,在疏散人群中有1 000多名死于与疏散相关因素,而因辐射直接死亡人员很少[35];切尔诺贝利核事故后,接受很小辐射剂量的欧洲妇女有超过10万人进行了堕胎[36];美国依据《铀水冶尾矿补救行动方案》,花费14.5亿美元来预防1 290例理论癌症死亡病例[33]。
此外,因LNT对癌症发病率和死亡的预测,导致部分病人拒绝进行医疗成像检查,不能即时诊断救治而面临巨大风险;基于LNT的条例和政策基本排除了中低剂量药物辐射疗法的进展,尽管某些药物,如阿尔茨海默病治疗的药物已在动物实验显示其具有治疗潜力[37-38]。
考虑到目前基于LNT的极高社会成本(经济和人力成本),有研究者认为应该重新考虑与电离辐射有关的法规制订,应提高辐射暴露限值,减轻企业监管负担[14]。
3 电离辐射风险评估模型
目前有关辐射致癌风险评估模型有5种,包括线性无阈模型、线性有阈模型、线性二次方模型、超线性模型及刺激模型[7]。线性无阈模型(Linear-no-threshold model)是目前辐射防护领域的金标准模型,这种模型下,低剂量段水平的风险估计是通过高剂量的线性剂量-效应外推来实现的,目前没有明确科学证据。线性二次模型(Linear-quadratic model)见于放射性治疗及原爆幸存者寿命队列研究的白血病拟合模型,是线性无阈模型的一种,在我国GBZ 97辐射致白血病的归因份额计算中得到应用;线性有阈模型在部分研究中得到证实,但由于对剂量阈值存在的可能性还不能断定, 另外, 如果存在剂量阈值, 也不能断定它在什么剂量水平;一些动物实验数据,如旁效应及低剂量超免反应显示模型为超线性效应模型;刺激模型显示低剂量下的u形剂量-效应关系,上述动物实验数据处于理论探索阶段。不同模型的比较见图1所示。
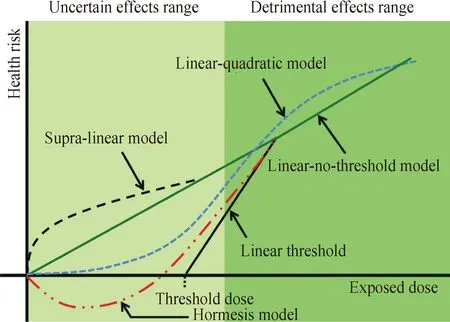
x轴表示辐射暴露水平,y轴表示疾病的总体风险。
4 线性无阈模型研究展望
因低剂量电离辐射涉及到工人暴露以及环境清理等方面的监管问题,美国国会对低剂量辐射研究比较感兴趣。2017年3月,美国总统特朗普发布了关于“执行监管改革议程”的第13777号行政命令,指示联邦机构建立监管改革工作组。据此,美国保健物理学会(HPS)督促美国环保部(EPA)重新考虑是否采用线性无阈模型(LNT)作为辐射暴露监管的基础,并要求其通过更好地了解低剂量、低剂量率(LDDR)辐射暴露的不确定性来改进几份文件,这些文件涉及到采用LNT模型及集体剂量估算辐射风险[39]。美国政府问责办公室2017年报告(GAO2017)声明,美国将开展一项低剂量辐射计划,该计划由美国能源部(DOE)与联邦机构合作完成[40]。2018年,美国参议院一致同意通过第589号《美国能源部研究和创新法案》,指示DOE科学办公室“实施一项低剂量辐射研究计划,以提高对低剂量辐射暴露影响的科学认识,减少有关不确定,提高电离辐射风险管理措施[41]。但从目前来看研究方向脱离不了低剂量辐射流行病学调查及电离辐射的分子生物学技术。
4.1 辐射流行病学研究动态
百万低剂量作业人员健康影响研究是美国能源部(DOE)与美国核管会(NRC)等多个机构合作开展的放射工作人员的流行病学研究,队列人数比日本寿命队列LSS(86 000人)大12倍,包括了11.5万名原子能退伍军人、36万名DOE工作人员、15万名核设施工作人员、25万名放射科医生和医务人员以及13万名工业放射技师[42]。与LSS队列相比,百万人群的辐射剂量更符合职业暴露特点,即慢性长期小剂量照射,科学家对百万人群队列研究结果期望较高。美国NCRP企图通过对低剂量/低剂量率辐射流行病学调查评估,重新理解线性无阈模型。NCRP倡议开展以下三方面工作:(1)回顾以往流行病学研究,重点审查流行病学研究方法;(2)审查统计方法;(3)审查剂量学资料[43]。
4.2 低剂量辐射生物效应研究动态
NCRP在其24号评论《低剂量辐射对健康的影响:辐射生物学和流行病学结合的前景》(NCRP 2015)中公布了低剂量研究的技术路线图,提倡使用辐射生物学数据以提高对辐射流行病学研究结果的理解,减少低剂量暴露风险估计的不确定性,更好地理解与辐射诱导的随机效应相关的复杂生物学问题,如通过凋亡消除异常细胞,通过免疫功能调节抑制癌症发生等[44]。目前,揭示致癌效应等生理现象的分子和生化方法已迅速应用于放射生物学,特别是表观遗传学(染色体结构的磷酸化、甲基化、乙酰化和糖基化)、辐照细胞中活性氧研究、组学研究(基因组学、表观基因组学、转录组学、蛋白质组学和代谢组学)等[7]。Tharmalingam 等[45]认为低剂量辐射生物效应取决于多种因素,如辐射剂量、剂量率、组织类型、细胞类型、性别、物种及时间调节等,都是评估LDR暴露对健康影响需考虑的重要因素。但总的来讲,低剂量辐射导致癌症发生的风险极小,并认为LDR介导的癌症风险的一个重要事项是细胞防御机制(DNA修复系统、凋亡信号、细胞周期阻滞等),若细胞防御机制修复无效,可导致细胞突变累积,即使在LDR暴露下也会增加癌症风险。因此,作者认为根据个体的基因组成确定的个体照射方案可能是未来职业健康监护可探索的一条途径。高通量“组学”技术有助于使这种个性化的研究成为可能。
4.3 剂量阈值建议
ALARA是辐射保护的重要支柱,辐射安全专业人员绝大多数同意,在非常低的剂量,如本底辐射水平采用ALARA,并不能提高公众或放射作业人员辐射安全。相反,会产生重大的经济和社会后果。据此,美国橡树岭联保大学(ORAU)专家建议将ALARA可忽略的个体剂量由0增加至0.1 mSv/a,用以设置ALARA的截止点[46]。2015年有3位请愿者向美国核管会(NRC)提出建议,修改美国联邦法规10 CFR第20部分(辐射防护标准),其中2位建议:①放射工作人员剂量应保持在目前水平(50 mSv/a),如果是慢性照射,每年可允许达到100 mSv; ②应将ALARA从标准中彻底删除;③应将公众暴露剂量与放射工作人员剂量定到同一水平[47]。Doss认为原子弹幸存者癌症风险增加的阈值剂量为~700 mGy,考虑到不确定性,阈值剂量可低至350 mGy,采取3倍安全系数,则急性照射剂量为100 mGy可被认为是安全的,作者建议在辐射防护条例中将100 mSv定为急性照射的剂量指导水平;同时作者认为应将慢性暴露的剂量限值设为3年可暴露于1 Gy,采用3倍安全系数,1年的剂量指导值可设定为100 mGy,且强调公众成员及职业人群应设定成同一剂量指导值[48-49]。
5 结论
目前众多研究论文对LNT研究过程中的不确定性及其带来的经济和社会问题进行了阐述[50],然而更重要的问题是随着LNT模型被拒绝和辐射刺激等效应模式逐渐被接受,LDR致癌性争议解决已迫在眉睫,需要一种基于LNT模型的替代方法。为了验证和确定LNT的替代模型,低剂量辐射研究势在必行,或许包括职业人群流行病学及低剂量辐射生物效应研究,也可能是对现有发表的包括剂量阈值、LNT和刺激效应的剂量-效应模型进行科学整合,得出最佳的健康监管点[5];但不论采取何种方式,均应做好代价效益的平衡,在节约成本的同时,必须有效保护劳动者健康。

