石墨炔负载Cr2团簇催化剂用于合成氨的第一性原理研究*
宋 薇,李沉思,王梦梦,董 宁
(河南工学院 理学部,河南 新乡 453003)
0 引言
氨(NH3)不仅是工农业生产中不可或缺的原料,同时也是一种潜在的碳能源载体,在全球经济增长中起着至关重要的作用。目前工业上氨的生产主要依赖于高能耗以及高二氧化碳排放的Haber-Bosch工艺,这种工艺每年的能源消耗量约占全球的1.4%,二氧化碳排放量约占全球的3%[1, 2]。因此,人们致力于研究如何实现在常温常压下以氮气和水的高效反应合成氨,特别是如果合成氨过程中的驱动能量能由可持续的绿色能源供给,将能够彻底克服Haber-Bosch法合成氨技术中所涉及的能耗、污染以及安全性等方面的问题。电催化氮还原反应(nitrogen reduction reaction,NRR)可由清洁电能驱动,并在常温常压条件下合成氨。因此,利用电催化技术,以水作为反应的溶剂和合成氨的质子源,能避免化石燃料燃烧所带来的污染,是解决环境和能源问题的理想方案之一。作为新兴的研究热点,电催化合成氨的研究依然处于初级阶段,目前主要面临两大挑战:一是反应物氮气的惰性导致很难解离或激活N≡N键;二是析氢反应(hydrogen evolution reaction,HER)的竞争导致法拉第效率低下[3]。若想实现低能耗、高产量、零污染的合成氨技术,其核心就是电催化剂的选择。对于NRR而言,催化剂除了具有高活性以外,同时还需兼顾对竞争性HER的抑制作用。所以如何开发稳定且高效的电催化剂成为电催化能源转化和存储技术所面临的亟待解决的问题。目前,用于电催化合成氨的催化剂种类繁多,其中纳米团簇催化剂因具有高表面原子占比,使得其能比颗粒材料尤其是体相材料提供更多的活性位点,从而展现出更好的催化活性。2018年,清华大学李隽教授课题组提出了“表面团簇催化”的新概念,首次揭示了孤立双金属团簇催化剂在合成氨上的可行性[4]。裸金属团簇催化剂在室温下稳定性和感应效率较低,而二维材料具有化学性质稳定、吸附性能好、比表面积大等优点,故将金属团簇负载到二维材料表面可以增强其稳定性和催化活性。近期研究人员报道了一些关于过渡金属(TM)团簇负载到二维材料表面的催化活性,如TM1-3@GDY/G[5,6]、Fe2@g-CN[7]、FeTM@N1-4G[8]等。Co2@GDY[6]和Fe2@g-CN[7]都表现出优异的催化性能,这是由于双活性中心的协同作用可以促进含氮中间体的吸附与解吸,降低反应能垒,因此有利于NRR进行。随着团簇尺度增大,活性中心也随之增加,催化效果变得更加明显,如Fe3团簇负载到GDY/Gra[5]表面后表现出良好的催化性能并具有抑制HER的能力,且限制电位低至-0.26 V。近年来,石墨炔(GY)作为一种新型的二维碳同素异形体,因其具有比表面积大、高度共轭、无顺反异构、载流子迁移率高等优点而受到研究人员的广泛关注。最近研究发现,GY与金属原子之间存在较强的化学吸附及明显的电荷转移,这有利于催化活性的提升。因此,将金属团簇负载到GY表面也有可能作为高效的催化剂,但关于这方面的研究却鲜有报道。在本研究中,我们将选择GY负载Cr2团簇作为电催化剂,采用密度泛函理论(DFT)系统地研究Cr2@GY体系的稳定性、电子性质以及在电催化NRR领域的活性。
1 计算方法
本文所有的能量和电子性质计算均采用自旋极化DFT在VASP软件中实现[9-12],并采用了Perdew-Burke-Ernzerhof(PBE)方法来描述电子交互相关作用,交换能和相关能则用广义梯度近似(GGA)来描述。用投影缀加平面波方法(PAW)方法表征核电子对价电子密度的影响。设置平面波基组的截断能为350 eV,采用共轭梯度法进行弛豫计算,力和能量的收敛标准分别为0.02 eV/和10-4 eV。布里渊区用Monkhorst-Pack网表示,K点设置为3 × 3 ×1。选用GY的2 × 2超晶胞,共含有48个碳原子(图1(a)),其优化的晶格参数为6.89 Å[13],并在垂直z方向上插入15Å的真空板,以消除非物理周期性偶极相互作用。
Cr2@GY表面对N2分子的吸附强度可以通过吸附能(Eads)来表示,采用下列公式计算:
Eads=Etot-ECr2@GY-EN3
其中Etot是Cr2@GY对N2分子吸附时的总能量,ECr2@GY是Cr2@GY的能量,EN2是真空中孤立的N2分子的能量。根据此定义,Eads的负值越大表示吸附强度越高。
自由能(ΔG)计算基于氢电极模型[14-16]。在标准反应条件(pH=0,298.15K,101325Pa)下,(H+e-)对的化学势为H2的一半,外电位为0 V。
ΔG=ΔE+ΔZPE-TΔS+ΔGU+ΔGpH
这里的ΔE表示用DFT方法计算得到的能量,ΔZPE代表零点振动能,T代表温度,ΔS代表熵的变化,ΔGU代表在电化学反应中加的电势,ΔGpH=kBT×ln10×pH,kB是玻耳兹曼常数。
2 结果与讨论
2.1 N2分子在Cr2@GY表面吸附的结构和能量
如图1(b)所示,Cr2团簇负载到GY上的最稳定位置是中心位,与六个C原子相连。在此基础上,我们研究N2分子的有效吸附,这是NRR顺利进行的前提。NRR是一个复杂的过程,它包括两种不同的吸附模式,即N2分子的垂直吸附和平行吸附。所谓的垂直吸附指的是N2分子中的一个N原子与Cr2@GY表面相连,而平行吸附是两个N原子同时附着在Cr2@GY表面上。从吸附能的计算结果可以看出,N2分子垂直吸附(Eads= -0.317 eV)的强度高于平行吸附(Eads= -0.122 eV)的强度。由于吸附能均为负值,说明N2分子可以自发地吸附在Cr2@GY表面,为放热过程。此外由于吸附能高于-0.5 eV,说明N2分子的吸附是较弱的物理吸附。在这两种吸附模式下,N-N键长分别从自由N2分子的1.092Å分别延长到1.129Å和1.137Å,由此可以说明N2分子得到了一定程度的活化,有利于接下来NRR的顺利进行。
接下来我们研究了N2分子与Cr2@GY之间的电荷转移,这将有助于我们更好地理解催化机理。Bader电荷分析表明,由于N原子的电负性(3.04)大于C(2.55)和Cr(1.66),所以电荷从Cr2@GY向N2分子转移,转移量分别为0.156 e(垂直吸附)和0.167 e(平行吸附)。为了确认这一电子转移过程,我们绘制了电荷密度差分图(图2)。观察图2可以看出Cr原子与N2分子之间存在着明显的电荷转移。在两种吸附模式中,Cr-N键和Cr原子周围既存在电荷积累,也存在着电荷消耗,说明两个N原子同时失去和得到电子。这完全符合“接受-给予”过程[17],即Cr原子空的d轨道可以接受N2分子的孤对电子,而Cr原子的已占据d轨道可以向N2分子的反键轨道提供电子。通过“接受-给予”过程使得惰性的N≡N键更容易活化,促使后续氢化反应的顺利进行。
为了进一步了解Cr2@GY催化活性的来源,我们计算并比较了N2分子吸附在Cr2@GY上的分波态密度(PDOS)。从图3(a)可以看出,N2垂直吸附在Cr2@GY表面时,在费米能级以下,N原子的2p轨道和Cr原子的3d轨道之间存在着较强的杂化,有两个比较明显的重叠峰,相反N2水平吸附在Cr2@GY表面时,这种杂化峰却不明显,这也与吸附能的计算结果相吻合。
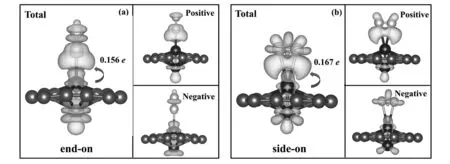
图2 N2在Cr2@GY表面以 (a) 垂直吸附和(b) 平行吸附的电荷密度差分图,等值面设为0.001 e/Å3
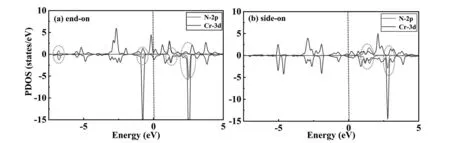
图3 N2在Cr2@GY表面以(a) 垂直吸附和(b) 平行吸附的分波态密度(PDOS);虚线处的费米能级设为零
2.2 电催化NRR机理
一般来说,NRR机理可分为三种可能的途径,包括N2分子以垂直方式吸附时的远端和交替路径以及N2分子以水平方式吸附时的酶促路径。对于远端路径,质子和电子对(H+/e-)连续攻击一个N原子直到第一个NH3分子生成,然后攻击另一个N原子生成第二个NH3分子。对于交替和酶促途径,H+/e-对交替攻击两个N原子,使得两个NH3分子相继生成[18,19]。为了研究NRR在Gr2@GY上的催化活性,优化后的反应中间体结构和自由能曲线如图4、图5和图6所示。
对于远端和交替路径,*N2的活化(N2→*N2)和*NNH的形成(*N2→*N-NH)这两步完全相同。从图4(a)和图5(a)中可以看出,N2分子活化步骤的自由能(ΔG)上升了0.13 eV,说明N2分子的活化需要一定能量的输入。后续的*NNH生成,即第一个加氢步骤后,ΔG继续上升了0.57 eV。远端路径后续的四个反应步骤均为放热过程,ΔG对应值分别为-0.59 eV(*N-NH→*N-NH2)、-0.15 eV (*N-NH2→*N)、-1.16eV(*N→*NH)、-0.38eV(*NH→*NH2)。对应着*N-N、*N-NH、*N-NH2的N-N键长分别为1.129Å、1.235Å和1.329Å。对于交替路径,后续四个反应步骤的ΔG值分别为0.20 eV(*N-NH→*NH-NH)、-0.80eV(*NH-NH→*NH-NH2)、-0.87eV(*NH-NH2→*NH-NH3)、-0.81eV (*NH-NH3→*NH2)。*NH-NH和*NH-NH2对应的N-N键长分别为1.299Å和1.407Å。由以上N-N键长变化可以看出,随着加氢过程的进行,N-N键被逐步拉伸。尤其当交替路径进行第四步加氢时,N-N键已经完全断裂,说明交替路径更有利于NRR的进行。最后一个加氢步骤(*NH3的脱附)的ΔG值为0.39 eV。显然,第一个加氢步骤(*NNH的生成)是NRR的决速步骤,其余所有步骤的ΔG值均低于第一步加氢的0.57eV。
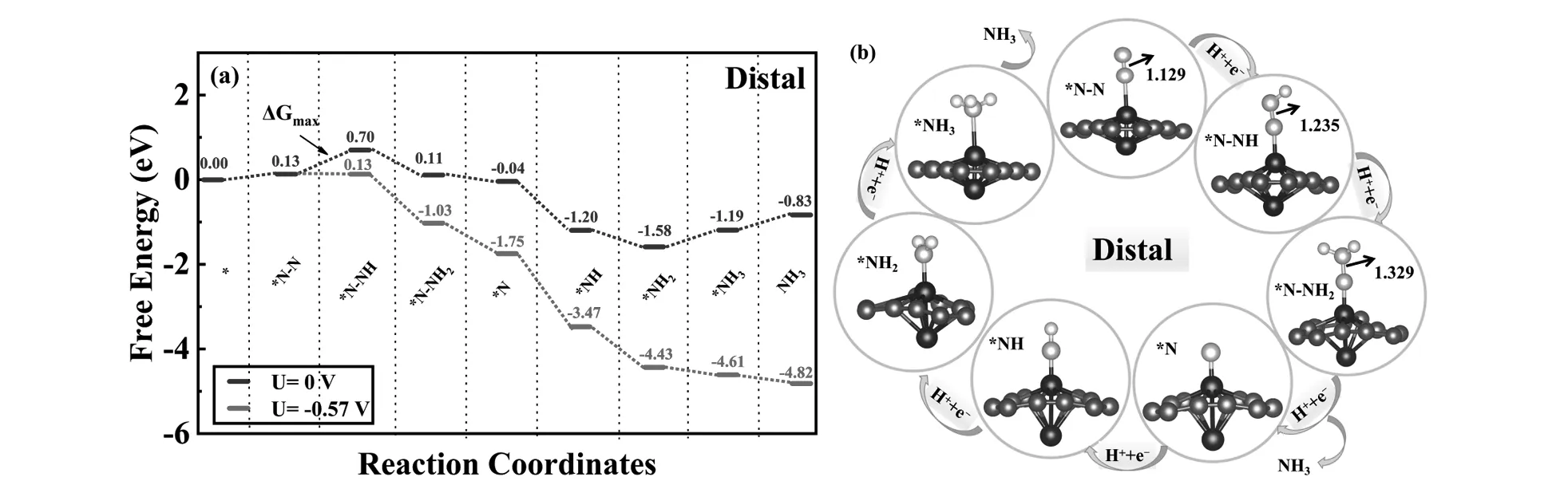
图4 (a) 远端路径的吉布斯自由能图;(b) 优化后各种中间体的几何结构。棕、蓝、灰、粉球分别代表C、Cr、N、H原子
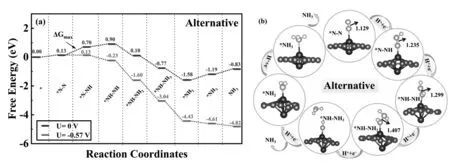
图5 (a) 交替路径的吉布斯自由能图;(b) 优化后各种中间体的几何结构
对于酶促路径(图6),*N2的活化反应也并非自发进行,需要输入0.30eV的能量,稍高与远端和交替路径的能量输入,这与吸附能较高有关。随后的*NNH生成只需要克服0.23eV的自由能垒,这表明*NNH更有可能通过酶促途径形成。接下来的五个氢化步骤的ΔG值分别为-0.22eV、 -2.23eV、-0.71eV、 1.47eV和 -0.03 eV,除了第五个氢化步骤(*NH2-NH2→*NH2-NH3)以外,其余各步骤均为放热过程。而*NH2-*NH3的生成也是酶促路径的决速步骤,反应能垒高达1.47eV。
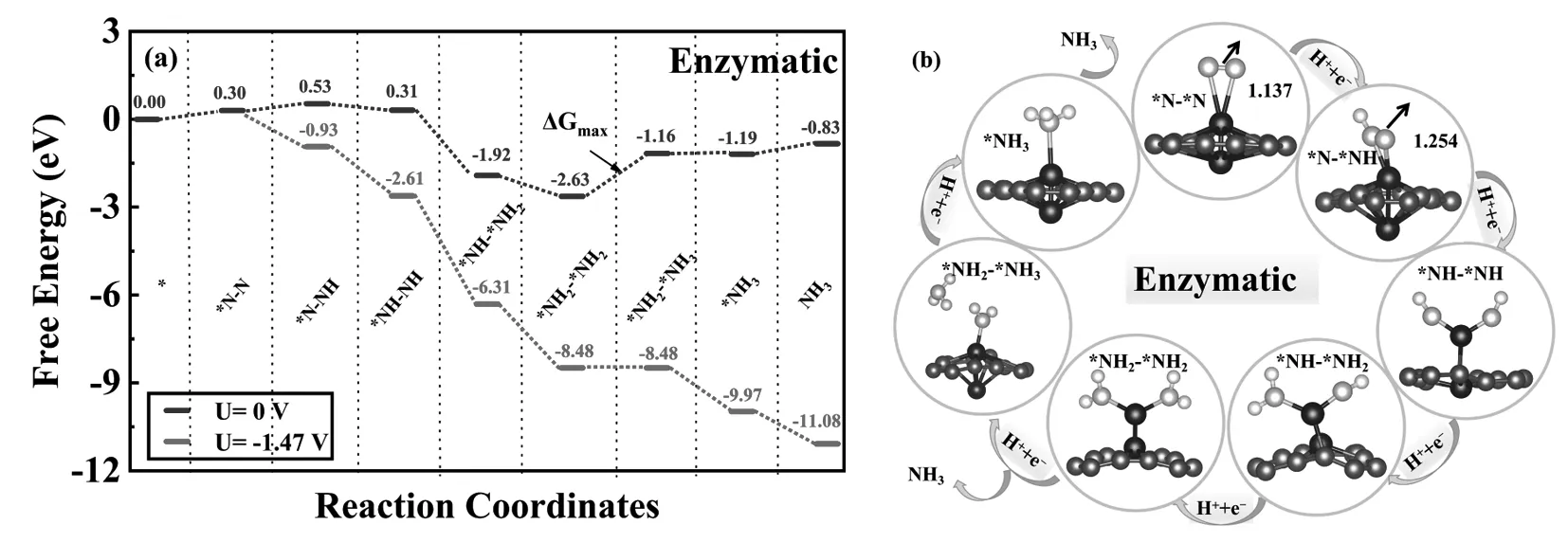
图6 (a) 酶促路径的吉布斯自由能图;(b) 优化后各种中间体的几何结构
为了尝试降低酶促路径决速步骤的反应能垒,我们对不同路径进行杂化。如图7所示,我们将酶促路径与远端路径相结合,前三个氢化步骤采用酶促路径,后三个氢化步骤采用远端路径。从得到的自由能曲线可以看出(图 7(a)),决速步骤的自由能的确降低了0.75 eV,但还是比远端路径和交替路径的高,说明杂化路径不是最适合NRR的路径。

图7 (a) 杂化路径的吉布斯自由能图;(b) 优化后各种中间体的几何结构
接下来,我们比较了不同中间体的电荷转移的情况。如表1所示,随着氢化步骤的进行,电荷转移大体上呈现出先增加再减少的趋势。对于远端和交替路径而言,最大的电荷转移量出现在*N和*NH-NH3的形成,这都是NH3的脱附步骤,由此可见较大的电荷转移可以活化N原子,促使NH3的形成。而对于酶促路径而言,前几步氢化反应的电荷转移都比较高,对应的自由能垒都呈现出下降趋势,尤其是*NH-*NH的电荷转移量最大,对应氢化反应的能垒下降了-2.23 eV,说明电荷转移也可以降低反应能垒,促进NRR顺利进行。
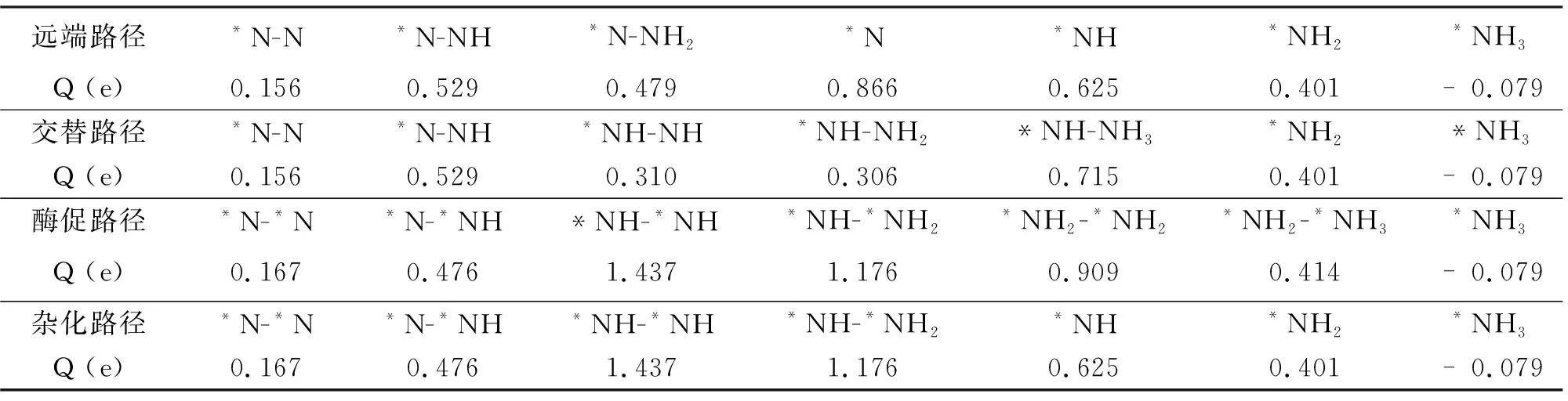
表1 通过远端、交替、酶促和杂化路径进行NRR过程中,各种反应中间体与Cr2@GY之间的电荷转移(正值和负值分别代表得电子和失电子)
3 结论
电催化还原氮气合成氨是一种可以显著降低传统工业过程能耗的方法,本文通过DFT计算研究了GY负载Cr2团簇的电催化性能,通过远端路径和交替路径都可以实现较低能垒的NRR过程,且其自由能垒仅为0.57 eV。电子性质的研究表明,Cr2@GY的高活性与电荷转移密切相关,电荷转移可以有效降低自由能垒且促使NH3脱附,使得NRR顺利进行。我们希望这些结果能够促进对更高效NRR电催化剂的研究。
(责任编辑吕春红)

