竹纤维基活性炭对Cr(Ⅵ)吸附性能研究
高艳峰,王颖博,田苗苗,孙书双,朱亚明,高丽娟,赵雪飞
(辽宁科技大学 化学工程学院,辽宁 鞍山 114051)
随着全球工业化水平快速提高,含有重金属的工业废水排放量逐年增多,重金属污染问题日益严重。重金属污染通常指含量超标的含铅、锰、铜、铬等重金属离子废水直接或间接排入环境中,造成不可逆的环境污染和危害。其中,铬在水体中存在的主要形式为Cr(Ⅲ)和Cr(Ⅵ)。Cr(Ⅲ)稳定,是一种可以满足人类身体正常代谢的微量元素,有一定的毒性,但其毒性特征只有在高浓度下才会显现[1]。Cr(Ⅵ)的毒性远大于Cr(Ⅲ),在水中的主要存在形态为铬酸盐和重铬酸盐[2],会对环境产生不同程度的持久性污染和危害。当人类接触到含有Cr(Ⅵ)的水体时,会导致皮肤过敏,如果通过水源和食物进入人体,会致人中毒,严重可致癌。世界卫生组织规定,饮用水中Cr(Ⅵ)允许的最大浓度为0.05 mg/L[3]。因此,去除废水中Cr(Ⅵ)意义重大。
目前,去除废水中重金属离子的常见方法包括:氧化化学还原法、膜分离法、吸附处理法、沉淀法、离子交换法等。其中,活性炭吸附法成本相对较低,且吸附效能优良,广泛用于废水中重金属离子的吸附脱除。生物质活性炭是活性炭的一种,主要是以生物质废弃物为原料,经炭化、活化处理后的一种活性炭,具有来源广泛、价格低廉和吸附性能高的特点,广泛用作吸附剂处理工业废水的重金属离子。王威振等[4]考察不同部位梧桐生物质炭对水溶液中Cd2+的吸附效果,发现梧桐皮生物炭对Cd2+的吸附量更高。王晓霞等[5]研究稻草秸秆活性炭的制备方法,发现溶液pH值对重金属Cd2+的吸附效果有明显影响。温嘉伟等[6]利用KOH活化法制备的棕榈树纤维生物质活性炭对溶液中Pb2+的最大吸附容量为110.89 mg/g。丁绍兰等[7]通过炭化-活化法制备樱花生物质活性炭,研究其对溶液中Cr(Ⅵ)的吸附性能表明,樱花生物质活性炭对溶液中Cr(Ⅵ)的吸附属于单层吸附,且最大吸附量为49.78 mg/g。已有研究表明,生物质活性炭对重金属离子的吸附具有潜在的发展前景。本文以造纸业废弃竹纤维为原料,采用KOH活化法制备高比表面积活性炭,研究竹纤维基活性炭对Cr(Ⅵ)的去除效果和吸附行为,为造纸废弃竹纤维再利用及活性炭吸附重金属离子Cr(Ⅵ)提供理论基础。
1 实验部分
1.1 制备竹纤维基活性炭
在实验室中,将造纸业废弃竹纤维在550℃炭化后,采用KOH活化剂,按碱炭质量比为5∶1混合,在864℃活化46 min,制备竹纤维基活性炭(Bamboo activated carbon fiber,BAC)。其碘吸附值为3 766 mg/g。实验用重铬酸钾、磷酸、硫酸、二苯基碳酰二肼、丙酮、氢氧化钾、无水乙醇、盐酸和氢氧化钠等化学试剂均为分析纯,由国药集团有限公司提供。
1.2 Cr(Ⅵ)标准工作曲线的绘制
配制不同浓度的Cr(Ⅵ)标准溶液50 mL。向每支比色管中各加入0.5 mL磷酸溶液和硫酸溶液,摇匀后加入2 mL显色剂,将比色管置于阴暗处放置5~10 min,在540 nm测吸光度值,绘制吸光度-浓度(Absorbance-Concentration,A-C)标准曲线,如图1所示。
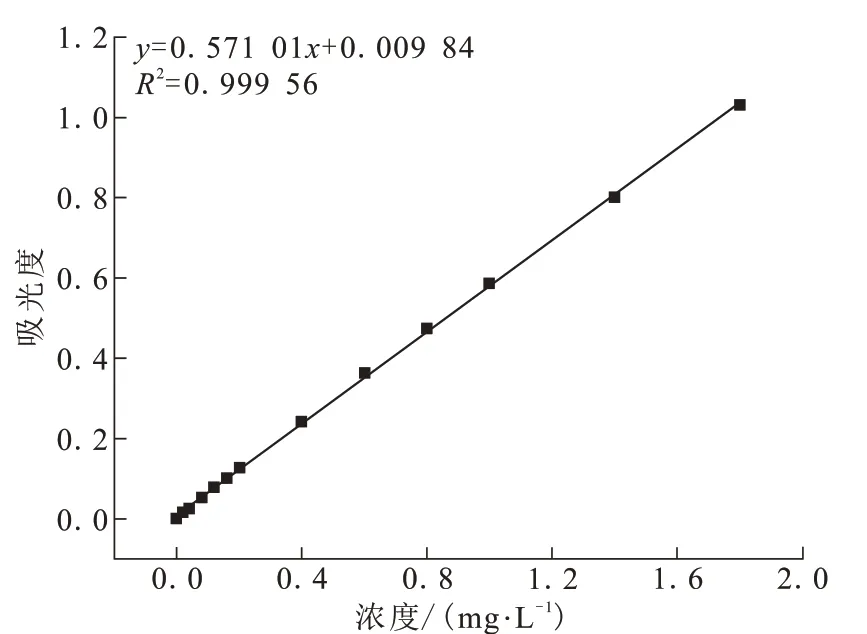
图1 Cr(Ⅵ)标准工作曲线Fig.1 Standard work curve of Cr(Ⅵ)
1.3 吸附实验方法
称取BAC 0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 g分别放入10支250 mL具塞锥形瓶中,再分别加入50 mL质量浓度为20 mg/L的Cr(Ⅵ)溶液,将锥形瓶置于25℃恒温水浴振荡器,调整转速为120 r/min,避光振荡吸附4 h。待吸附完毕,取滤液测定吸光度,依据标准曲线Cr(Ⅵ)浓度计算BAC的去除率ω和吸附量qt。计算式


式中:C0为Cr(Ⅵ)溶液初始浓度,mg/L;Ct为t时刻溶液中Cr(Ⅵ)的浓度,mg/L;qt为t时刻BAC的吸附量,mg/g;V为吸附Cr(Ⅵ)溶液的体积,mL;m为BAC的剂量,g。
1.4 吸附动力学模型
吸附动力学研究生物质活性炭的吸附速率和反应特性。水溶液中吸附动力学通常采用准一级动力学模型(Pseudo-first Order模型)和准二级动力学模型(Pseudo-second Order模型)[8]。本文利用这两种模型评价BAC吸附Cr(Ⅵ)的机理。
准一级动力学非线性方程

准二级动力学非线性方程

式中:k1为准一级反应速率常数,min-1;k2为准二级反应速率常数,min-1;qe为吸附达到平衡时吸附剂的吸附量,mg/g;qt为t时刻吸附剂的吸附量,mg/g。
1.5 吸附热力学模型
吸附热力学是描述吸附过程动态平衡的基本定律。在研究热力学特征时,用吸附等温曲线描述竹纤维基活性炭与污染物之间相互作用的性质,同时反映活性炭的孔分布性质及表面特性。常用的吸附等温模型有Langmuir和Freundlich模型[9]。Langmuir方程

式中:qe为吸附剂达到吸附平衡时吸附量,mg/g;qm为吸附剂的单位质量饱和吸附量,mg/g;Ce为吸附平衡时被吸附污染物的浓度,mg/g;b为与吸附能相关的Langmuir常数。
Langmuir模型基于吸附过程为单分子层吸附的假设,认为吸附剂表面用于吸附目标污染物的活性位点有限并且分布均匀,各吸附位点具有相同的能量,被吸附物质之间不产生相互作用[10]。在利用Langmuir模型时,可定义无纲量分离因子RL,用于判断吸附反应过程是否有利。若RL介于0~1之间,则吸附过程为有利吸附,若RL=1,符合线性吸附,若RL=0,则认定为不可逆吸附,若RL>1,为不利吸附[11]。RL计算式

式中:KL为Langmuir吸附平衡常数;C0为被吸附污染物的初始浓度,mg/g。
Freundlich方程

式中:k为与溶液中污染物和生物质活性炭的性质和种类有关的经验常数;n为级数。
Freundlich模型假设吸附剂表面吸附位点能量各异,适用于多分子层吸附过程,吸附位点位置较为分散,吸附剂和吸附质之间、吸附质分子之间有多种吸附条件存在。常数n可以判断吸附过程的难易状态。当n>2时,表明吸附过程容易进行;当n<1时,表明吸附难以进行;当1<n<2时,表明吸附较难进行[12]。
2 实验结果与讨论
2.1 BAC的表面形貌研究
扫描电镜(SEM)表征竹纤维基活性炭的表面微观形貌如图2所示。炭化后的竹纤维(Bamboo carbon fiber,BC)具有良好的纤维状结构,表面具有较多的凸起状颗粒物。经活化后,BAC仍保持了较好的纤维状结构,表面凸起状颗粒消失,出现明显的褶皱状结构。在KOH活化过程中,竹纤维表面和炭骨架均受到刻蚀,形成更多的孔道。
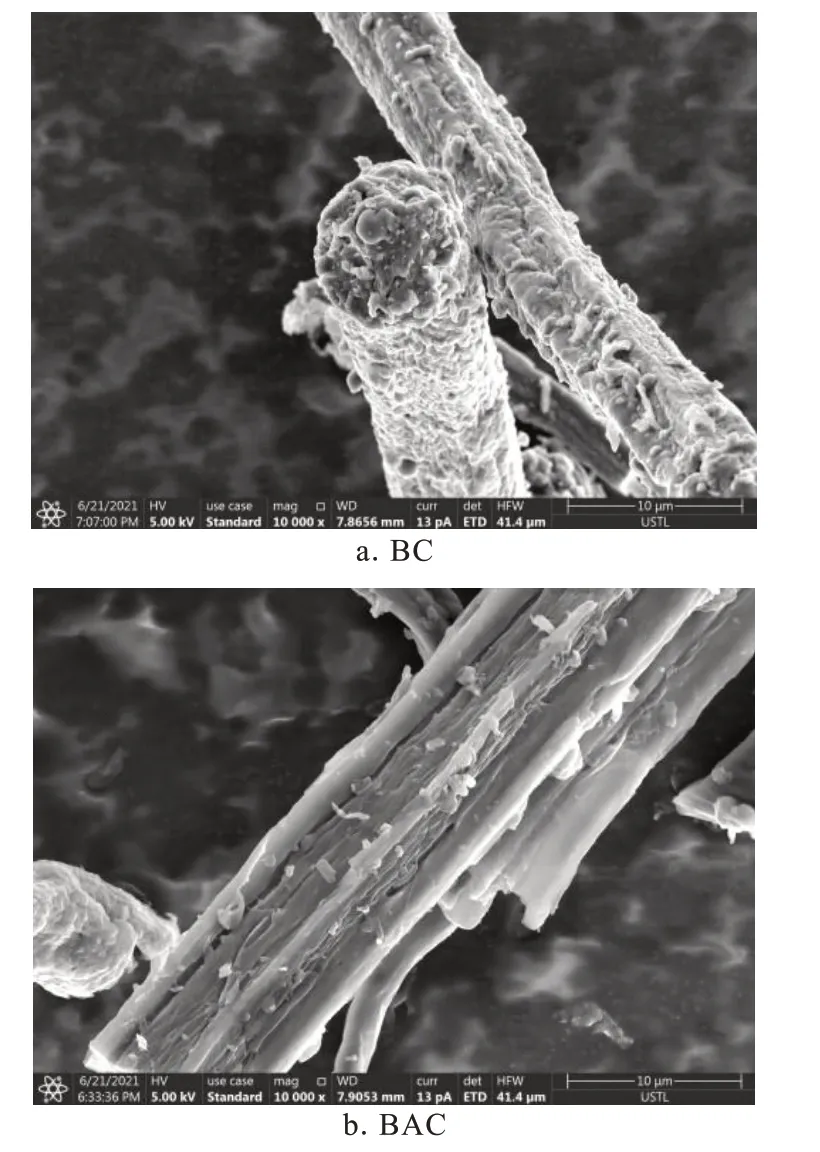
图2 竹纤维基炭纤维和竹纤维基活性炭的SEM照片Fig.2 SEM images of BC and BAC
2.2 BAC投加量对吸附效果的影响
向浓度为20 mg/L的Cr(Ⅵ)溶液(pH=7)中分别投加0.05~0.5 g的BAC,吸附温度恒定25℃,控制转速为120 r/min,进行吸附实验。BAC对Cr(Ⅵ)的去除率和吸附量如图3所示。当BAC的投加量为0.05 g时,去除率仅为67.72%,随着活性炭投加量的增加,BAC的去除率明显提高,在投加量为0.35 g时逐渐趋于平衡,当投加量为0.5 g时去除率达到100%。随着活性炭投加量的增加,活性位点充足,促进了活性炭对Cr(Ⅵ)的吸附[13-14]。同时,BAC的单位吸附量随BAC投加量的增加由13.54 mg/g降至2 mg/g。因为初始溶液中Cr(Ⅵ)含量是一定的,当活性炭吸附位点已经满足吸附需求时,过剩的吸附位点就会互相争夺Cr(Ⅵ),导致BAC单位吸附量降低。当投加量达到0.35 g时,去除率达到99.36%,此时BAC对Cr(Ⅵ)的吸附趋于饱和。考虑到制备活性炭的成本,选用BAC投加量为0.35 g进行后续实验。

图3 BAC投加量对Cr(Ⅵ)去除率和吸附量影响Fig.3 Effects of BAC dosage on Cr(Ⅵ)removal rate and adsorption capacity
2.3 溶液pH值对吸附效果的影响
向浓度为20 mg/L的Cr(Ⅵ)溶液中投加0.35 g BAC,调整pH值为1~13,吸附温度25℃,转速120 r/min,进行吸附实验。pH值对BAC吸附效果的影响如图4所示。pH值为1~7时,去除率均接近100%,pH值为9~13时,去除率明显降低。吸附量的变化规律与去除率一致。
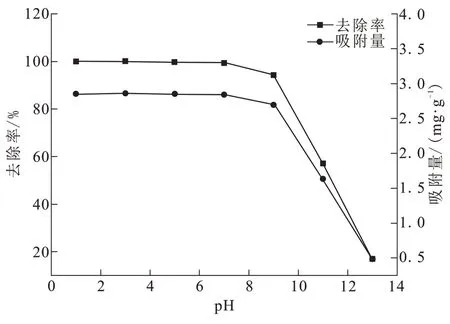
图4 pH值对Cr(Ⅵ)去除率和吸附量的影响Fig.4 Effects of pH value on Cr(Ⅵ)removal rate and adsorption capacity
pH值会影响生物质活性炭表面的官能团形态、电荷密度及溶液中被吸附离子的存在形态,进而影响吸附过程和吸附效果[14]。在酸性条件下,HCrO4-和Cr2O72-是Cr(Ⅵ)的主要存在形式[15],此时溶液中含有大量H+,BAC表面的—OH和—COO—等官能团会发生质子化,从而使其带正电[16]。在静电吸引的作用下,Cr(Ⅵ)迅速被带正电的活性炭吸附点吸附。其次在酸性溶液中,有一部分Cr(Ⅵ)离子可以被还原为Cr(Ⅲ)[17]。
随着pH值的增高,溶液中H+含量减少,此时Cr(Ⅵ)的主要存在形式向CrO42-转变,溶液中OH-含量不断增加,与铬酸盐产生竞争吸附,Cr(Ⅵ)自由度减少,与BAC表面基团之间的静电引力作用减弱。当pH值超过7,BAC表现为负电性,产生较强的表面斥力,部分Cr(Ⅵ)生成沉淀,从而阻碍其在BAC表面的吸附,导致吸附效果逐渐下降。
不同pH值范围吸附后滤液状态如图5所示。在酸性条件下,Cr(Ⅵ)基本被活性炭吸附完全,吸附后的滤液为澄清状态。在强碱性条件下,吸附后的滤液呈深紫红色,表明滤液中依然存在大量的Cr(Ⅵ)。因此,选用pH值为3作为最佳值进行后续吸附实验。

图5 不同pH值范围滤液状态Fig.5 States of filtrate under different pH values
2.4 溶液初始浓度对吸附效果的影响
BAC投加量0.35 g,pH=3,吸附温度25℃,转速120 r/min,Cr(Ⅵ)溶液初始浓度范围为20~140 mg/L。Cr(Ⅵ)溶液初始浓度对吸附效果的影响如图6所示。在20~60 mg/L较低浓度范围内,BAC对Cr(Ⅵ)的去除率稳定在99.6~100%之间;初始浓度大于60 mg/L后,去除率随着浓度的增大显著降低。BAC吸附量先较大幅度增高后缓慢增长,吸附量在浓度最高时达到15.784 mg/g。
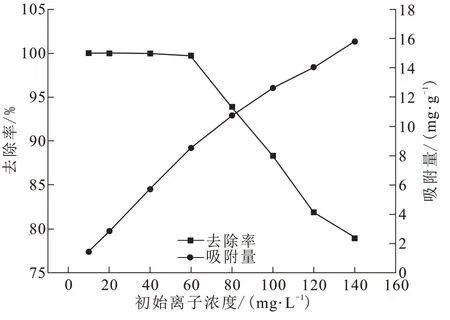
图6 溶液初始离子浓度对Cr(Ⅵ)去除率和吸附量的影响Fig.6 Effects of initial ion concentration in solution on Cr(Ⅵ)removal rate and adsorption capacity
在Cr(Ⅵ)浓度为20~60 mg/L范围内,传质推动力随着浓度的增加而增大,加快了离子扩散速度,活性炭可以充分地与溶液中的Cr(Ⅵ)相接触并将其吸附。当浓度增大到80 mg/L时,活性炭的吸附容量基本达到饱和,此时活性炭表面的高能量位点被占满,可供吸附的有效位点数量很少,吸附只能向低能量位点转移[18]。溶液中的Cr(Ⅵ)开始竞争BAC表面剩余的低活性位点,剩余的Cr(Ⅵ)残留于吸附液中,导致Cr(Ⅵ)去除率降低。
2.5 吸附时间对吸附效果的影响
向浓度为60 mg/L的Cr(Ⅵ)溶液中投加0.35 g BAC,在pH=3、吸附温度为25℃、转速120 r/min时,进行吸附实验。吸附时间对吸附效果的影响如图7所示。吸附时间越长,去除率越高。吸附量在60 min之前为快速吸附,150 min时,BAC基本达到饱和,此时去除率达到99.68%。之后吸附量几乎不随时间变化,稳定在8.544 mg/g。
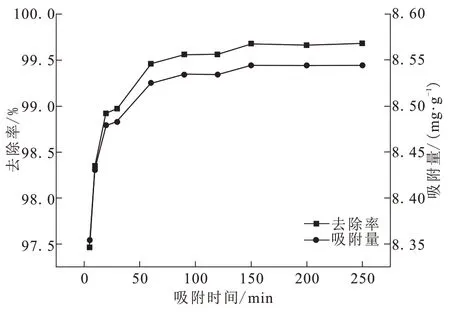
图7 吸附时间对Cr(Ⅵ)去除率和吸附量的影响Fig.7 Effects of adsorption time on Cr(Ⅵ)removal rate and adsorption capacity
一方面,在吸附初期,溶液中的Cr(Ⅵ)浓度较高,BAC与液相之间浓度差较大,Cr(Ⅵ)扩散速度加快,与BAC的活性位碰撞从而被吸附到孔隙。另一方面,在吸附初始阶段BAC表面可供反应的官能团及孔隙丰富,Cr(Ⅵ)极易附着于BAC表面,随着BAC表面可供结合的位点减少,吸附作用逐渐减弱,吸附反应逐渐达到平衡。
不同吸附时间滤液状态如图8所示。150 min时,滤液澄清,溶液里Cr(Ⅵ)几乎被去除完全。

图8 不同吸附时间滤液状态Fig.8 States of filtrate under different adsorption times
2.6 吸附动力学
为研究BAC的吸附动力学,控制BAC投加量为0.35 g,pH=3,吸附温度25℃,转速120 r/min,Cr(Ⅵ)溶液初始浓度分别为60、80、100、120 mg/L,进行吸附实验。实验结果如图9所示。在吸附开始的5 min内,吸附量迅速增加,之后趋于稳定,在150 min达到平衡吸附量。溶液浓度越高,吸附量越大。BAC对浓度60、80、100、120 mg/L Cr(Ⅵ)的 平 衡 吸 附 量 分 别 为8.544、10.651、12.269、13.448 mg/g,对应去除率分别达到99.68%、93.22%、85.88%、78.52%。
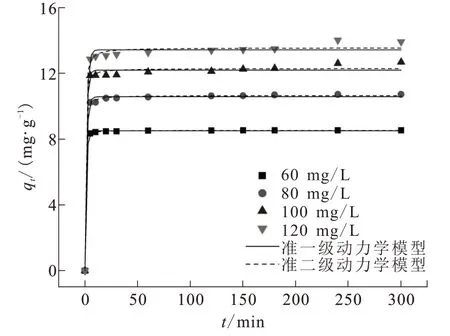
图9 BAC对Cr(Ⅵ)的吸附动力学拟合曲线Fig.9 Kinetics fitting curve of Cr(Ⅵ)adsorption by BAC
采用准一级动力学模型和准二级动力学模型拟合吸附曲线,计算动力学参数,结果详见表1。在不同浓度的Cr(Ⅵ)溶液中,两种动力学模型都能较好地解释吸附过程,但是准二级动力学模型拟合的R2值更高,预测的qe更加接近实测值,表明BAC对Cr(Ⅵ)的吸附过程更适合准二级动力学模型。吸附过程以化学吸附为主,同时,通过分子间范德华力进行物理吸附。
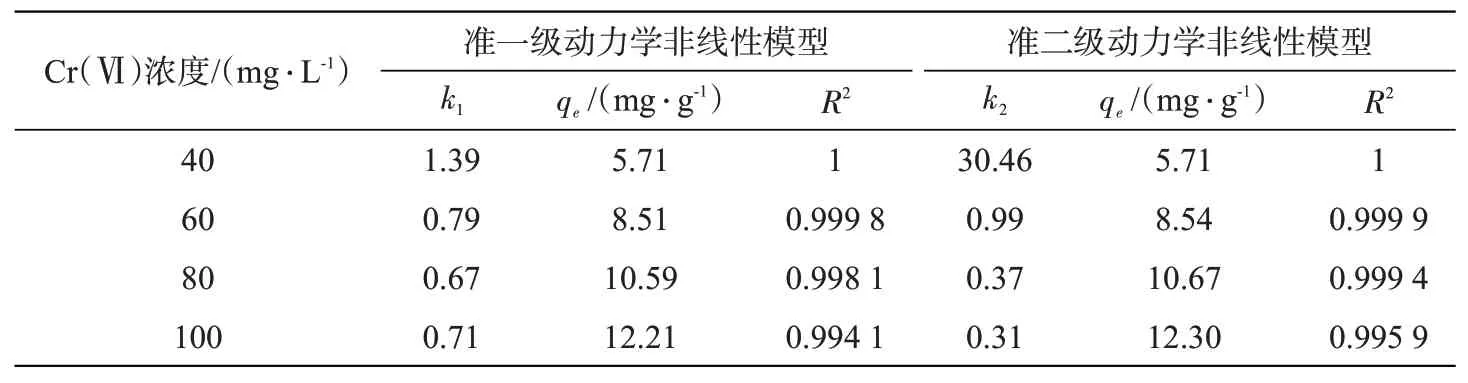
表1 BAC吸附Cr(Ⅵ)动力学模型参数Tab.1 Kinetic parameters for Cr(Ⅵ)adsorption by BAC
2.7 吸附热力学
分别在25、35、45℃进行等温吸附实验,采用Langmuir和Freundlich吸附等温模型拟合平衡吸附量qe与平衡浓度Ce关系曲线,如图10所示,模型参数计算结果详见表2。
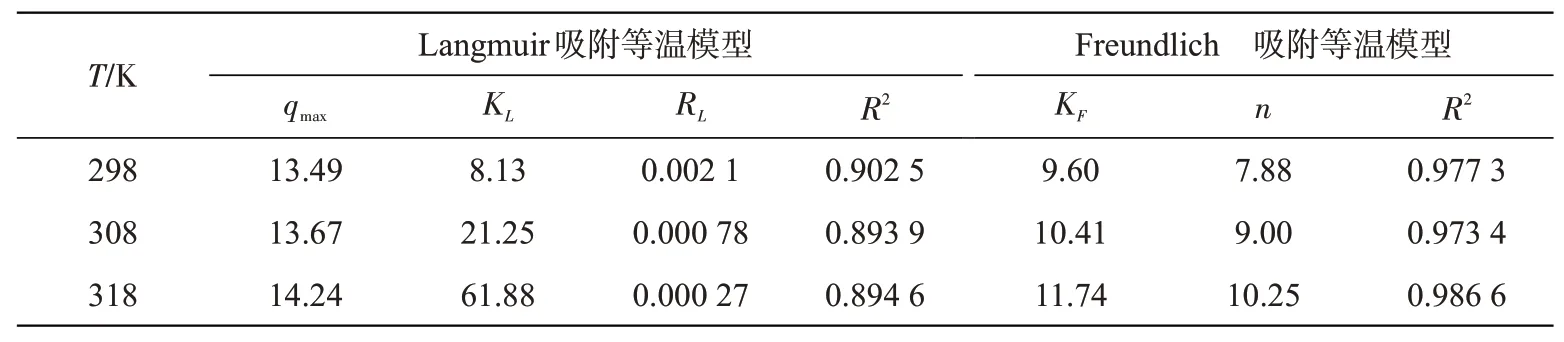
表2 BAC吸附等温模型参数Tab.2 Isothermal model parameters for adsorption of BAC

图10 Langmuir和Freundlich吸附等温模型拟合曲线Fig.10 Isotherm model fitting curves of Langmuir and Freundlich adsorptions
Freundlich模型的R2值更接近于1,表明BAC对Cr(Ⅵ)的吸附过程更符合Freundlich模型。根据Freundlich吸附理论,BAC表面的吸附热和吸附位点分布不均匀,低浓度时先发生单分子层吸附,高浓度时转为多分子层吸附,这与竹纤维基活性炭的多孔性结构相符。分离因子RL介于0~1之间,说明温度对吸附过程有利。KF值越上升,表明温度越高,BAC的吸附能力越强。Freundlich常数n值均大于2,表明吸附等温线具有良好的非均相吸附特征,同时说明吸附过程容易进行。
计算BAC吸附Cr(Ⅵ)的热力学参数ΔG°、ΔH°和ΔS°,结果如表3所示。三个温度下吸附过程的ΔG°都小于0,说明BAC在给定温度下的吸附行为都能自发进行。吸附过程的ΔS°大于0,表明吸附Cr(Ⅵ)的过程有序性降低,自由度增大。吸附过程的焓变ΔH°大于0,说明吸附反应为吸热过程。
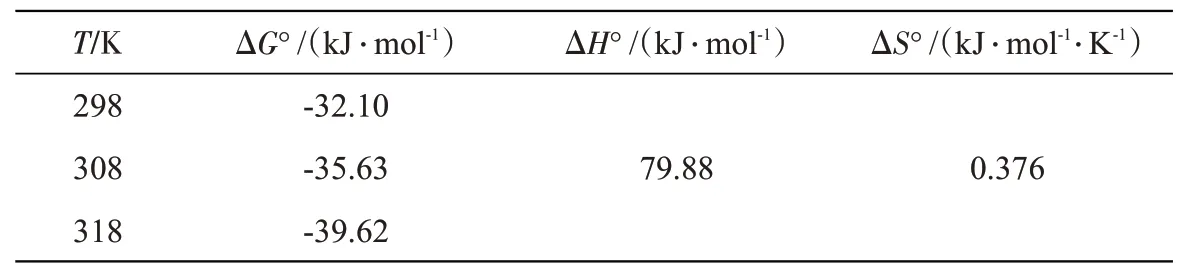
表3 BAC吸附Cr(Ⅵ)的热力学参数Tab.3 Thermodynamic parameters for Cr(Ⅵ)adsorption by BAC
3 结论
以造纸业废弃竹纤维为原料,以KOH为活化剂制备竹纤维基活性炭(BAC),考察BAC的投加量、溶液pH值、Cr(Ⅵ)溶液初始浓度和吸附时间对BAC吸附Cr(Ⅵ)效果的影响,采用吸附动力学模型和吸附等温模型探究吸附过程机制。
(1)Cr(Ⅵ)初始浓度为20 mg/L、BAC的投加量为0.35 g、溶液pH=3的条件下,BAC对Cr(Ⅵ)的去除率达到100%。在初始浓度增至60 mg/L时,BAC仍保持99.67%去除率。当吸附时间达到150 min时,基本达到饱和吸附。pH值为显著影响因素。
(2)动力学计算表明,准二级动力学模型能更好地解释竹纤维基活性炭对Cr(Ⅵ)的吸附过程,BAC对Cr(Ⅵ)的吸附是化学吸附和物理吸附共同作用的结果,化学吸附占主导。
(3)热力学计算结果表明,Freundlich模型更适合描述BAC的吸附行为,吸附过程近似于多分子层吸附,BAC对Cr(Ⅵ)的吸附过程是自发的吸热反应。

