亚临床甲状腺功能减退对2型糖尿病患者代谢指标的影响
王 柯,孔庆来
(曹县人民医院,山东 菏泽 274400)
糖尿病与甲状腺疾病是内分泌系统常见的代谢性疾病,糖尿病患者可出现多种激素水平异常,其中以亚临床甲状腺功能减退,又称亚临床甲减(Subclinical hypothyroidism,SCH)最为常见[1]。甲状腺激素为维持人体生理机能的重要激素,其缺乏可引起胆固醇降解和排泄减少,引起高胆固醇血症;甲状腺激素为升糖激素,其对血糖的影响较为复杂,既可增加葡萄糖在肠道的吸收及刺激糖异生,也可增加周围组织对葡萄糖的利用;甲状腺激素可直接作用于血管平滑肌细胞引起血管扩张,其分泌不足,导致外周血管收缩,血管阻力增加,血压升高。目前关于SCH对2型糖尿病(Type 2 diabetes,T2DM)患者的血糖、血脂、血压的影响结论不一,因此,本文通过比较观察组与对照组临床代谢指标,以观察SCH对T2DM患者代谢指标的影响,现报道如下。
1 资料与方法
1.1 一般资料 将2019年2月—2020年9月我院收治的2型糖尿病患者202例,根据甲状腺功能分为观察组与对照组。观察组121例合并SCH,男72例,女49例;年龄34~79岁,平均(57.17±12.05)岁;病程4~16年;体质量指数(BMI)平均(25.56±4.02)kg/m2。对照组81例不合并SCH,男57例,女24例;年龄30~74岁,平均(54.09±12.67)岁;病程3~12年;BMI平均(24.84±3.42)kg/m2。两组患者性别、年龄、病程、BMI等一般资料比较,P>0.05,差异无统计学意义,具有可比性。本研究经医院伦理委员会批准,所有患者及家属均知情同意。
纳入标准:T2DM的诊断符合《中国2型糖尿病防治指南(2017年版)》的诊断标准[2]:典型糖尿病症状+随机血糖≥11.1 mmol/L或空腹血糖≥7.0 mmol/L或葡萄糖负荷实验(OGTT)2 h血浆葡萄糖≥11.1 mmol/L;无典型糖尿病症状者需至少化验两次血浆葡萄糖数值均达到诊断标准;亚临床甲减的诊断符合《甲状腺疾病诊治指南-甲状腺功能减退症》的诊断标准[3]:血清促甲状腺激素(TSH)≥4.2 μIU/mL,血清游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)在正常参考范围内。排除标准:合并有糖尿病急性并发症、严重肝肾心脏及脑血管疾病者;既往有甲状腺疾病及服用过影响甲状腺功能的药物者;肿瘤患者;妊娠及哺乳期女性。
1.2 方法 (1)入院患者22:00之后禁饮食,次日清晨均进行口服葡萄糖耐量试验,采集空腹静脉血,分离血清,检测空腹血糖(FBG)、餐后2 h血糖(2 h PG)、空腹胰岛素(FINS)水平;采集空腹静脉血糖化血红蛋白(HbA1c),置于抗凝血管;采用稳态模型胰岛素抵抗指数(HOMAIR)评价胰岛素抵抗程度,HOMA-IR=FBG(mmol/L)×FINS(μU/mL)/22.5。(2)采用贝克曼AU5800全自动生化分析仪测定血脂代谢指标中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)。(3)均采用贝克曼DXI800发光仪器测定促甲状腺激素(TSH)、抗甲状腺过氧化物酶抗体(TPO-Ab)、甲状腺球蛋白抗体(TG-Ab)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)。(4)血压:血压测量两次,间隔1~2 min,以两次血压的平均值作为测量结果。
1.3 观察指标 (1)血糖代谢指标包括FBG、2 h PG、FINS、HbA1c、HOMA-IR。(2)血脂代谢指标包括TC、TG、HDL-C、LDL-C水平。(3)甲状腺检测指标包括FT3、FT4、TSH、TPO-Ab及TG-Ab。(4)血压包括收缩压和舒张压。
1.4 统计学处理 应用SPSS19.0软件进行统计处理,计量资料以表示,采用t检验;计数资料以n(%)表示,采用χ2检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 血糖代谢指标 观察组血糖代谢指标中2 h PG、FINS、HOMA-IR显著高于对照组(P<0.05);FBG、HbA1c水平高于对照组,两组比较,P均>0.05。见表1。
表1 两组血糖代谢指标比较(±s)

表1 两组血糖代谢指标比较(±s)
组别 n FBG(mmol/L) 2 h PG(mmol/L) FINS(μU/mL) HbA1c(%) HOMA-IR观察组 121 9.62 ±4.40 19.45±5.89 15.77±6.18 8.09±1.89 6.48±2.82对照组 81 8.82±2.95 17.36±5.02 12.58±4.98 8.05±2.66 4.72±2.41
2.2 血脂代谢指标 观察组血脂代谢指标中TC、LDL-C水平高于对照组,TG、HDL-C水平低于对照组,两组比较,P均>0.05。见表2。
表2 两组血脂代谢指标比较(±s)

表2 两组血脂代谢指标比较(±s)
组别 n TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)观察组 121 2.40±1.72 5.01±1.05 1.25±0.42 2.73±0.95对照组 81 2.58±2.21 4.96±1.29 1.32±1.23 2.50±1.02
2.3 甲状腺检测指标 观察组甲状腺检测指标中TSH、TPO-Ab、TG-Ab水平均显著高于对照组(P<0.05);FT4水平显著低于对照组(P<0.05);FT3水平低于对照组(P>0.05)。见表3。
表3 两组甲状腺检测指标比较(±s)
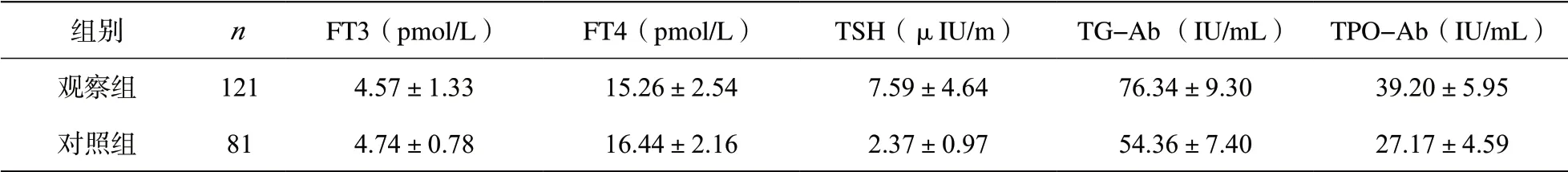
表3 两组甲状腺检测指标比较(±s)
组别 n FT3(pmol/L) FT4(pmol/L) TSH(μIU/m) TG-Ab (IU/mL) TPO-Ab(IU/mL)观察组 121 4.57±1.33 15.26±2.54 7.59±4.64 76.34±9.30 39.20±5.95对照组 81 4.74±0.78 16.44±2.16 2.37±0.97 54.36±7.40 27.17±4.59
2.4 血压水平 观察组收缩压水平(131.6±18.20)mm Hg,对照组为(125.1±14.19)mm Hg,两组比较,差异具有统计学意义(P<0.05);观察组舒张压水平(77.3±10.33)mm Hg,对照组(76.7±8.74)mm Hg,两组比较,差异无统计学意义(P>0.05)。
3 讨论
SCH起病隐匿,无明显临床症状,就诊时容易被忽视,给患者带来不利影响,而糖尿病合并亚临床甲减发病率呈升高趋势[4]。
目前国内外关于T2DM合并SCH对临床代谢指标影响的相关性研究结论尚存在争议。本研究发现观察组2 h PG、FINS、HOMA-IR明显高于对照组(P<0.05),观察组FBG较对照组升高(P>0.05),两组HbA1c水平比较,P>0.05。SCH对血糖代谢的影响可能机制:甲状腺激素在调节人体物质代谢中发挥着重要的作用,正常水平的甲状腺激素能够促进血糖的合成和分解代谢,而亚临床甲减对血糖的影响可能与高水平的TSH直接影响人体组织中瘦素水平,其对肝葡萄糖的生成具有刺激作用,TSH增加了肝脏中6-磷酸葡萄糖和磷酸烯醇丙酮酸羧基酶在mRNA水平上的表达,此外TSH减少胰岛素分泌及胰岛β细胞的合成,进而增加血糖水平[5]。SCH患者代谢减慢,致使肠道葡萄糖吸收能力下降,糖原分解及糖异生减少,基础胰岛素分泌减少,随着胰岛素敏感性降低,葡萄糖在外周组织中的作用也会下降,故胰岛素抵抗增加。
Liu Y等[6]研究显示T2DM合并SCH患者的TC、TG、LDL-C水平高于不合并SCH者,本研究显示观察组TC、LDL-C较对照组升高,TG、HDL-C较对照组降低,但均无显著性差异(P>0.05)。
国内有研究显示T2DM合并SCH血清TSH水平高于不合并SCH,FT3、FT4水平均低于不合并亚临床甲减组[7],本研究显示观察组TSH、TPO-Ab、TG-Ab水平均显著高于对照组(P<0.05),观察组FT4水平明显低于对照组(P<0.05),观察组FT3水平较对照组低(P>0.05)。分析其原因可能是随着糖尿病病程延长,胰岛功能逐渐衰减,导致合并亚临床甲减患者TSH活性下降,长时间的血糖代异常可引起机体免疫功能紊乱,TPO-Ab、TG-Ab异常升高,导致甲状腺组织破坏,甲状腺激素合成受阻,进而引起亚临床甲减或甲状腺功能减退,TPO-Ab、TG-Ab为桥本甲状腺炎的诊断性抗体,考虑T2DM出现亚临床甲减与桥本甲状腺炎有关,故糖尿病患者应注意筛查甲状腺自身抗体,尽早发现并纠正甲状腺功能异常。
童慧昕等[8]研究显示合并亚临床甲减的T2DM患者的高血压患病率高于未合并亚临床甲减者,在单变量多元回归分析中发现血压与TSH呈正相关,本研究显示观察组血压高于对照组,且两组收缩压具有显著性差异(P<0.05),提示亚临床甲减可增加高血压风险,故对患有SCH的T2DM患者要重视血压的管理。亚临床甲减对血压影响的可能机制:甲状腺激素是人体调节新陈代谢最重要的激素,分泌不足可导致新陈代谢减慢,热量消耗减少,体重增加,而超重或肥胖是高血压的重要危险因素,亚临床甲减时,促甲状腺激素升高,其刺激交感神经,使交感神经兴奋性增高,导致心率增快,心肌收缩力增强,心脏排出量增加,可引起外周小动脉收缩,使外周血管阻力增加,血压升高。
综上所述,随着对糖尿病与甲状腺疾病的深入研究,亚临床甲减可能对2型糖尿病患者的血糖、血压产生不利影响,因此T2DM患者应常规筛查甲状腺功能,及早发现并积极干预,这将会对糖尿病患者综合管理产生积极影响。

