甘草多糖的抗氧化及降血糖作用研究
王 晴,洪 叶,柳振宇,林长青
(延边大学,医学院,吉林延吉 133000)
甘草(Glycyrrhiza uralensisFisch.)又名国老、甜草,为豆科甘草属多年生草本植物[1]。目前,已经从甘草中分离出大量的生物活性物质,如香豆素类、挥发油类、皂苷类、多糖类等[2]。多糖是一类结构多样的大分子,由单糖残基通过糖苷键相互连接而成的聚合物[3]。甘草多糖是一种酸性吡喃多糖,内部有小气泡状孔洞。研究发现,甘草多糖因其具有抗氧化[4],调节免疫活性[5],抗菌[6],抑制肿瘤生长[7],抗炎[8],生物制药[9]等特性而备受关注。另有研究指出,甘草多糖可以抑制α-葡萄糖苷酶的活性,有助于缓解高血糖[10]。
1型糖尿病(T1DM)的发展受多重因素的影响,其中遗传和环境因素最为主要[11],在世界范围内,患病人数激增,已引起越来越多学者们的重视。T1DM的发病原因主要由于体内胰岛素分泌不足,不能将摄入的物质及时分解,使得机体内糖代谢失调,最终导致血糖升高,引发糖尿病。T1DM的发病机制复杂,不仅是单一的异常血糖代谢疾病,更是全身代谢紊乱疾病,它已严重影响人们的生活质量。近年来,随着T1DM患者数量的增加,治疗药物也越来越多。但目前市面上的降糖药物主要以西药为主,西药具有很多的副作用,长期服用会造成内分泌失调,产生较强依赖性,甚至会诱发癌变等[12],因此更加青睐对药食两用的中药资源在降血糖方面的开发。
但目前有关甘草多糖的报道多集中在甘草多糖的提取工艺以及纯化研究[13-14],对于甘草多糖对降血糖的作用还鲜有报道。实验拟研究甘草多糖的抗氧化及降血糖作用,旨在开发出更多甘草产品,为临床治疗糖尿病提供新的思路。
1 材料与方法
1.1 材料与仪器
甘草 市售,产自甘肃,2020年9月收获,规格为二等甘草;6周龄C57BL/6小鼠 雄性,无特定病原体(SPF)级,50只,体重(25±2)g,长春亿斯实验动物中心,合格证书:SCXK(吉)2018-0007。符合《延边大学实验动物伦理守则》,获得延边大学实验动物伦理委员会批准;DPPH自由基(DPPH·)清除能力检测试剂盒、ABTS自由基(ABTS+·)清除能力检测试剂盒、总胆固醇(Total Cholesterol, TC)、甘油三酯(Triglyceride, TG)、高密度脂蛋白(High-density lipoprotein, HDL-C)、低密度脂蛋白(Low-density lipoprotein, LDL-C)试剂盒 北京索莱宝科技有限公司;链脲佐菌素(Streptozotocin, STZ) 99.9%,美国Sigma公司;盐酸二甲双胍缓释片 北京太洋药业有限公司;超氧化物歧化酶(Super Oxide Dismutase, SOD)活性检测试剂盒、过氧化氢酶(Catalase,CAT)检测试剂盒、总谷胱甘肽 (Glutathione, GSH)检测试剂盒、脂质氧化(Malondialdehyde, MDA)检测试剂盒 上海碧云天生物技术有限公司。
HH-4型四孔数显恒温水浴锅 江苏科析仪器有限公司;DHG-9070A型立式鼓风干燥箱 上海一恒科学仪器有限公司;XL-10B型扣压摇摆式粉碎机
杭州旭众机械设备有限公司; SuPerMax 3100型多功能酶标仪 上海闪谱生物科技公司。
1.2 实验方法
1.2.1 甘草多糖提取及纯化 将甘草烘干,粉碎后过40目筛,参照张光辉等[15]的方法并稍作改动,甘草:水比为1:20(g/mL),提取时间3 h,提取温度80 ℃,浸提两次,合并提取液,用85%乙醇醇沉24 h,取沉淀,用氯仿-正丁醇除去提取物中蛋白,冻干成粉,4 ℃保存备用。取甘草多糖粗提物,用分子量为3500 Da的透析袋透析24 h,过DEAE-52纤维素柱,分别用水、0.1 mol/L NaCl、0.2 mol/L NaCl进行洗脱,速度为1 mL/min,再过葡聚糖凝胶G-200柱子,用蒸馏水进行洗脱,速度为1 mL/min,旋蒸浓缩,并冻干成为甘草多糖。
1.2.2 甘草多糖的多糖含量测定 采用苯酚硫酸法[16]测定多糖含量,称取标准葡聚糖10 mg于250 mL容量瓶中,加水至刻度,分别吸取0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL,各以蒸馏水补至1.0 mL,加入1 mL 6%苯酚,5.0 mL浓硫酸,30 ℃水浴30 min,486 nm测吸光度,以葡聚糖浓度为横坐标,吸光度为纵坐标绘制标准曲线。称取样品1 mg,溶于1 mL水中,按上述方法进行测定,并根据标准曲线计算多糖含量。
1.2.3 甘草多糖的抗氧化性测定
1.2.3.1 DPPH·清除率的测定 根据王秋丹等[17]方法并稍作改动,称取5 mg甘草多糖,溶于5 mL蒸馏水中,原液浓度为1000 μg/mL,将原液按梯度稀释为800、400、200、100、50 μg/mL,以VC作为对照组,样品组:取不同浓度样品液1 mL于5 mL离心管中,并加入3 mL DPPH溶液,样品对照组:样品液加3 mL甲醇溶液吸光度为Aj,空白对照组:1 mL甲醇溶液加3 mL DPPH溶液吸光度为A0。3500 r/min离心20 min,在517 nm处测吸光度,按公式(1)进行计算。

式中:Ai:样品组吸光度;Aj:样品对照组吸光度;A0:空白对照组吸光度。
1.2.3.2 ABTS+·清除率的测定 准确称取干燥至恒重的ABTS标准品180 mg,加入50 mL蒸馏水,加入33 mg过硫酸钾,室温避光放置12~24 h备用。用蒸馏水稀释并调节至405 nm照射吸光度OD值调节在0.70±0.02范围内。
样品溶液的制备:用蒸馏水配制1000、800、400、200、100、50 μg/mL的甘草多糖提取液、VC溶液作对照,取不同浓度样液30 μL加入配好的ABTS溶液270 μL,酶标仪于405 nm处测定吸光度值Ai,等体积蒸馏水代替ABTS溶液做空白对照组Aj,蒸馏水替代样品作为对照组A0。每个样品浓度平行三次实验,取平均值。ABTS+·清除率按公式(2)进行计算。
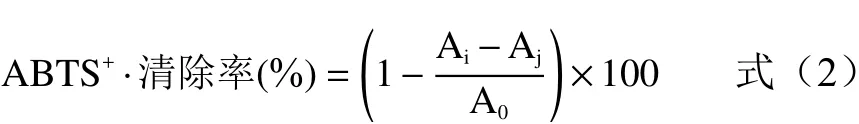
式中:Ai为30 μL甘草多糖溶液加入270 μL ABTS溶液于405 nm处的吸光度;Aj为30 μL甘草多糖溶液加入270 μL蒸馏水于405 nm处的吸光度;A0为30 μL蒸馏水加入270 μL ABTS溶液于405 nm处的吸光度。
1.2.4 甘草多糖的降血糖作用研究
1.2.4.1 动物分组及给药 50只C57BL/6小鼠,分为5组,每组10只,正常组(灌胃蒸馏水200 mg/kg·BW),模型组(灌胃蒸馏水200 mg/kg·BW),甘草多糖低剂量组(甘草多糖200 mg/kg·BW),甘草多糖高剂量组(甘草多糖400 mg/kg·BW),阳性组(二甲双胍200 mg/kg·BW),剂量设定通过前期预实验而定。动物适应性喂养1周,除正常组外,其他组别连续5 d腹腔注射STZ(30 mg/kg·BW)建立T1DM模型,每天上午9:00进行灌胃,连续灌胃8周,实验期间对所有小鼠的体重进行记录,造模成功后每两周对小鼠进行隔夜禁食,禁食不禁水,次日采用尾尖取血测定空腹血糖值(FBG)并记录。
1.2.4.2 小鼠口服糖耐量测定 参照王秋丹等[17]的方法进行口服糖耐量(OGTT)实验,在实验最后一天灌胃1 g/kg·BW葡萄糖溶液,分别于灌胃0、30、60、90 min使用尾尖取血测定小鼠血糖值。
1.2.5 小鼠TC、TG、HDL-C、LDL-C测定 实验结束后,眼球取血,室温静置2 h,3000 r/min离心10 min,将离心后的上清液吸至1.5 mL离心管中,即为血清,按试剂盒要求取上血清行各项指标的测定。
1.2.6 小鼠SOD、GSH、CAT、MDA测定 小鼠解剖后,将肝脏取出并称重,按肝脏:生理盐水为1:3的比例制备成组织匀浆,并按试剂盒说明书依次加入反应液,测定肝脏组织中SOD、GSH、CAT、MDA活性及含量。
1.3 数据处理
使用SPSS 23.0软件对数据进行统计学分析和显著性差异分析,结果以均值±标准偏差表示,P<0.05表示有显著性差异。
2 结果与分析
2.1 甘草多糖的含量
多糖的标准曲线方程为y=10.1741x+0.0237(R2=0.9901),计算出多糖含量为690 mg/g。
2.2 甘草多糖对DPPH·、ABTS+·的清除能力
图1为甘草多糖在不同浓度下对DPPH·、ABTS+·的清除能力,在50~1000 μg/mL范围内,甘草多糖对DPPH·、ABTS+·的清除能力呈现剂量依赖性升高,且在1000 μg/mL浓度下达到最高,对二者的清除能力分别为82.84%±0.80%,85.52%±2.27%,但均与VC有极显著性差异(P<0.01)。甘草多糖清除DPPH·和ABTS+·的IC50值为162.8 μg/mL和74.3 μg/mL,可见甘草多糖有着良好的抗氧化性。
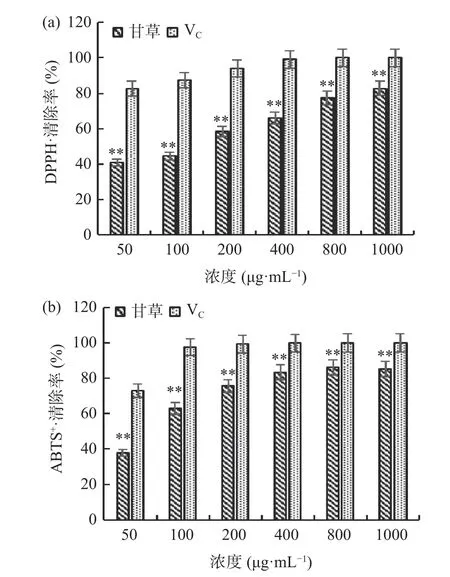
图 1 甘草多糖对DPPH·、ABTS+·的清除能力Fig.1 The scavenging capacity of Glycyrrhiza polysaccharide on DPPH·, ABTS+·
2.3 甘草多糖对小鼠体重、FBG的影响
体重减轻以及FBG升高是糖尿病的典型特征[18]。表1为T1DM小鼠体重,在实验结束时,与正常组相比,模型组小鼠的体重显著降低(P<0.05),但经高、低剂量的甘草多糖灌胃后的T1DM小鼠体重下降得到缓解,且高剂量组与低剂量组间无显著性差异(P>0.05),高剂量组与阳性组间无显著性差异(P>0.05)。表2为T1DM小鼠FBG,经8周的灌胃后,各小鼠的FBG差异显著(P<0.05)。与模型组相比,灌胃了甘草多糖的T1DM小鼠的FBG显著下降(P<0.05),在第8周时,甘草多糖高剂量组与低剂量组和阳性组间均无显著性差异(P>0.05)。这表明,甘草多糖能够缓解T1DM小鼠体重的下降,并控制其FBG的升高,具有一定的治疗糖尿病的潜力。

表 1 T1DM小鼠体重(g)Table 1 Body weight of T1DM rats (g)
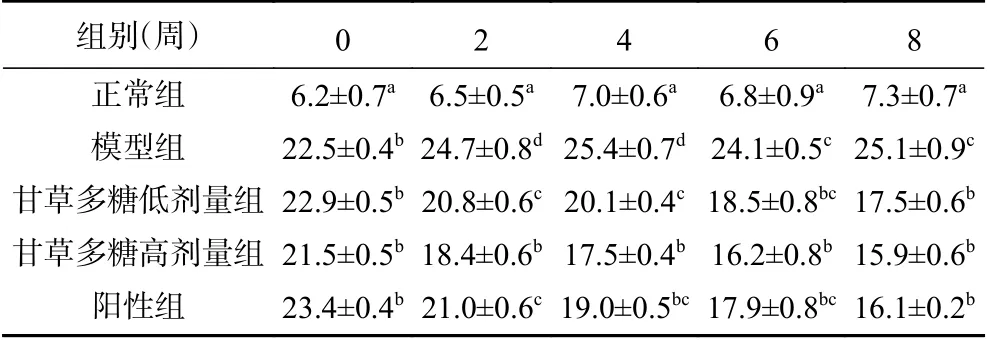
表 2 T1DM小鼠空腹血糖值(mmol/L)Table 2 Fasting blood glucose of T1DM rats (mmol/L)
2.4 甘草多糖对T1DM小鼠OGTT的影响
OGTT能够反映机体对葡萄糖的耐受能力。由图2所示,在灌胃葡萄糖后,小鼠血糖含量在30 min内急剧升高,在30 min时血糖均达到了最高值,随后呈现下降趋势,且高剂量组的糖耐量极显著优于模型组(P<0.01)。经甘草多糖灌胃后,可能调节了T1DM小鼠体内对葡萄糖的摄取及利用,从而降低了其FBG水平,提高了机体的OGTT水平。可见,甘草多糖能够提高T1DM小鼠对葡萄糖的耐受能力。

图 2 甘草多糖对T1DM小鼠OGTT的影响Fig.2 Effect of Glycyrrhiza polysaccharide on OGTT of T1DM rats
2.5 甘草多糖对小鼠TC、TG、HDL-C、LDL-C的影响
机体中TC、TG、HDL-C、LDL-C能够反映机体对脂代谢的调控能力。图3为甘草多糖对T1DM小鼠血脂水平的影响,与正常组相比,模型组中TC、TG、LDL-C水平极显著升高(P<0.01),HDL-C水平极显著降低(P<0.01),甘草多糖高剂量组TC、TG、HDL-C、LDL-C分别为2.79±0.36、0.98±0.12、1.28±0.23、1.67±0.29 mmol/L,可见经其治疗后能够极显著降低TC、TG、LDL-C的水平(P<0.01),极显著提高HDL-C的水平(P<0.01)。这可能由于甘草多糖在体内水解吸收后,参与了T1DM小鼠的脂代谢反应,从而改善了异常血脂水平。由此能够说明甘草多糖具有调节脂代谢的作用。
2.6 甘草多糖对T1DM小鼠氧化指标的影响
在上述实验中已证明甘草多糖在体外具有良好的抗氧化性,实验进一步在体内实验中测定其是否具有调节相关氧化酶的作用。SOD是生物体系中抗氧化酶系的重要组成成员,GSH是机体内广泛存在的一种重要的过氧化物分解酶,CAT促使过氧化氢分解为分子氧和水,使细胞免于遭受H2O2的毒害,MDA是一种由脂质过氧化反应的产物[19]。图4为甘草多糖对T1DM小鼠SOD、GSH、CAT、MDA水平的影响,结果显示,模型组中SOD、GSH、CAT、MDA水平分别为224.3 U/mg、121.5 μmol/g、50.2 U/mg、16.4 nmol/mgprot,与正常组相比均有极显著性差异(P<0.01),经甘草多糖高剂量组治疗后,SOD、GSH、CAT、MDA水平为425.4±16.37 U·mg-1、169.3±13.28 μmol·g-1、61.6±3.16 U·mg-1、7.5±0.83 nmol/mg prot,与模型组相比有极显著性差异(P<0.01),且趋于阳性组。这是由于T1DM小鼠体内不能分泌足够的胰岛素,间接导致体内氧化应激相关酶水平发生显著变化,经甘草多糖治疗后可有效改善这些指标的水平。由此证明,甘草多糖不仅在体外具有抗氧化作用,在体内也具有调节抗氧化酶的作用。由此推测,甘草多糖可能是通过改善T1DM小鼠机体内的氧化应激水平从而起到降血糖作用。

图 3 甘草多糖对T1DM小鼠TC、TG、HDL-C、LDL-C的影响Fig.3 The effect of Glycyrrhiza polysaccharide on TC, TG,HDL-C, LDL-C in T1DM mice
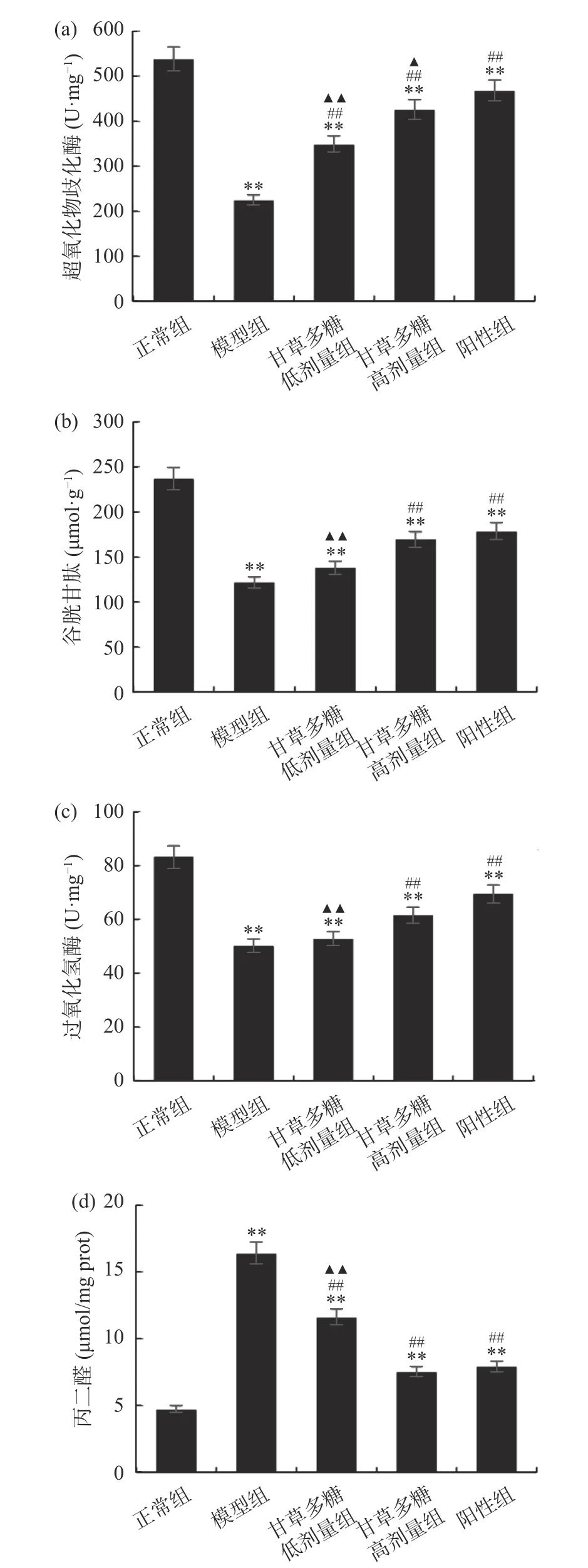
图 4 甘草多糖对T1DM小鼠SOD、GSH、CAT、MDA的影响Fig.4 The effect of Glycyrrhiza polysaccharide on SOD、GSH、CAT、MDA in T1DM mice
3 讨论与结论
正常情况下,机体氧化还原系统处于动态平衡,当机体处于应激、病理状态时,会产生·OH、DPPH·等强氧化自由基[20]。植物多糖可通过直接或间接清除自由基,或是提高抗氧化酶活性或降低氧化酶活性起到抗氧化作用。本实验中,显示在甘草多糖清除DPPH·和ABTS+·的IC50值分别为162.8 和74.3 μg/mL。可见,甘草多糖在体外具有良好的抗氧化性。
本实验又进一步研究了其对T1DM小鼠的降血糖作用以及体内抗氧化性。糖尿病的典型症状为“三多一少”,对葡萄糖的耐受能力减弱,因此选取体重、FBG以及OGTT作为基础测定指标,结果显示,经甘草多糖治疗后的T1DM小鼠体重下降缓慢,FBG也明显下降,OGTT有所提高。胰岛素代谢失调会引发血脂异常,体内胰岛素的缺乏导致摄入的脂肪等不能被利用,使得机体内脂肪加速分解,脂肪分解所产生的游离脂肪酸(FFA)进入肝脏生成TG和酮体,会间接导致TC、HDL-C、LDL-C发生变化,最终导致体内血脂异常[21-22]。T1DM会导致机体内异常脂代谢情况的发生[23],其中甘油三酯水平显著升高为1型糖尿病最为突出的脂代谢紊乱表现[24]。结果显示,甘草多糖能够改善T1DM小鼠的异常脂代谢情况。其原因可能是T1DM小鼠对葡萄糖利用失调,脂肪分解增加,从而产生了大量的游离脂肪酸,组织吸收脂肪酸的能力降低,FFA大量释放到血液和肝脏中[25],导致TC、TG、LDL-C的含量增多。糖尿病患者机体内氧自由基含量增多,过多的氧自由基与脂质相互作用产生过氧化反应生成MDA。GSH在体内既是重要的抗氧化剂又是自由基清除剂,能够与体内过多的自由基结合,从而将过多的有害物质清除,排泄出体外[26]。CAT与SOD在机体中具有较强的抗氧化能力,在体内能够抑制氧自由基的生成,能够减少氧自由基对细胞造成的伤害,并且能够降低MDA的生成量[27]。在本试验中,与正常对照组相比,T1DM小鼠血清的MDA浓度极显著增加(P<0.01),而SOD、GSH、CAT浓度极显著降低(P<0.01),表明T1DM小鼠出现了氧化应激反应。与正常对照组小鼠相比,甘草多糖治疗后能够显著抑制这些标志物的变化。
本文结果说明甘草多糖具有良好的抗氧化活性以及降血糖作用,认为其对1型糖尿病的降血糖作用可能是通过改善异常脂代谢以及机体氧化应激从而发挥作用,该研究可为甘草多糖在1型糖尿病的治疗方面提供新的思路,后续可对甘草多糖的降血糖机制以及在细胞层面进行深入研究。

