局部晚期或转移性肺腺癌罕见基因突变患者的临床特征和生存分析
林青岳,屈晶晶,周建英
310003 杭州,浙江大学医学院附属第一医院呼吸与危重症医学科
肺癌是全球癌症中发病率和病死率最高的癌症之一[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)的发生率为85%~90%,主要包括腺癌(40%~50%)和鳞癌(20%~30%)[2]。大约30%的NSCLC患者存在对靶向治疗敏感的基因改变,如表皮生长因子受体(epidermal growth factor receptor,EGFR)19号外显子缺失和21号外显子L858R突变,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排,c-ros原癌基因1(c-ros oncogene 1,ROS1)融合[3]。然而对于鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF)V600E突变、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)突变、转染重排(rearranged during transfection,RET)融合基因、EGFR20外显子插入(EGFRexon 20 insertion mutations,EGFR20-ins)等罕见突变,化疗联合免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)或贝伐珠单抗仍是其常规一线治疗方案。
随着近年来相应靶向药物的陆续上市,上述患者开始接受选择性靶向药物治疗。但由于上述基因突变是罕见的,在具有这些突变的中国晚期肺腺癌患者中最佳治疗方案尚未得到很好的探索。因此,我们采用回顾性队列研究设计方案,分析了BRAFV600E突变、HER2突变、RET融合基因、EGFR20-ins突变晚期肺腺癌患者的临床特征及不同治疗方案的临床疗效,为指导临床提供依据。
1 对象与方法
1.1 研究设计方案
本研究采用回顾性队列研究设计方案,筛选2019年10月到2021年12月就诊于浙江大学附属第一医院呼吸内科或肿瘤科,诊断为晚期或局部晚期肺腺癌患者。收集BRAFV600E突变、HER2突变、RET融合基因、EGFR20-ins突变的晚期肺腺癌患者,分别将每组患者分成化疗±贝伐珠单抗组、化疗+ICIs组及选择性靶向药组,分别比较各突变组内不同治疗方案的临床疗效差异,为晚期肺腺癌罕见基因突变的治疗方案制定提供临床参考。其中一线化疗中培美曲塞±铂类占98%;二线化疗中培美曲塞±铂类占33%,白蛋白紫杉醇±铂类占50%。ICIs主要包括帕博利珠单抗、信迪利单抗、卡瑞利珠单抗、替雷利珠单抗、特瑞普利单抗。不同基因突变患者具体靶向用药见表1。本研究由浙江大学医学院附属第一医院临床研究伦理委员会批准(IIT20221051A)。

表1 不同基因突变肺腺癌患者具体靶向用药
1.2 病例纳入
诊断标准:经我院病理科组织病理诊断为肺腺癌,采用聚合酶链式反应(PCR)或高通量测序技术(NGS)检测BRAFV600E突变、HER2突变、RET融合基因和EGFR20-ins突变。纳入标准:①ECOG体力状况评分为0~2分;②接受化疗、免疫治疗或选择性靶向治疗的患者;③年龄18~85岁,未合并其他类型活动性肿瘤;④存在BRAFV600E突变、HER2突变、RET融合基因或EGFR20-ins突变;⑤至少有一个客观可测量或可评价的肿瘤病灶;⑥分期为ⅢB期、ⅢC期以及Ⅳ期的肺腺癌患者;⑦预计生存时间>3个月,至少治疗2个月,有随访结果可评价疗效。排除标准:病例资料不完整或不能接受随访者。根据入排标准,最终入选患者71例。
1.3 观察指标及疗效评价标准
主要观察指标为:无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS),次要观察指标为:客观缓解率(objective response rate,ORR)及药物不良反应。疗效评估根据实体瘤疗效评价标准1.1版(RECIST 1.1)[4],药物不良反应根据CTCAE 4.0分级[5],最后一次随访时间为2022年8月1日。
1.4 统计学分析
采用χ2检验比较不同基因突变患者之间的临床特征,采用Kaplan-Meier曲线进行生存分析。所有的统计和图表分析使用GraphPad Prism 8进行。P<0.05视为差异有统计学意义。
2 结果
2.1 临床特征
根据纳入和排除标准,最终纳入BRAFV600E突变患者14例、HER2突变患者22例、RET融合基因患者20例、EGFR20-ins突变患者15例,病人筛查流程见(图1)。
入组71例患者中,女性占52%,70%从不吸烟,中位年龄61(37~83)岁,61%的患者年龄<65岁。确诊时70%患者为Ⅳ期,9%为ⅢC期,17%为术后复发,17%存在脑转移,大多数(96%)患者的ECOG功能状态为0~1。4组患者在性别、年龄、吸烟史、ECOG评分、TNM分期及有无脑转移的临床资料基线水平一致,P>0.05(表2)。
2.2 BRAF V600E突变患者疗效分析
所有患者(n=14)的中位随访时间为15.5(5.5~32.4)个月。一线治疗中,43%(6/14)的患者接受化疗±贝伐珠单抗治疗,28%(4/14)接受化疗+ICIs治疗,28%(4/14)接受达拉非尼-曲美替尼双靶向治疗。一线治疗的mPFS为6.3个月(95%CI:4.3~7.6)(图2A)。化疗±贝伐珠单抗组的ORR、mPFS、mOS分别为83%、6.3个月、18.2个月,化疗+ICIs组的ORR、mPFS、mOS分别为75%、4.7个月、17.6个月,达拉非尼-曲美替尼组的ORR、mPFS、mOS分别为75%、15.8个月、23.2个月(表3)。达拉非尼-曲美替尼组的mPFS长于化疗±贝伐珠单抗组及化疗+ICIs组,但差异无统计学意义(P=0.426 5,图2B);达拉非尼-曲美替尼组的mOS长于化疗±贝伐珠单抗组及化疗+ICIs组,差异亦无统计学意义(P=0.833 7,图2D)。

图1 晚期肺腺癌罕见基因突变患者筛查流程图

表2 71例晚期肺腺癌不同基因突变患者的临床基线特征 [例(%),M(Pmin,Pmax)]

表3 BRAF V600E突变肺腺癌患者不同治疗方案的ORR、PFS和OS [例(%),M(Pmin,Pmax)]

A:总体PFS;B:不同治疗方案的PFS;C:总体OS;D:不同治疗方案的OS
2.3 HER2突变患者疗效分析
所有患者(n=22)的中位随访时间为14(6.3~35.4)个月。一线治疗中,36%(8/22)的患者接受化疗±贝伐珠单抗治疗,50%(11/22)接受化疗+ICIs治疗,14%(3/22)接受HER2抑制剂(吡咯替尼/舒沃替尼)治疗。18例患者疾病进展,17例接受二线治疗,3例接受HER2抗体偶联药物(antibody-drug conjugate,ADC)作为四五线治疗。
一线治疗的mPFS为5.3个月(95%CI:3.0~7.0,图3A)。化疗±贝伐珠单抗组的ORR、mPFS、mOS分别为25%、5.2个月、13.6个月;化疗+ICIs组的ORR、mPFS、mOS分别为64%、8.7个月、26.8个月;HER2抑制剂组的ORR、mPFS、mOS分别为33%、2.9个月、NR(表4)。化疗+ICIs组的mPFS长于化疗±贝伐珠单抗组及HER2抑制剂组,差异有统计学意义(P=0.013 5,图3B);HER2抑制剂组的mOS未达到,化疗+ICIs组的mOS长于化疗±贝伐珠单抗组,但差异无统计学意义(P=0.071 8,图3D)。
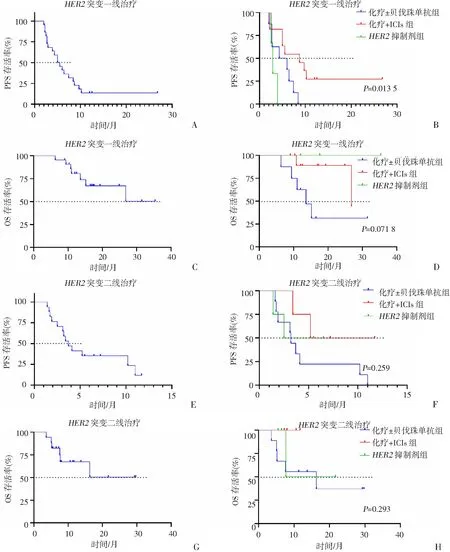
A、E:一、二线治疗总体PFS;B、F:一、二线治疗不同治疗方案的PFS;C、G:一、二线治疗总体OS;D、H:一、二线治疗不同治疗方案的OS
二线治疗的mPFS为3.7个月(95%CI:2.5~4.9,图3E),较一线mPFS短。各治疗组的ORR、mPFS、mOS见表4。化疗+ICIs组的mPFS长于化疗±贝伐珠单抗组及HER2抑制剂组,但差异无统计学意义(P=0.259,图3F)。二线治疗的mOS未达到(图3G),各治疗组间mOS无统计学意义(图3H)。在所有接受系统治疗的患者中,3例接受HER2 ADC治疗(全为四线、五线),其中2例分别取得8、11.5个月的PFS,且目前均未进展。
2.4 RET融合基因患者疗效分析
所有患者(n=20)的中位随访时间为17.7(6.8~39.8)个月。一线治疗中,25%(5/20)的患者接受化疗±贝伐珠单抗治疗,45%(9/20)接受化疗+ICIs治疗,30%(6/20)接受RET抑制剂(普拉替尼/塞尔帕替尼)治疗。16例疾病进展,其中11例接受二线治疗。
一线治疗的mPFS为7.8个月(95%CI:6.8~8.8,图4A)。化疗±贝伐珠单抗组的ORR、mPFS、mOS分别为40%、7.8个月、NR;化疗+ICIs组的ORR、mPFS、mOS分别为56%、6.7个月、NR;RET抑制剂组的ORR、mPFS、mOS分别为83%、17.5个月、27.2个月(表5)。RET抑制剂组的mPFS长于化疗±贝伐珠单抗组及化疗+ICIs组,差异无统计学意义(P=0.092 3,图4B)。一线治疗的mOS未达到(图4C),各治疗组间mOS两两相比差异无统计学意义(图4D)。
二线治疗的mPFS为3.8个月(95%CI:3.5~4.1,图4E)。各治疗组的ORR、mPFS、mOS见表5。RET抑制剂组的mPFS小于化疗±贝伐珠单抗组及化疗+ICIs组,但差异无统计学意义(P=0.810 2,图4F)。二线治疗的mOS未达到(图4G)。
2.5 EGFR 20-ins突变患者疗效分析
所有患者(n=15)的中位随访时间为13.4(6.1~28.1)个月。一线治疗中,53%(8/15)的患者接受化疗±贝伐珠单抗治疗,20%(3/15)接受化疗+ICIs治疗,27%(4/15)接受靶向药(埃万妥单抗/莫博替尼/双剂量伏美替尼)治疗。12例患者疾病进展,8例接受二线治疗,其中6例为靶向药治疗。
一线治疗的mPFS为9.8个月(95%CI:3.6~16,图5A),化疗±贝伐珠单抗组的ORR、mPFS、mOS分别为38%、7.2个月、NR,化疗+ICIs组的ORR、mPFS、mOS分别为33%、6个月、NR,靶向药组的ORR、mPFS、mOS分别为50%、11.3个月、15.5个月(表6)。靶向药组的mPFS长于化疗±贝伐珠单抗组及化疗+ICIs组,但差异无统计学意义(P=0.364 3,图5B)。一线治疗的mOS未达到(图5C),各治疗组间mOS两两比较差异无统计学意义(图5D)。二线治疗中靶向药治疗6人,mPFS 为12.3个月。

表4 HER2突变肺腺癌患者不同治疗方案的ORR、PFS和OS [例(%),M(Pmin, Pmax)]

表5 RET融合基因肺腺癌患者不同治疗方案的ORR、PFS和OS [例(%),M(Pmin, Pmax)]
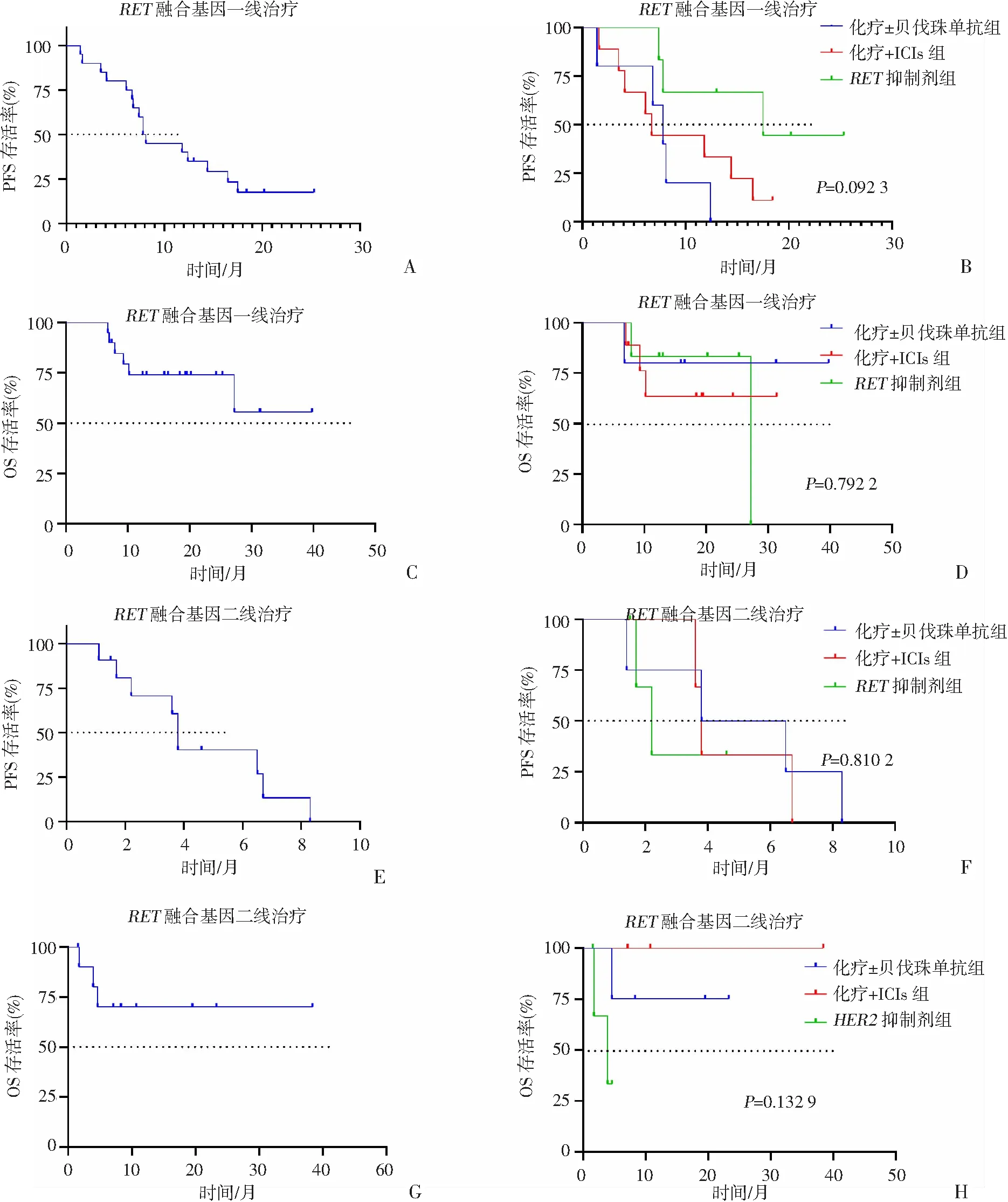
A、E:一、二线治疗总体PFS;B、F:一、二线治疗不同治疗方案的PFS;C、G:一、二线治疗总体OS;D、H:一、二线治疗不同治疗方案的OS

表6 EGFR 20-ins突变肺腺癌患者不同治疗方案的ORR、PFS和OS [例(%),M(Pmin, Pmax)]
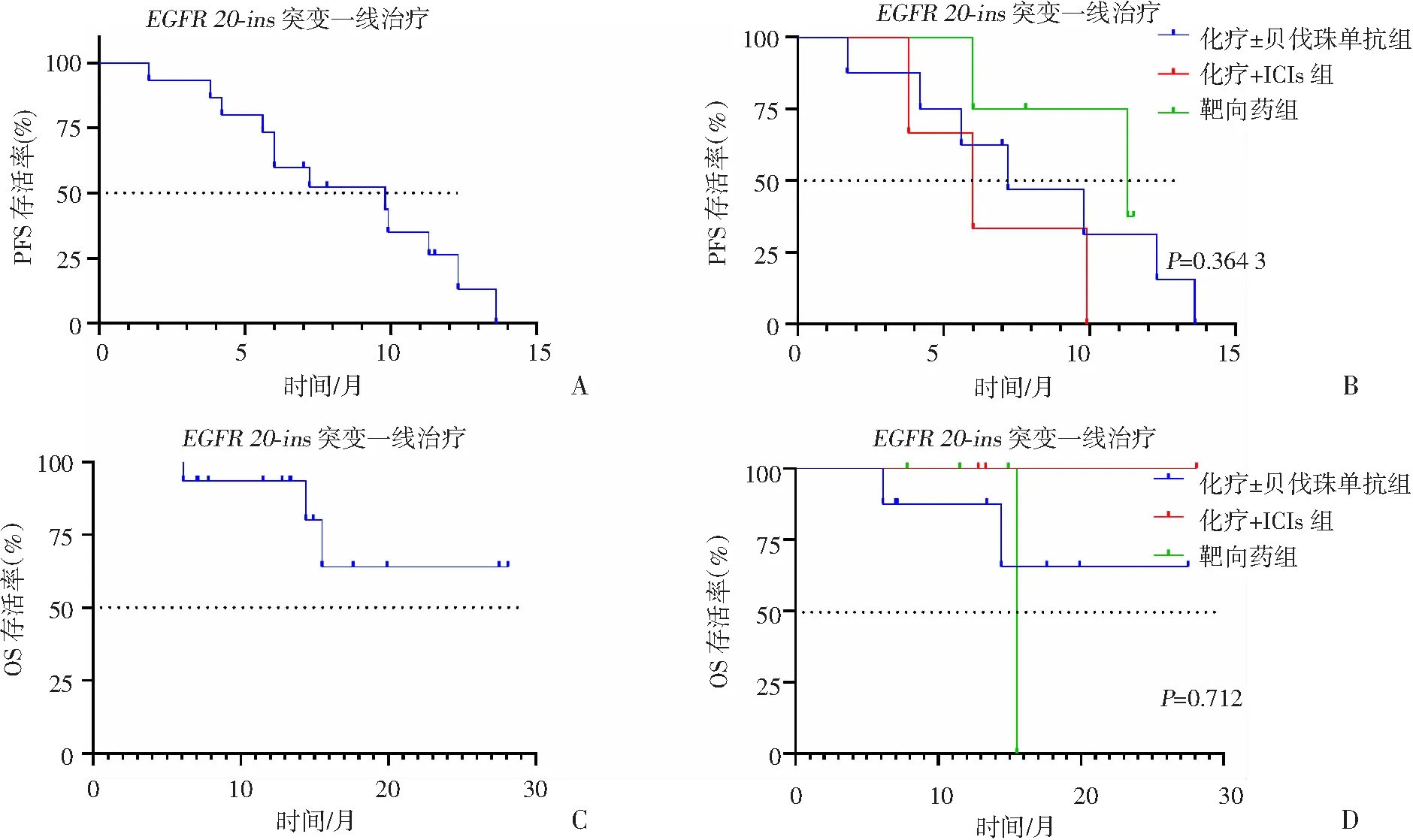
A:一线治疗总体PFS;B:一线治疗不同治疗方案的PFS;C:一线治疗总体OS;D:一线治疗不同治疗方案的OS

表7 不同基因突变的肺腺癌患者接受靶向治疗的不良反应
2.6 不良反应
共记录了24条与靶向治疗相关的不良反应,多为1~2级。在使用塞尔帕替尼的患者中,1例出现3级肠穿孔,另1例出现3级高血压;在使用莫博替尼的患者中,1例出现3级皮疹。各靶向药物相关不良反应见表7。
3 讨论
3.1 BRAF V600E突变晚期肺腺癌患者治疗探索
BRAF突变大多发生在肺腺癌,占所有NSCLC病例的3%左右,BRAFV600E突变约占BRAF突变的50%[6]。BARLESI等[7]报道262例BRAF突变患者,61%为男性,25%从不吸烟,87%为腺癌。AULIAC等[8]的研究提示13%的BRAF突变患者在确诊时存在脑转移。本组病例中,57%为男性,64%为非吸烟者,21%的患者存在脑转移。脑转移率高于上述研究,考虑和我们统计的全为BRAFV600E突变晚期病例有关。
一项多中心的回顾性研究显示,携带BRAFV600E突变的晚期NSCLC患者接受达拉非尼联合曲美替尼一线治疗的mPFS为16.8个月(95%CI:6.1~23.2),mOS为21.8个月(95%CI:1.0~NR)[8]。在另一项研究中,达拉非尼联合曲美替尼一线治疗的ORR为63.9%,mPFS为10.8个月(95%CI:7.0~14.5),mOS为17.3个月(95%CI:12.3~40.2)[9]。在本研究中,一线双靶向治疗的ORR为75%,mPFS 为15.8(5.7~22.7)个月,mOS为23.2 (8.6~23.2)个月,这一数据与其他研究结果具有可比性。
对于免疫治疗,在GUISIER等[10]的一项以抗PD1/PDL-1作为二线或后线治疗的研究中,ORR为26.1%,mPFS为5.3个月(95%CI:2.1~NR),mOS为22.5个月(95%CI:8.3~NR)。在DUDNIK等[11]的研究中,免疫治疗的ORR为25%,mPFS为3.7个月(95%CI:1.6~6.6),mOS未达到(95%CI:2.1~NR)。在本研究中,一线化疗联合免疫治疗的ORR为75%,mPFS和mOS分别为4.7 (3.2~21.1)和17.6(5.5~29.1)个月,ORR明显高于另外研究,考虑和合并含铂化疗及样本量小(n=4)有关,但mPFS和mOS与前两个研究相比无明显优势。
在本研究中,一线达拉非尼-曲美替尼组的mPFS优于化疗±贝伐珠单抗组及化疗+ICIs组,但由于样本量的限制,差异无统计学意义(15.8vs.6.3vs.4.7个月,P=0.426 5)。双靶向治疗可能是BRAFV600E突变肺腺癌患者的最有效治疗手段。为了完全剖析靶向治疗、一线化疗或基于免疫治疗的治疗策略的疗效差异,有必要进行更大规模的前瞻性研究。
3.2 HER2突变晚期肺腺癌患者治疗探索
HER2基因突变主要包括突变、扩增和过度表达,在NSCLC中发生率<5%,大多数为腺癌,多数为女性及不吸烟者[12-14]。在我们的队列中,64%为女性,77%的患者从不吸烟,14%在确诊时存在脑转移。
SAALFELD等[13]此前报道称,HER2阳性NSCLC患者一线化疗联合免疫治疗的ORR为52%,mPFS为6个月(95%CI:6~14),mOS约为36个月;二线及后线单免疫治疗的ORR为16%,mPFS为4个月(95%CI:4~6),mOS为10个月(95%CI:6~NR)。在我们的队列中,一线化疗+ICIs治疗的ORR为64%,mPFS为8.7 (2.2~26.8)个月,mOS为26.8 (9.0~26.8)个月,与SAALFELD的研究具有可比性;二线化疗+ICIs治疗的mPFS为8.5 (3.4~11.7)个月,明显长于SAALFELD的研究,考虑和我们的治疗联合化疗有关。
在HER2抑制剂方面,WANG等[15]及ZHOU等[16]的研究提示接受吡咯替尼治疗的HER2阳性NSCLC患者mPFS为6.4~6.9个月,mOS为12.9~14.4个月。而在我们的研究中,接受HER2抑制剂作为一线治疗的3例患者的mPFS为2.9 (2.5~3.9)个月,作为二线治疗的4例患者的mPFS为4.5(1.4~6.5)个月,均小于上述另两个研究,考虑和样本量少、部分患者存在合并突变有关(1例合并ROS1突变,1例合并ROS1及TP53突变)。今后我们将进一步扩大样本量以验证HER2抑制剂的临床疗效。
在我们的研究中,一线化疗+ICIs组的mPFS优于化疗±贝伐珠单抗组及HER2抑制剂组,差异有统计学意义(8.7vs.5.2vs.2.9个月,P=0.013 5)。因此,化疗+ICIs可能仍是HER2阳性肺腺癌患者的首选治疗方案。
近年来,抗体偶联药物(ADC)在HER2基因突变NSCLC的研究上取得了积极的进展[17-18]。在LI等[19]的研究中,91例化疗进展后患者接受德喜曲妥珠单抗治疗,mPFS为8.2个月(95%CI:6.0~11.9),mOS为17.8个月(95%CI:13.8~22.1)。在我们的研究中,3例患者接受ADC作为四、五线治疗,其中2例分别取得8及11.5个月的PFS,且目前均未进展。FDA已经批准德喜曲妥珠单抗用于转移性HER2突变NSCLC患者的突破性治疗[20]。
3.3 RET融合基因晚期肺腺癌患者治疗探索
RET融合基因在NSCLC中发生率很低(0.7%~2%),以腺癌为主,多数为不吸烟者及女性,诊断时常伴脑转移[21-23]。在我们的队列中,65%为女性,80%从不吸烟,确诊时脑转移发生率为10%。
GLORY全球研究中,接受铂类+培美曲塞化疗患者的ORR为49%,mPFS为6.4个月(95%CI:4.3~8.8),mOS为23.6个月(95%CI:13.4~33.2)[24]。GFPC 01-2018研究报道单免疫治疗患者的ORR为38%,mPFS为7.6个月(95%CI:2.3~NR),mOS 未达到(95%CI:26.8~NR)[10]。在我们的队列中,一线化疗±贝伐珠单抗治疗患者的mPFS为7.8 (2.0~12.4)个月, mOS未达到;一线化疗+ICIs治疗患者的mPFS为6.7(2.0~18.4)个月,mOS未达到,与上述研究数据均有可比性,且两组mPFS相当,差异无统计学意义(P=0.489)。可见对比化疗,免疫治疗在RET融合阳性肺腺癌患者中无明显优势。
相较于化疗及免疫治疗,RET抑制剂在研究中取得了不俗的疗效。全球多中心的ARROW临床研究显示,普拉替尼一线治疗的ORR为72%,mPFS为13.0个月(95%CI:9.1~NR);含铂化疗进展后二线治疗的ORR为59%,mPFS为16.5个月(95%CI:10.5~24.1)[25]。塞尔帕替尼全球性临床研究LIBR ETTO-001显示,含铂化疗进展后二线治疗的ORR为57%,mPFS 为19.3个月(95%CI:16.5~NR)[26]。在我们的队列中,一线接受RET抑制剂治疗患者的ORR为83%,mPFS为17.5(7.4~25.3)个月,与上述研究具有可比性。
在我们的研究中,一线治疗RET抑制剂组的mPFS长于化疗±贝伐珠单抗组及化疗+ICIs组,差异无统计学意义(17.5vs.7.8vs.6.7个月,P=0.092 3)。RET抑制剂可能是RET融合基因晚期肺腺癌患者的最有效治疗手段。
3.4 EGFR 20-ins突变晚期肺腺癌患者治疗探索
EGFR20外显子插入突变是EGFR突变的第三大常见类别,占所有EGFR突变NSCLC的5%~12%,约占所有肺腺癌的2%,更常见于女性及非吸烟者[27-28]。在我们的队列中,53%的患者不吸烟,73%为男性,与上述研究相左,考虑与样本量过少以及选择性偏差有关。
据美国癌症电子病历Flatiron Health数据库记录,化疗及化疗联合方案是EGFR20-ins突变NSCLC患者最常用的一线治疗方案。该记录显示,一线单纯化疗患者ORR为19.5%,mPFS为5.7个月(95%CI:3.0~10.9),mOS为17个月(95%CI:10.5~33.2);一线含铂化疗联合免疫治疗患者的ORR为18.8%,mPFS为4.5个月(95%CI:1.2~10.3),mOS为11.3个月(95%CI:5.6~NR)[29]。GIRARD等[30]记录了59例患者接受一线免疫治疗,mPFS为3.7个月(95%CI:3.0~4.9),mOS为10.9个月(95%CI:5.2~14.3)。在我们的研究中,一线化疗±贝伐珠单抗组和化疗+ICIs组的mPFS分别为7.2、6.0个月(P=0.48),两组mOS均未达到。上述不同研究中,化疗组mPFS及mOS均不同程度长于免疫组,但可惜在我们的队列中两者差异无统计学意义,需进一步扩大样本量并结合PD-L1水平的对照研究来明确哪种方案更优。
与携带“经典”EGFR突变相比,传统酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)在EGFR20-ins突变人群中的疗效不理想[31]。埃万妥单抗和莫博替尼是EGFR20-ins突变肺癌的选择性靶向药物。CHRYSALIS I期临床研究显示埃万妥单抗在含铂化疗进展后的患者中取得40%的ORR,8.3个月(95%CI:6.5~10.9)的mPFS及22.8个月(95%CI:14.6~NR)的mOS[32]。另一项临床研究显示莫博替尼在EGFR20-ins突变NSCLC患者中取得35%的ORR,7.3个月(95%CI:5.5~9.2)的mPFS及24.0个月(95%CI:14.6~28.8)的mOS[33]。在我们的研究中,一线靶向治疗的mPFS为11.3(6~11.5)个月,二线靶向治疗的mPFS为12.3 (2.7~12.3)个月,均长于上述另2个研究,考虑与样本量小、具体基因插入位点不同及随访时间短mPFS不够成熟有关。
EGFR20-ins突变具有异质性,不同插入位点基因突变对靶向药的反应不同[27],在我们的队列中,一线靶向药组的mPFS长于化疗±贝伐珠单抗组及化疗+ICIs组,虽差异无统计学意义(11.3vs.7.2vs.6.0个月,P=0.364 3),但表明选择性靶向药对EGFR20-ins突变肺腺癌的疗效是值得肯定的。
综上所述,我们的数据表明靶向治疗可能对BRAFV600E突变、RET融合基因晚期一线肺腺癌患者更有效,而化疗联合免疫治疗可能是目前HER2阳性晚期肺腺癌患者的最佳治疗方案。但是由于本研究进行的是肺腺癌罕见突变的回顾性研究,纳入病例数较少,因此在未来我们需要进一步扩大入组的患者例数来验证研究结果,甚至我们将会开展前瞻性研究来探索晚期肺腺癌罕见突变患者的最佳临床治疗方案。

