贵州部分地区规模猪场链球菌和多杀性巴氏杆菌的耐药性分析
黄忍,张定练,肖驰
(广东天农食品集团股份有限公司,广东 清远 511500)
猪链球菌病是由多种不同血清型链球菌(Streptococcosis suis,SS)感染引起的,主要以淋巴结脓肿、脑膜炎、关节炎及败血症状为主要临床特征[1]。通过荚膜抗原可将链球菌分为35个血清亚型,其中猪二型链球菌(Streptococcus suistypeⅡ,SS2)是猪体内最常分离到,也是致病力最强的菌株[2]。SS2不仅导致猪急性败血症、脑膜炎、关节炎、心肌炎和急性死亡的发生,且可感染人并致死,为人兽共患性传染病。因此其不仅可给全球养猪业造成重大经济损失,而且严重威胁食品安全和人类健康[3]。
多杀性巴氏杆菌是一种革兰氏阴性小杆菌,通常存在于健康动物的上呼吸道中,被认为是一种机会性致病菌[4]。多杀性巴氏杆菌具有广泛的感染宿主,可引起牲畜、家禽和野生动物的多种疾病,包括猪、牛、小反刍动物和兔子的肺炎、牛的急性败血症、家禽的禽霍乱和猪的萎缩性鼻炎[5]。此外,多杀性巴氏杆菌为人兽共患性传染病原,严重时可导致人菌血症的发生。多杀性巴氏杆菌主要引起猪萎缩性鼻炎和猪肺疫两种疾病[6]。这两种疾病均可导致猪生长缓慢和饲料转化率降低,给养猪业造成巨大的经济损失。
抗生素是治疗这两种疾病的有效方法,但由于抗生素的滥用,细菌极易产生耐药性,导致治疗的失败。本研究对2021年从贵州省黔南州、遵义市、贵阳市三个地区7个规模化猪场分离到的4株多杀性巴氏杆菌和6株猪二型链球菌进行耐药性分析,以期为这两种病的有效防治及减少耐药性的产生提供参考和依据。
1 材 料
1.1 菌株
试验用猪源多杀性巴氏杆菌和猪二型链球菌,从贵州省黔南州、遵义市、贵阳市三个地区7个规模化猪场的病死猪肺脏病料经分离鉴定获得,菌株由贵州日泉农牧有限公司实验室保存。
1.2 主要试剂
胰蛋白胨大豆琼脂培养基(TSA)和胰蛋白胨大豆肉汤培养基(TSB),购自青岛海博生物技术有限公司;猪链球菌2型荧光PCR检测试剂盒和猪多杀性巴氏杆菌荧光PCR检测试剂盒,购自广州悦洋生物技术有限公司;青霉素、阿莫西林、氨苄西林、头孢曲松、头孢他啶、头孢拉啶、多西环素、庆大霉素、卡那霉素、新霉素、恩诺沙星、诺氟沙星、复方新诺明、克林霉素、多黏菌素B、氟苯尼考,购自杭州四季青公司。
1.3 主要仪器
PCR仪(CFX96 Touch),美国伯乐有限公司;超净工作台(PCR-2A),苏洁医疗器械(苏州)有限公司。
2 方法
2.1 菌种复苏、革兰氏染色镜检鉴定
将实验室保存的菌种用含5%马血清TSA培养基和血平板进行培养,培养条件为37℃、12~18 h。菌种复苏后观察菌落形态,进行革兰氏染色镜检。
2.2 PCR鉴定
使用商业化试剂盒对分离菌株进行RT-PCR鉴定。
2.3 药敏试验
按美国临床与实验室标准化协会推荐的K-B法对分离菌株进行16种抗生素药物敏感性试验,试验结果按照美国临床与实验室标准协会编制的抗微生物药物敏感性试验执行标准手册[7]要求进行判读。
3 结果与分析
3.1 菌落形态及染色镜检结果
4株菌株在血平板上呈现β溶血环,形成表面光滑、边缘整齐、无色透明的针尖状小菌落,且4株菌株革兰氏染色镜检均为两端钝圆、单个、散在排列的阴性短杆菌(见图1)。将这4株菌株分别命名为TN-1、TN-2、TN-3、TN-4。6株菌株在血平板上呈现α溶血环,形成表面光滑、边缘整齐、乳白色小菌落,且6株菌株革兰氏染色镜检均呈二联或四联革兰氏阳性球菌。将这6株菌株分别命名TN-5、TN-6、TN-7、TN-8、TN-9、TN-10。
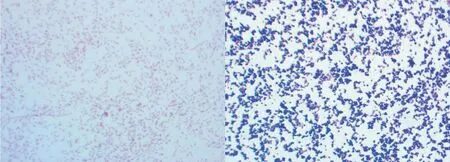
图1 分离的革兰氏阴性短杆菌(左)和革兰氏阳性球菌(右)
3.2 分离菌qPCR检测结果
采用猪源多杀性巴氏杆菌和猪二型链球菌RTPCR检测试剂盒对10株菌株进行RT-PCR检测。检测结果显示,TN-1、TN-2、TN-3、TN-4为猪源多杀性巴氏杆菌,TN-5、TN-6、TN-7、TN-8、TN-9、TN-10为猪二型链球菌。
3.3 药敏试验结果
共检测4株猪源多杀性巴氏杆菌和6株猪二型链球菌对9大类16种抗菌药物的敏感性,药敏试验结果表1和表2。从表1可知,4株多杀性巴氏杆菌对克林霉素耐药率为100%,对庆大霉素、卡那霉素、新霉素、诺氟沙星的耐药率为75%,耐药情况十分严重。对青霉素、氨苄西林、多西环素、复方新诺明、氟苯尼考耐药率为50%,耐药情况较为严重。对多黏菌素B和头孢类抗生素敏感。从表2可知,6株猪二型链球菌对青霉素、头孢他啶、头孢拉啶、多西环素、庆大霉素、卡那霉素、新霉素、恩诺沙星、克林霉素、氟苯尼考完全耐药,对氨苄西林、阿莫西林、诺氟沙星、复方新诺明和多黏菌素B耐药较为严重。对三代头孢头孢曲松耐药率为33.3%,现阶段仅有三代头孢较为敏感,多数菌株表现为多重耐药。

表1 4株猪多杀性巴氏杆菌对14种抗生素的药敏试验结果
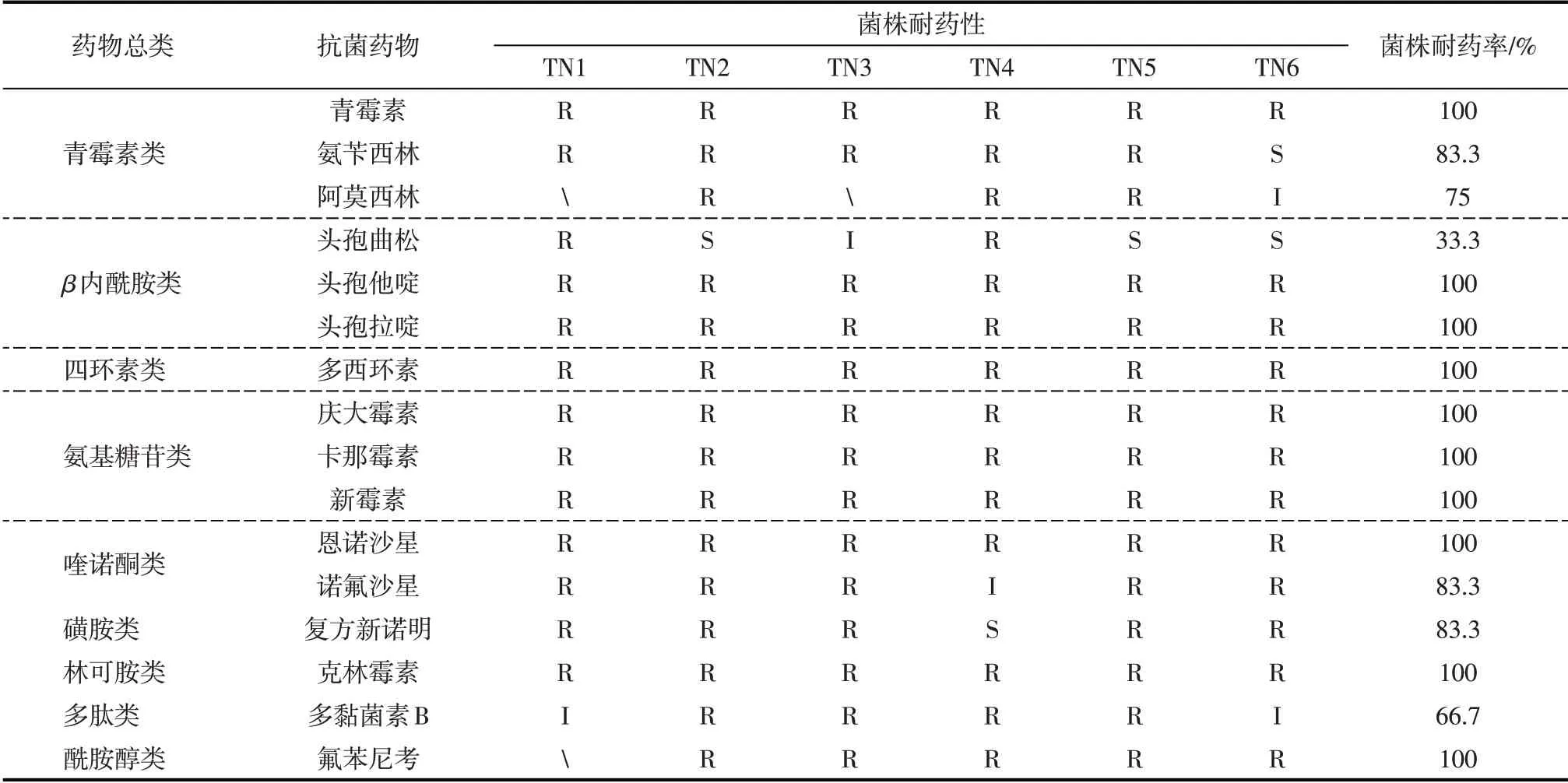
表2 6株猪2型链球菌对16种抗生素的药敏试验结果
4 讨 论
随着养猪规模不断扩大,养猪大集团产能不断增加,引种和生猪交易频繁进行,将会增加疾病的发生率。并且疾病的发展也会越来越复杂,为了保证猪群的健康,预防和治疗性用药也会越来越频繁[8]。虽然在一段时间、一定程度上对疫病起到了控制作用,但是很多时候的无效用药和长期用药都会增加耐药菌株的产生。特别是母猪群出现大面积耐药的情况下,保育、育肥至出栏的猪可选择的药物会越来越少。随着耐药性的增加和药效的减弱,药物使用剂量也会越来越大,成本也会增加。
本研究前期对贵州地区呼吸道疾病死亡和急性死亡猪只进行解剖采集肺脏组织。经过细菌分离、染色镜检、qPCR检测等技术,发现了猪源多杀性巴氏杆菌和链球菌为致猪死亡的主要病原菌,对这几个猪场而言,致病性细菌是引起呼吸道疾病和急性死亡的主要病原菌,其中又以猪源多杀性巴氏杆菌和猪二型链球菌为主。
本研究对分离到的4株猪源多杀性巴氏杆菌和6株猪二型链球菌进行了药敏检测,发现均存在多重耐药现象。4株猪源多杀性巴氏杆对β内酰胺类和多肽类药物较为敏感,对氨基糖苷类和喹诺酮类药物严重耐药,对青霉素类、四怀素类、磺胺类和酰胺醇类抗生物耐药较为严重。6株猪二型链球菌对青霉素、头孢他啶、头孢拉啶、多西环素、庆大霉素、卡那霉素、新霉素、恩诺沙星、克林霉素、氟苯尼考完全耐药,对氨苄西林、阿莫西林、诺氟沙星、复方新诺明和多黏菌素B耐药较为严重。三代头孢头孢曲松耐药率为33.3%,现阶段仅有三代头孢较为敏感。多数菌株表现为多重耐药。因此对猪二型链球菌而言,耐药程度已经很高。
通过对这几个养猪场的走访发现,猪场长期并且仅使用大环内酯类的泰万和泰乐菌素,青霉素类的青霉素和阿莫西林,β-内酰胺类的头孢噻夫,酰胺醇类的氟苯尼考,林可胺类的克林霉素。并且上游母猪场也长期并且仅使用以上药物。此外,发现这些猪场缺少兽医的指导,缺乏针对性用药策略,长期开大处方,长期低剂量长时间进行药物保健。因此,一系列的不规范操作导致了猪场发生严重耐药。在了解了猪场用药和疾病背景的情况下,有针对性地开展了药物敏感性试验,同时确保猪群吃到足量的药物是很关键的,长期低剂量使用药物不仅达不到治疗效果还会导致细菌耐药的产生。
基于此案例,为了避免耐药菌株的持续出现,猪场应该根据猪群的临床症状,严格控制药物的使用,通过药物敏感试验严格筛选敏感药物用于疾病的预防和治疗[9]。同时在日常管理中,加强猪场生物安全防控工作,做好猪群的免疫和免疫监测,提高猪群抵抗力,减少不良诱因继发细菌性疾病的发生,降低经济损失。

