新生SD大鼠心房肌细胞的原代培养及改良
汪尊冬 李蔚 曾臻 胡永胜 刘维琴
在心血管疾病的基础研究中,常用的动物模型包括动脉粥样硬化模型[1]、心房颤动模型[2]、心肌缺血模型[3]等。除动物模型外,细胞模型可以排除动物体液、神经等因素对实验的干扰,能更直观地展示疾病对心血管组织的影响。心肌细胞可分为心房肌细胞与心室肌细胞,目前被大多数学者所认可的永生型心室肌细胞为H9C2[4],心房肌细胞系为HL-1[5],但是HL-1 培养条件复杂,在国内市场销售较少,且售价昂贵。本研究旨在探索并改良体外原代培养心房肌细胞的方法。
1 材料与方法
1.1 实验动物
出生1~3 d 的SD 乳鼠15 只,雌雄不拘,由贵州中医药大学动物中心提供。
1.2 方法
1.2.1 心房肌细胞的提取及纯化 所有操作均在超净台进行。(1)取1~3 d 的SD 乳鼠,用75%酒精浸泡约10 s;(2)采用“三指法”提捏乳鼠,用眼科剪从胸骨旁剪出约1 cm 切口,挤出心脏,放于提前预冷的D-Hank’s 溶液中;(3)清洗至溶液澄清,并去除血凝块;(4)在体视显微镜下剪除左右心耳、结缔组织、大血管及心室,保留心房组织;(5)将心房组织移入培养皿中,用0.25%胰酶覆盖心房组织,然后用封口膜将培养皿封闭,将培养皿放于4 ℃冷库消化5~6 h;(6)5~6 h 后用与0.25%胰酶消化液等体积的含10%胎牛血清的培养基终止消化,将组织剪碎成1 mm3大小;(7)将组织碎块倒入15 mL 离心管中,加入终浓度为0.1%Ⅱ型胶原酶+0.5%BSA 消化液4 mL,放于37.5 ℃恒温水浴锅中,消化2~3 次可将组织碎块消化干净,每次 12 min,并收集上清;(8)将含细胞的消化液用等体积含10%胎牛血清的培养基终止消化,并用 200 目过滤网滤除组织碎块,收集上清;(9)将收集到的含细胞上清液离心,1 000 转/min,5 min;(10)离心后去除上清,用含10%胎牛血清的培养基吹散细胞沉淀,将含细胞的培养基移入直径 60 mm 的培养皿中,差速贴壁90 min;(11)90 min后将含细胞的培养基移入50 mL 离心管中,使用细胞计数板计数,以1×106/mL 种植细胞,种植前加入Brd U,使Brd U 终浓度为0.1 mmol/L,以抑制成纤维细胞生长;(12)36~48 h 后更换为不含Brd U 的正常含血清培养基,显微镜下观察。
1.2.2 免疫荧光鉴定 72 h 后细胞铺满细胞爬片约80%,将细胞爬片取出。用PBS 清洗细胞爬片后,4%多聚甲醛固定爬片15 min;然后用0.5%Triton X-100 室温通透细胞爬片,用山羊血清封闭细胞爬片30 min;孵育一抗(小鼠抗大鼠α-actin 1∶100;兔抗大鼠肌钙蛋白T 1∶100),4℃孵育过夜。第二天用PBS 清洗细胞爬片,加入荧光二抗(FITC-羊抗小鼠IgG 1∶100;CoraLite594 conjugate-羊抗兔IgG 1∶100),37 ℃孵育1 h;复染细胞核,滴加DAPI 避光孵育5 min(从滴加荧光二抗开始,后续步骤均要避光操作);最后滴加抗荧光淬灭剂,用倒置荧光显微镜观察并采集图像。
2 结果
36 h 后镜下可见细胞已经贴壁,贴壁细胞形状不一,有梭形、三角形,还有一部分形状不规则(见图1),少数细胞出现自发搏动;72 h 细胞聚合成片,细胞搏动逐渐同步。72 h 后细胞铺满细胞爬片约90%,可用于免疫荧光鉴定与HE 染色观察细胞形态(见图2)。阳性细胞(心房肌细胞)可表达α-actin蛋白与心肌肌钙蛋白T,同时用DAPI 复染细胞核,可观察阳性细胞占总细胞的百分比,结果表明心房肌细胞占总细胞数超过95%(见图3)。

图1 心房肌细胞培养36 h(×100)
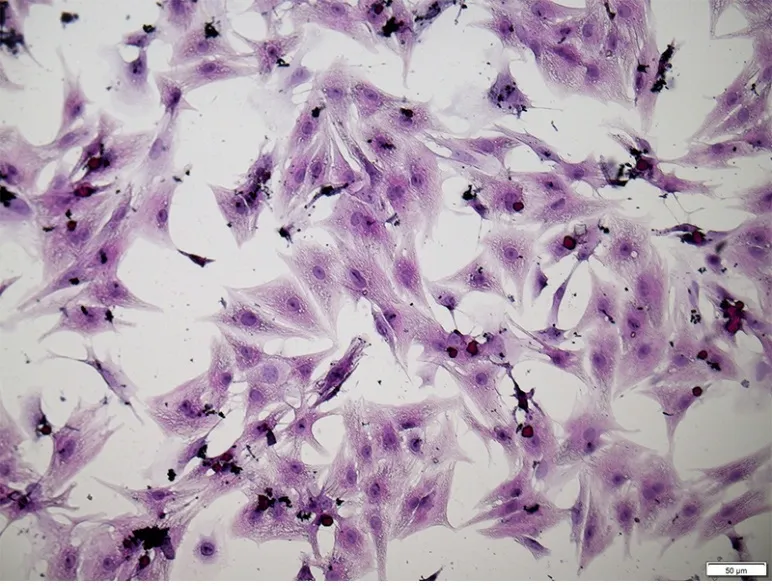
图2 心房肌细胞培养72 h后HE染色(×200)
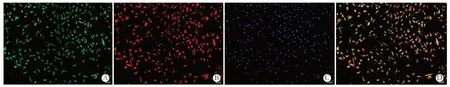
图3 培养细胞免疫荧光鉴定(×100)
目前多数文献采用“两步法”提取心肌细 胞[6-7],使用0.25%胰酶4 ℃消化心肌组织过夜,第二天继续用胶原酶消化细胞。本研究也尝试分别使用0.25%以及0.125%胰酶消化心肌组织过夜,但是过夜时间难以控制。实验结果显示,72 h 后镜下见过夜消化的心肌细胞较使用0.25%胰酶4 ℃消化5~6 h 所获得的心肌细胞明显减少(见图4)。
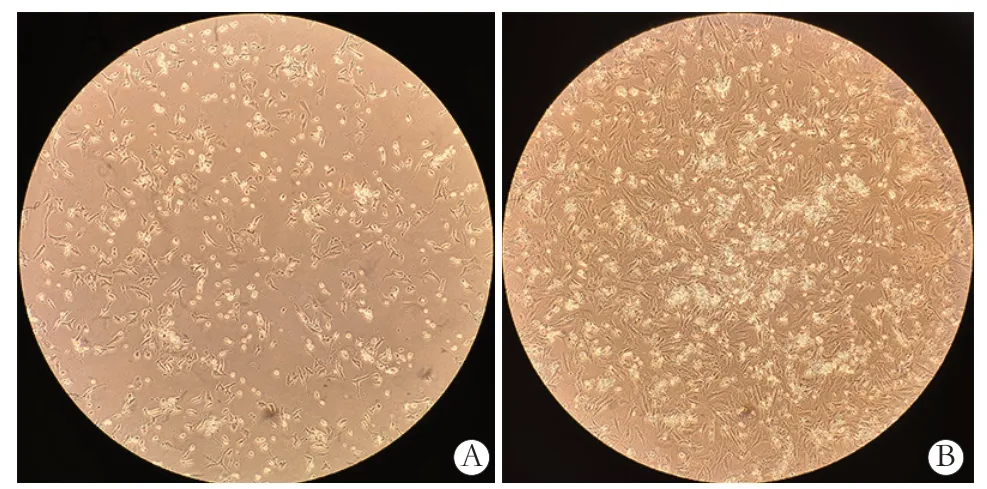
图4 不同消化法消化后心房肌细胞培养72 h(×100)
3 讨论
心肌细胞的体外培养是心血管疾病研究的基本技术,市场上虽有H9C2、HL-1 出售,但是永生化细胞的某些生理特性与原代提取的心肌细胞存在差异。在研究心肌细胞的电生理、信号转导以及药物毒性等,通常需要原代培养的纯度较高、活力较好心肌细胞。本研究(两步法提取原代心肌细胞)在现有文献方法的基础上加以改进,明显提高了细胞的收获率。
本研究的创新点在于将胰酶联合胶原酶同时消化心肌组织(一步法)改为“两步法”,同时提高胰酶浓度而缩短胰酶消化时间。目前较多的文献采用“一步法”提取心肌细胞[8-10]。当使用胰酶和(或)Ⅱ型胶原酶混合同时进行消化时,消化时间难以掌握,若消化过度则容易使细胞中的DNA与胶原混合,形成黏液状物质,使含细胞的上清液难以从消化体系中分离,细胞量明显减少而影响细胞收获率。而使用“两步法”提取原代心肌细胞则可明显减少黏液状物质,当将心房组织放置于4 ℃环境中消化时,0.25%的胰酶可以缓慢消化组织,使得心房组织变得疏松,再使用Ⅱ型胶原酶消化时可以迅速消化细胞间的胶原纤维,大大提高细胞收获率。王伟等[10]采用两次差速贴壁(45 min/次)分离成纤维细胞。本研究初期使用两次差速贴壁,发现第二次差速贴壁所获得的成纤维细胞甚少,故采用90 min 差速贴壁分离成纤维细 胞[10]。一次差速贴壁联合0.1 mmol/L Brd U 可明显减少成纤维细胞的含量,较两次差速贴壁明显降低了提取成本。
本研究的另一个创新点是Ⅱ型胶原酶与BSA的联合使用,BSA 可以降低消化酶对细胞的损伤,提高细胞的活性。此外,可以先将Brd U 配制成 10 mmol/L 溶液,待差速贴壁完成后,按1 mL 含细胞培养基加10 μLBrd U,可以减少离心次数,降低细胞损伤,提高细胞活力。鉴定方面,大多数研究只采用α-actin 蛋白荧光染色鉴定[9-11],Burstein 等[12]在实验中发现,有95%首代的成纤维细胞表达α-actin 蛋白,故本研究采用α-actin 蛋白联合心肌肌钙蛋白T 的双荧光法鉴定。
综上所述,采用“两步法”(使用0.25%胰酶4 ℃消化心房肌组织5~6 h,然后用0.1%Ⅱ型胶原酶+0.5%BSA 消化液消化心房组织)可更有效地培养原代心房肌细胞。

