肺炎链球菌热休克蛋白40在诱导树突细胞成熟中的作用
刘敬敬,陈 雷
(厦门市儿童医院,福建 厦门 361006)
肺炎链球菌(S.pn)又称肺炎双球菌,可引起急性肺泡炎症性疾病,健康人鼻咽部70%以上存在S.pn。正常情况下S.pn无致病性,当机体防御功能减退、抗病能力减弱、球菌毒力和致病力增强时可引发伴有寒战高热、咳嗽、咯血痰、胸痛、呼吸困难等症状的肺炎,严重情况下可发展为脑膜炎、败血症等侵入性疾病[1]。在机体内,S.pn 可加速活化被抗原提呈细胞(APC),将抗原肽递呈给T 细胞,启动适应性免疫应答。肺炎链球菌热休克蛋白40又称Dna J,是分子伴侣的一种,该蛋白为S.pn的一种毒力因子,参与细胞免疫应答机制[2]。树突细胞(DCs)是机体专职呈递抗原的细胞,分为未成熟DCs(iDCs)和成熟DCs(mDCs)两大类,其中mDCs与促炎性细胞因子水平、病情严重程度密切相关[3]。研究表明,CD11c是一类高表达于DCs的表面分子,DCs及B淋巴细胞表面的主要组织相容性复合体Ⅱ型分子(MHCⅡ)在细胞完成抗原呈递,活化CD4+的T淋巴细胞中发挥重要作用。Shin等发现,iDCs成熟过程中,MHCⅡ会从晚期内含体和溶酶体中释放并迁移至质膜,可见,在iDCs中MHCⅡ主要存在于细胞内,而在mDCs中却大量表达于细胞质膜上。Chan等报道,随着DCs的成熟,IL-12的分泌是增加的,IL-12不仅可以促进DCs数量的增加,而且还会促进成熟[4-5]。研究表明,DCs细胞质膜上MHCⅡ和共刺激分子含量的增加意味着活力的增强,可促进DCs的成熟[6]。Dna J与DCs的成熟相关,但在成熟过程中的免疫应答机制尚不清楚。本文通过试验研究分析DnaJ诱导单核细胞来源DCs成熟过程中细胞表面分子的表达情况,探讨DnaJ在机体免疫应答中的作用机制。
1 资料与方法
1.1研究对象:我院检验科体检的0~18岁健康儿童。本次研究经过本院医学伦理委员会同意。
1.2主要仪器及试剂:电子天平(梅特勒-托利多,ME203E/02);细胞培养箱(Thermo,BC-J80S);流式细胞仪(贝克曼公司 FACS,Calibur); 胎牛血清(Gibco,1640958);RPMI1640细胞培养基(上海微科生物,S00000L0500);重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)(上海恒斐生物科技有限公司,415-ML-050);重组小鼠白细胞介素-4(rmIL-4)(上海玉博生物,CYT-282);异硫氰酸荧光素(FITC)标记的抗CD11c抗体、藻红蛋白(PE)标记的人类白细胞DR抗原(HLA-DR)、CD11c、CD86抗体、外周血单个核细胞分离试剂盒均来源于北京博奥森生物科技有限责任公司。
1.3方法
1.3.1Dna J的制备:①肺炎链球菌rHSP40基因合成:密码子优化软件MaxCodon TM Optimization Program (V13)对提供的肺炎链球菌热休克蛋白氨基酸序列进行优化,采用全基因合成方法,限制性酶切位点 NdeⅠ和HindⅢ将肺炎链球菌rHSP40基因插入到表达载体pET30a中,酶切法和测序确认最终表达载体的准确性。②肺炎链球菌rHSP40蛋白诱导表达:将构建的表达载体分别转到 Top10 克隆菌株和 BL21(DE3)表达菌株中,通过异丙基-beta-D-硫代半乳糖吡喃糖苷(IPTG)诱导表达肺炎链球菌rHSP40。③肺炎链球菌rHSP40蛋白纯化:通过亲和层析(Ni-IDA 树脂)纯化肺炎链球菌rHSP40。④肺炎链球菌rHSP40蛋白祛除内毒素:最后通过对甲氧基苄基(PMB)柱去除内毒素,获得目标蛋白。
1.3.2DCs的诱导成熟:①外周血单核细胞分离:抽取儿童外周血2 ml于负压采血管,按照外周血单个核细胞分离试剂盒说明书提取外周血单个核细胞。②DCs培养: 10%胎牛血清(FBS)的1640完全培养基(内含刺激因子浓度为15ng/ml的rmGM-CSF和rmIL-4)培养细胞,细胞计数板计数浓度为5×105/ml后接种于6孔培养孔板,每孔体积为4 ml。37℃、5%CO2饱和湿度的细胞培养箱培养6 h后,轻轻晃动六孔板,吸弃培养液、悬浮、半悬浮细胞,保留贴壁细胞,经PBS洗涤后,每孔加入含10%FBS的RPMI1640完全培养基(内含刺激因子浓度为15 ng/ml的rmGM-CSF和rmIL-4)4 ml继续培养3 d。③DCs诱导成熟:收集培养3 d后体系中的悬浮及半悬浮细胞,1 500 r/min,离心5 min,PBS洗涤,将细胞接种于六孔板,当细胞浓度为 1×107/ml,用15 μg/ml的肺炎链球菌rHSP40对细胞进行刺激,10%FBS的RPMI1640完全培养基(内含刺激因子浓度为5 ng/ml的rmGM-CSF和rmIL-4),37℃、5%CO2培养箱培养16 h,胰酶消化收集细胞。
1.3.3细胞表面分子检测:将FITC标记的抗CD11c抗体、PE标记的抗HLA-DR、CD11c、CD86抗体按照使用说明书进行稀释。收集阴性对照组细胞及rHSP40刺激组细胞1×107个,PBS洗涤1遍,分别加入稀释后抗体,4℃冰箱避光孵育30 min。PBS洗涤2遍,离心除去未吸附抗体。1 ml灭菌移液枪轻柔吹打两组细胞悬液,用流式细胞仪进行分析检测。
2 结果
2.1肺炎链球菌rHSP40基因合成与构建情况:琼脂糖电泳确认质粒基因电泳条带及目的基因电泳条带,见图1目的基因质量控制结果、图2目的基因构建结果。
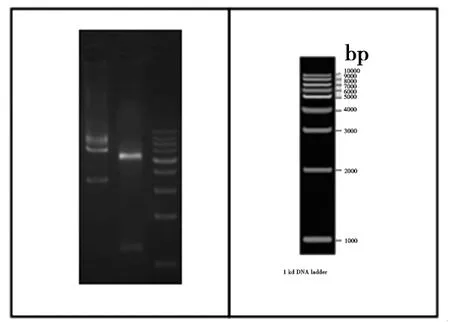
注:泳道1为质粒电泳的基因片段,泳道2为目的基因DT3198电泳基因片段,泳道3为DNA Marker电泳条带

图2 目的基因构建结果图解
2.2肺炎链球菌rHSP40诱导表达结果的鉴定:考马斯亮莉染色法对肺炎链球菌rHSP40蛋白染色鉴定,脱色至背景清晰确定最佳诱导条件。加终浓度0.2 mmol/L IPTG,15℃诱导16 h后可作为诱导条件,用于肺炎链球菌rHSP40放大培养,见图3。
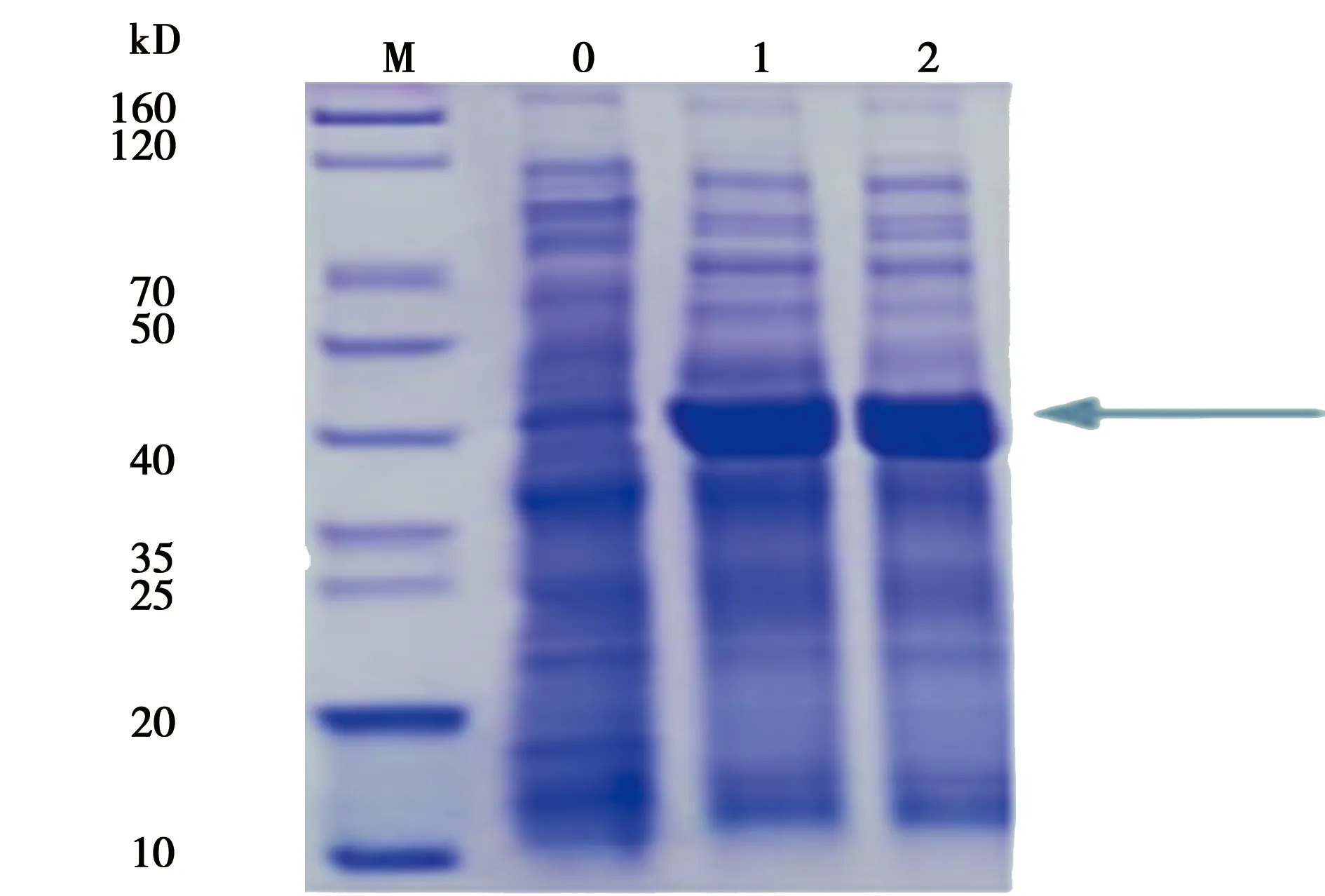
泳道M:蛋白Marker,泳道 0:阴性对照,泳道1:15℃诱导 16 h,泳道2:37℃诱导 16 h
2.3肺炎链球菌rHSP40蛋白纯化:SDS-PAGE 分析经 Ni-IDA 亲和层析纯化,收集纯度相对较高的条带8~10中,将其透析到 1×PBS(pH值8.0)中,下一步尝试 PMB 柱去除内毒素,分析结果见图4。
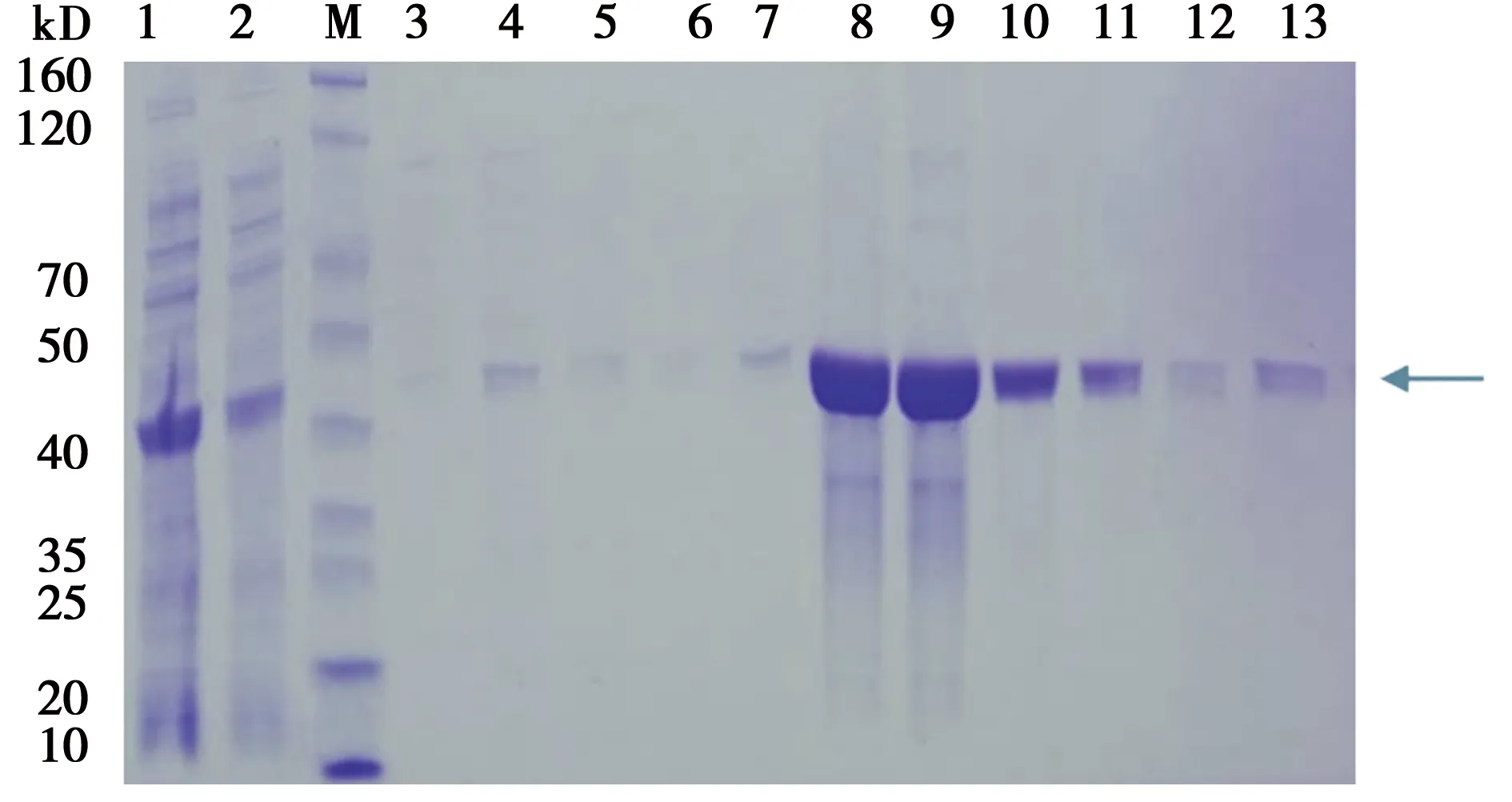
泳道 M:蛋白 Marker;泳道 1:全菌破菌离心后上清;泳道 2:上清同 Ni-IDA 孵育后流出液;泳道 3~7:50 mmol咪唑的洗脱组分;泳道8~10:100 mmol咪唑的洗脱组分;泳道11~13:300 mmol咪唑的洗脱组分
2.4PMB柱去除内毒素结果:通过凝胶法内毒素检测试剂盒测定,得出内毒素去除的实验检测结果浓度:C=3.18 mg/ml(Bradford法测定原始数据),本批鲎试剂灵敏度:λ=0.25 EU/ml;样品中所含内毒素限值:L=1 EU/μg;最大稀释倍数:MVD= C*L/λ;实验结果分析:Chaperone蛋白的内毒素水平<1 EU/μg,结果如下:稀释倍数10、100、1 000结果为凝固;稀释倍数12 000、16 000时,结果为未凝固。
2.5肺炎链球菌rHSP40刺激后的细胞表面分子CD11c、HLADR、CD80及CD86表达情况:肺炎链球rHSP40刺激外周血单个核细胞,10%FBS的RPMI1640完全培养基(内含刺激因子浓度为5 ng/ml的rmGM-CSF和rmIL-4),37℃、5%CO2培养箱培养16 h,收集细胞进行细胞表面分子检测CD11c、HLADR、CD80及CD86表达情况,结果如下图5,结果显示肺炎链球菌HSP40刺激后的细胞表面分子CD11c、HLADR、CD80及CD86高表达。见图5。
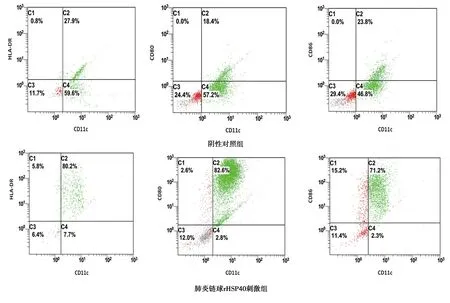
图5 CD11c、HLADR、CD80及CD86表达情况
3 讨论
DCs是机体最主要的专职APC。有研究表明,根据DCs的成熟状态可以将其分为未成熟DCs(iDCs)和成熟DCs(mDCs),CD11c是一类高表达于DCs的表面分子[7-9]。DCs及B淋巴细胞表面的HLA-DR在细胞完成抗原呈递,活化CD4+的T淋巴细胞中发挥重要作用[10-12]。Shin等发现,iDCs成熟过程中,HLADR会从晚期内含体和溶酶体中释放并迁移至质膜,可见,在iDCs中HLADR主要存在于细胞内,而在mDCs中却大量表达于细胞质膜上[13-15]。同时,细胞表面的共刺激分子CD80和CD86是活化效应T细胞的重要第二信号,也与DCs的成熟相关。DCs细胞质膜上HLADR和共刺激分子含量的增加意味着细胞活力的增强[16-17]。研究表明,在感染应激条件下 S.pn 高表达HSP40以适应外界环境变化,HSP40是S.pn 重要的毒力因子,参与细胞免疫应答机制[18]。但HSP40在单核细胞来源的DCs成熟过程中的研究至今在国内外未见报道。本课题旨在通过研究HSP40在诱导儿童外周血单个核细胞来源的DCs成熟过程中细胞表面分子分泌情况,以期指导儿童重症肺炎的治疗。
研究通过肺炎链球菌rHSP40基因合成与构建获得准确的表达载体,将构建好的含有肺炎链球菌rHSP40基因的质粒转化到BL21(DE3)感受态细胞中,通过IPTG诱导表达肺炎链球菌rHSP40,之后通过亲和层析(Ni-IDA树脂)纯化肺炎链球菌rHSP40,最终通过PMB柱去除内毒素获得最终目标蛋白。研究通过培养外周血单个核细胞,培养完成后接种于6孔培养板,分为阴性对照组和实验组,结果显示肺炎链球菌HSP40刺激后的细胞表面分子CD11c、HLADR、CD80及CD86高表达,表明肺炎链球菌HSP40可诱导DCs成熟。
综上所述,肺炎链球球菌HSP40可通过上调外周血单个核细胞表面分子CD11c、HLADR、CD80及CD86表达,诱导DCs成熟。研究通过探讨肺炎链球菌HSP40(HSP40 )在DCs成熟过程中的作用,加强肺炎链球菌的致病机制的进一步的认识,从而为更好地阐明肺炎链球菌致病机制及研发新型疫苗作铺垫。

